
探讨供者来源侵袭性移植肾真菌感染的临床特点,总结临床诊治经验。
回顾性分析2011年2月到2016年1月117例DCD供者供肾移植的临床资料,其中12例受者术后发生供者来源侵袭性移植肾深部真菌感染,12只供肾来源于6例供者。对12例发生真菌感染受者的危险因素和临床表现进行总结。
所有受者均有不同程度的移植肾功能恢复延迟,4例有发热,3例有尿频、尿急、尿痛等泌尿系症状,其余均无特异性临床表现。12例受者发生真菌感染的时间为12~56 d,检出毛霉菌4例、念珠菌属4例及曲霉菌4例,接受同一供者供肾的2例受者均为同一真菌感染;4例死亡(其中2例带移植肾功能死亡),3例移植肾切除后进行了人工血管搭桥术,除带移植肾功能死亡的受者外其余受者均切除了移植肾恢复血液透析。
临床应注意供者来源的真菌感染,高度怀疑时应早期外科干预,保障受者安全。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
公民逝世后器官捐献(DCD)供者多来源于重症监护室(ICU),由于其住院时间长,捐献前多带有气管插管、中心静脉导管及尿管等,容易合并真菌感染[1]。自2011年以来,DCD逐步发展成为我院移植器官来源的最重要组成部分。本研究中,我们统计了我院2011年2月至2016年1月间117例DCD供者供肾移植的临床资料,其中12例受者术后发生了侵袭性移植肾深部真菌感染。我们回顾性分析了供者相关的危险因素,探讨受者真菌感染的诊断和处理等,总结临床诊疗过程中的经验和教训,现报告如下。
12例受者中,男性9例,女性3例,平均年龄36岁(21~58岁);原发病为慢性肾小球肾炎9例,IgA肾病2例,以及糖尿病肾病1例。其中1例受者为2次肾移植,其术前群体反应性抗体(PRA)为26%,其余受者术前PRA均为阴性,移植前淋巴细胞毒交叉配型试验均<10%。
所有DCD供者器官均严格按照《中国心脏死亡器官捐献工作指南》获取,并通过医院伦理委员会审批[2]。12例肾移植术后发生真菌感染的受者,共接受6例供者的12只供肾。6例供者中,男性5例,女性1例,年龄20~58岁;原发病为脑血管意外3例,脑外伤2例,以及原发性癫痫导致缺血缺氧性脑病1例。所有供者均无自主呼吸,使用呼吸机辅助呼吸和留置导尿,5例供者保留有深静脉导管。5例供者在ICU中监护和治疗时间超过2周,1例虽不到2周,但转入ICU前曾应用多种抗生素。
术前2 h常规一次性服用吗替麦考酚酯2.0 g,未行静脉诱导治疗,术中静脉滴注甲泼尼龙1.0 g,术后1和2 d分别给予甲泼尼龙0.5 g,常规抗生素预防细菌感染,或根据供者情况有选择性应用抗生素。免疫抑制剂方案为他克莫司+吗替麦考酚酯+泼尼松。
临床表现为发热、尿频、尿急、尿痛等非特异性感染的症状。血、尿和引流液等培养(多次培养)或者活检组织中发现真菌或菌丝,可确诊为真菌感染,其中组织病理检查为诊断金标准。
12例受者术后发生真菌感染的时间均在术后2个月内(12~56 d),其中术后1个月内发生7例,术后1~2个月发生5例。所有受者均有不同程度的移植肾功能恢复延迟(DGF),4例有发热表现,3例有尿频、尿急、尿痛等泌尿系感染症状,其余均无特异性临床表现。
12例发生真菌感染的受者中,检出毛霉菌4例,念珠菌属4例,以及曲霉菌4例。(1)4例感染毛霉菌的受者中死亡2例,该2例受者的移植肾分别来源于2例供者,1例(毛霉菌1)因移植肾动脉瘤介入治疗后带移植肾功能死亡,经尿培养阳性而确诊;1例(毛霉菌4)切除移植肾后在治疗过程中再次发生大出血死亡;另2例(毛霉菌2、3)在切除移植肾后恢复血液透析治疗。(2)4例曲霉菌感染受者中,1例(曲霉菌1)发生移植肾动脉血栓形成,切除移植肾后因二次出血而死亡;1例(曲霉菌3)在切除移植肾后取自体血管补片成形后再发髂外动脉出血,再次手术切除感染区域髂外动脉,行双侧股动脉人造血管搭桥术;另2例(曲霉菌2、4)在切除移植肾后恢复血液透析治疗。(3)4例念珠菌属感染受者中,1例(念珠菌2)未切除移植肾,后发生念珠菌感染全身播散(肺部、脑部)致败血症而死亡;1例(念珠菌4)术后持续低热,经血、尿培养同一供者来源的另1例受者为同一热带念珠菌,果断切除移植肾后恢复血液透析治疗;另2例(曲霉菌2、4)受者切除移植肾后恢复血液透析治疗。
12例真菌感染受者的移植肾在切除后行病理检查证实真菌感染10例,其中毛霉菌3例,曲霉菌4例,以及念珠菌3例。肾移植术后供者来源真菌感染的移植肾病理检查结果见图1。
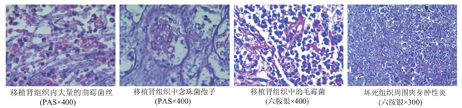

早在20年前国外就有供者原因导致受者术后发生真菌感染的报道,并建议建立完善的术前供者评估制度[3]。近年来,我国有学者对DCD供者供肾移植受者术后感染的危险因素的分析表明,供者感染是受者术后感染的独立危险因素[4]。
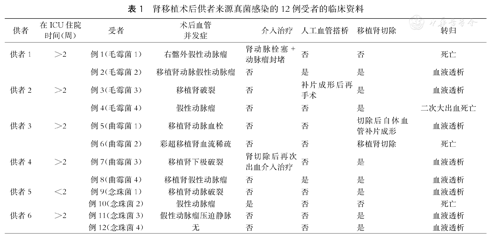
肾移植术后供者来源真菌感染的12例受者的临床资料
肾移植术后供者来源真菌感染的12例受者的临床资料
| 供者 | 在ICU住院时间(周) | 受者 | 术后血管并发症 | 介入治疗 | 人工血管搭桥 | 移植肾切除 | 转归 |
|---|---|---|---|---|---|---|---|
| 供者1 | >2 | 例1(毛霉菌1) | 右髂外假性动脉瘤 | 肾动脉栓塞+动脉瘤封堵 | 否 | 否 | 死亡 |
| 例2(毛霉菌2) | 移植肾动脉假性动脉瘤 | 否 | 是 | 是 | 血液透析 | ||
| 供者2 | >2 | 例3(毛霉菌3) | 移植肾破裂 | 否 | 补片成形后再手术 | 是 | 血液透析 |
| 例4(毛霉菌4) | 假性动脉瘤 | 否 | 否 | 是 | 二次大出血死亡 | ||
| 供者3 | >2 | 例5(曲霉菌1) | 移植肾动脉血栓 | 否 | 否 | 切除后自体血管补片成形 | 血液透析 |
| 例6(曲霉菌2) | 彩超移植肾血流稀疏 | 否 | 否 | 移植肾切除 | 死亡 | ||
| 供者4 | >2 | 例7(曲霉菌3) | 移植肾下极破裂 | 肾切除后再次出血介入治疗 | 否 | 是 | 血液透析 |
| 例8(曲霉菌4) | 移植肾假性动脉瘤 | 否 | 是 | 是 | 血液透析 | ||
| 供者5 | <2 | 例9(念珠菌1) | 移植肾动脉破裂 | 否 | 否 | 是 | 血液透析 |
| 例10(念珠菌2) | 假性动脉瘤 | 是 | 否 | 否 | 死亡 | ||
| 供者6 | >2 | 例11(念珠菌3) | 假性动脉瘤压迫静脉 | 否 | 否 | 是 | 血液透析 |
| 例12(念珠菌4) | 无 | 否 | 否 | 是 | 血液透析 |
国外有文献报道,对实体器官的保存液离心后培养,发现肝、肾的保存液中约有3.4%的真菌培养阳性,提示术前和术后的多位点多次的培养,对真菌感染的诊断仍有一定的参考意义[5]。国内有研究指出,在ICU住院第2周真菌感染发生率显著上升[6]。本研究中,我们统计的6例供者中,5例在ICU住院的时间超过2周,与该报道相符。目前对于ICU住院时间超过2周的DCD供者,其捐献器官的移植受者术后是否常规进行预防性抗真菌治疗,仍缺乏相关经验。我院移植中心目前对ICU住院时间超过2周,根据供者年龄、基础疾病、并发症、抗生素应用情况、营养状况以及留置导管时间等综合分析,有选择的预防性应用抗真菌药物。鉴于ICU住院患者的肺部和尿路真菌感染以白色假丝酵母菌属为主[7,8],我们对DCD供者供肾移植的受者术后早期多应用吡咯类抗真菌药物如氟康唑等,但其对曲霉菌属敏感性差,且对钙调磷酸酶抑制剂(CNI)类抗排斥反应药物浓度的影响较大,后改为棘白菌素类的卡泊芬净或多烯类的两性霉素B等,取得一定效果。术后如果有病理和培养证实的真菌感染,应根据真菌类型和药敏结果,在足量、足疗程用药的同时,及时外科干预治疗。
对于供肾前在ICU住院超过2周的供者,且(或)已经存在感染的高危供者,术前除常规进行供者的血、尿、痰等培养外,切取供者器官的同时留取组织液(如腹水)进行培养,对感染的组织进行病理检查等,可以为判断供肾质量以及术后预防和治疗性用药提供帮助。本研究中,8例受者发生侵袭性移植肾深部真菌感染,由于DCD供者供肾应用早期经验不足,常规血、尿培养阴性,未进一步进行保存液及引流液的常规培养。其余4例进行了多次多位点的培养,其中2例热带念珠菌供者中,1例培养结果出来前出现移植肾动脉瘤破裂,急诊切除移植肾病理证实,另1例尿和引流液培养均为热带念珠菌,果断切除移植肾,避免了更进一步的损害。
对于供者来源移植肾霉菌感染,多需要及时的外科干预治疗,包括及时切除移植肾和处理血管并发症等。国外有研究总结供者来源真菌感染的移植肾功能丧失发生率和受者死亡率分别为83%和17%,且以曲霉菌感染为多[9]。本研究中,我们总结的12例真菌感染受者中,由于DCD供者供肾移植的早期缺乏经验,1例尿培养出毛霉菌感染的受者在应用两性霉素治疗中移植肾破裂带移植肾功能死亡,死亡时移植肾功能恢复延迟,需行肾脏替代治疗。另1例带移植肾功能死亡受者的血、尿培养均为念珠菌,治疗过程中出现真菌全身播散死亡,死亡时移植肾功能恢复中,尿量正常,血肌酐降至230 μmol/L。鉴于曲霉菌和毛霉菌均有强烈的嗜血管性,念珠菌容易播散至其他部位,建议一旦确诊早日切除移植肾,以免进一步发生影响受者生命的并发症。
本组12例受者均出现不同程度的血管并发症,早期DCD供肾移植的2例毛霉菌感染受者中,1例发生移植肾破裂,急诊行移植肾切除后病理检查确诊,虽尽快进行了两性霉素B治疗,髂外动脉吻合口再次出血而二次手术;由于缺乏相关经验,接受同一供者供肾的另1例受者发生移植肾假性动脉瘤后,未切除移植肾而行动脉栓塞+动脉瘤封堵术,术后抗真菌治疗过程中突发移植肾疼痛,迅速出现休克死亡。因此,对于供者来源的侵袭性真菌感染,建议尽快切除移植肾和病变血管。术中应尽量避免在感染环境中进行血管重建,应充分切除病变血管,必要时应用人造血管替代搭桥,因为简单的血管断端吻合,可能导致致命性二次出血[10]。12例受者中,切除移植肾后3例进行了人工血管搭桥,2例采用自体血管补片成形;其中1例曲霉菌感染受者(曲霉菌3)行补片成形术后再次发生吻合口大出血,急诊手术见血管破坏严重,遂行人造血管与左侧股动脉端侧吻合,通过耻骨前面皮下隧道至右侧腹股沟区,再行人造血管与右股动脉端侧吻合,建立左股动脉至右股动脉的血流通路,术后数次床旁血液净化后转入普通血液透析治疗。
4例毛霉菌感染受者中死亡2例,其中1例未及时手术干预切除移植肾,1例切除移植肾后切除病变血管未行人工血管搭桥,嗜血管性的霉菌进一步侵袭血管导致致命性二次出血。对于由于感染因素引起的移植后假性动脉瘤,只有在瘤体较小,感染控制和基本排除侵袭性真菌感染的情况下考虑介入治疗,对于真菌感染的假性动脉瘤,建议开放性手术治疗,术中可以较直接的判断血管和移植肾情况,而行相应处理[11]。鉴于目前DCD供者越来越多,移植肾血管并发症发生率的升高,我们现行肾移植手术方式,尽量用髂内动脉与供肾动脉端端吻合,避免采用髂外动脉与供肾动脉端侧吻合,防止由于感染导致肾动脉或髂外动脉形成假性动脉瘤和吻合口破裂出血。
总之,侵袭性移植肾深部真菌感染有其特殊的临床背景和特点。对于高危供者,术前及时进行多位点(血、尿、痰、组织液)培养,组织病理检查,术后根据情况预防性应用抗真菌药。高度怀疑供者来源的移植肾真菌感染,及时进行外科手术干预,积极进行有针对性抗真菌治疗,对保障肾移植受者安全和降低移植肾功能丧失发生率有重要意义。



























