
探讨表达嵌合抗原受体的T淋巴细胞(CAR-T细胞)治疗急性B淋巴细胞白血病(B-ALL)行异基因造血干细胞移植(allo-HSCT)后复发,且经供者淋巴细胞输注(DLI)无效者的疗效及安全性。
10例B-ALL患者,allo-HSCT后原发病复发,在化疗联合DLI治疗无效后接受供者来源的CAR-T细胞治疗。10例患者共接受25例次CAR-T细胞治疗,输注针对CD19抗原的CAR-T细胞22例次,针对CD123抗原的CAR-T细胞2例次,针对CD22抗原的CAR-T细胞1例次。首次输注指征为血液学复发(7例)或微小残留病变阳性(3例),首次输注时间为allo-HSCT后6~66个月,中位数为24个月,回输CAR-T细胞(4.4~55)×105/kg,中位数为2.53×106/kg。
10例患者均在第1次CAR-T细胞治疗后获得最佳疗效,其中5例完全缓解,3例部分缓解,总有效率为80%(8/10)。起效时间为CAR-T细胞治疗后第14~37天,中位数为第24天,疗效维持时间1.3~6.3个月,中位数为4.75个月。血液学复发的患者CAR-T细胞治疗效果与治疗前骨髓幼稚细胞中位数相关(P=0.010),而与输注的CAR-T细胞数无关(P=0.538)。22例次可评估不良反应的CAR-T细胞治疗中,输注后出现发热13例次,出现发热的中位时间为CAR-T细胞输注后第6天(第0~8天),其中12例次发热考虑由细胞因子释放综合征(CRS)所致;1例次出现少许皮疹,诊断为Ⅰ度移植物抗宿主病(GVHD)。至随访结束(CAR-T细胞治疗后0.9~17个月),10例中,死于复发者3例,复发后失访1例,复发状态下存活3例,MRD阳性状态下存活2例,CR 1例,总体存活率为49.4%。
CAR-T细胞用于B-ALL行allo-HSCT治疗后原发病复发且DLI无效的患者有一定效果,疗效与骨髓幼稚细胞水平相关;治疗相关的不良反应主要为轻、中度CRS,还未发现其可诱发严重的GVHD。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
复发一直是白血病患者异基因造血干细胞移植(allo-HSCT)后所面临的重要问题,虽然化疗联合供者淋巴细胞输注(DLI)等治疗方案可获得再次缓解[1],但对于淋巴细胞白血病来说,预后往往不佳,且通常伴随严重的GVHD、骨髓抑制、感染等并发症[2]。近年来,经基因修饰后的表达嵌合抗原受体的T淋巴细胞(CAR-T细胞)能够以非主要组织相容性复合物(MHC)限制性的形式直接识别肿瘤细胞,同时具有自激活作用,在以化疗后复发的难治性淋巴系统肿瘤患者为主的临床试验中显示出了卓越疗效和安全性[3,4]。CAR-T细胞用于allo-HSCT后的原发病复发患者也有零星报道[5,6],但将其应用于DLI治疗无效的患者鲜见报道。本文总结了近1年在我院因移植后复发且DLI无效而接受CAR-T细胞治疗的急性B淋巴细胞白血病(B-ALL)患者资料,以期对CAR-T细胞治疗该类患者的疗效及安全性进行初步评价。
自2015年1月1日至2016年3月31日,共有10例B-ALL患者因allo-HSCT后复发而在本院接受CAR-T细胞治疗25次。10例中,男性6例,女性4例,年龄中位数为35岁(8~52岁),原发疾病全部为B-ALL,其中Ph染色体阳性(Ph+)者4例。10例患者中,同胞间HLA相合移植者4例,亲缘单倍体移植者6例。所有患者在接受CAR-T细胞治疗前均接受过化疗联合DLI治疗(表1)。随访截至2016年3月31日。

allo-HSCT后复发且DLI无效的难治性B-ALL患者基本情况
allo-HSCT后复发且DLI无效的难治性B-ALL患者基本情况
| 病例 | 性别 | 年龄(岁) | Ph染色体 | 移植类型 | DLI前复发状态 | DLI次数 |
|---|---|---|---|---|---|---|
| 1 | 男 | 42 | Ph+ | 同胞间HLA全相合 | 微小残留病变 | 1 |
| 2 | 男 | 18 | Ph- | 同胞间HLA全相合 | 血液学复发 | 2 |
| 3 | 男 | 42 | Ph- | 同胞间HLA全相合 | 血液学复发 | 1 |
| 4 | 女 | 36 | Ph- | 同胞间单倍体相合 | 血液学复发 | 3 |
| 5 | 女 | 34 | Ph- | 父亲供给女儿单倍体相合 | 微小残留病变 | 1 |
| 6 | 女 | 44 | Ph+ | 同胞间单倍体相合 | 微小残留病变 | 2 |
| 7 | 男 | 8 | Ph- | 父亲供给儿子单倍体相合 | 微小残留病变 | 2 |
| 8 | 男 | 16 | Ph+ | 父亲供给儿子单倍体相合 | 微小残留病变 | 6 |
| 9 | 男 | 52 | Ph+ | 同胞间HLA全相合 | 微小残留病变 | 2 |
| 10 | 女 | 12 | Ph- | 父亲供给女儿单倍体相合 | 微小残留病变 | 1 |
注:allo-HSCT为异基因造血干细胞移植,DLI为供者淋巴细胞输注,B-ALL为急性B淋巴细胞白血病
CAR-T细胞均由北京美康优娃生物科技有限公司制备,并有产品质量检测证明,属于第4代CAR-T细胞,所有CAR-T细胞均为供者来源。输注针对CD19抗原的CAR-T细胞22例次,针对CD123抗原的CAR-T细胞2例次,针对CD22抗原的CAR-T细胞1例次,其中有20例次回输前联合化疗(表2)。每次CAR-T细胞治疗前患者和(或)家属必须签署知情同意书。
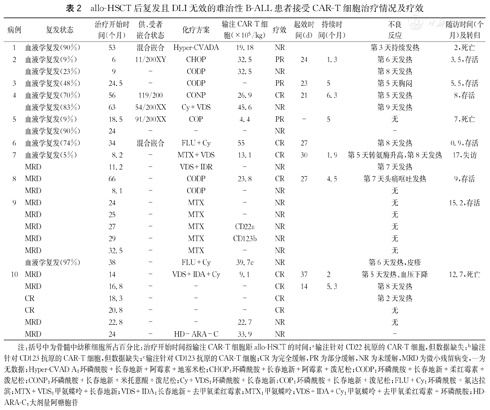
allo-HSCT后复发且DLI无效的难治性B-ALL患者接受CAR-T细胞治疗情况及疗效
allo-HSCT后复发且DLI无效的难治性B-ALL患者接受CAR-T细胞治疗情况及疗效
| 病例 | 复发状态 | 治疗开始时间(个月) | 供、受者嵌合状态 | 化疗方案 | 输注CAR-T细胞(×105/kg) | 疗效 | 起效时间(d) | 持续时间(个月) | 不良反应 | 随访时间(个月)及转归 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 血液学复发(90%) | 53 | 混合嵌合 | Hyper-CVADA | 19.18 | NR | 第3天持续发热 | 2,死亡 | ||
| 2 | 血液学复发(9%) | 6 | 11/200XY | CHOP | 32.5 | PR | 24 | 1.3 | 第6天发热 | 3.5,存活 |
| 血液学复发(23%) | 9 | - | CODP | 32.5 | NR | 第8天发热 | ||||
| 3 | 血液学复发(48%) | 24.5 | - | CODP | - | PR | 23 | 5 | 第5天胸闷 | 5.5,存活 |
| 4 | 血液学复发(70%) | 56 | 119/200 | CONP | 26.9 | CR | 21 | 6.3 | 第5天发热 | 8,存活 |
| 血液学复发(83%) | 63 | 54/200XX | Cy+VDS | 45.6 | NR | 第9天发热 | ||||
| 5 | 血液学复发(9%) | 18.5 | 91/200XX | COP | 4.4 | PR | - | 5 | 无 | 7,死亡 |
| 血液学复发(90%) | 24 | - | - | - | NR | - | ||||
| 6 | 血液学复发(74%) | 34 | 混合嵌合 | FLU+Cy | 55 | CR | 27 | 第8天发热 | 0.9,存活 | |
| 7 | 血液学复发(5%) | 8.2 | - | MTX+VDS | 13.1 | CR | 30 | 1.9 | 第5天转氨酶升高,第8天发热 | 17,失访 |
| MRD | 11.2 | - | VDS+IDR | - | NR | 第7天发热 | ||||
| 8 | MRD | 66 | - | CODP | 23.8 | CR | 27 | 4.5 | 第7天头痛呕吐发热 | 9,存活 |
| MRD | 8.1 | - | CODP | - | NR | 无 | ||||
| 9 | MRD | 24 | - | MTX | - | NR | 无 | 15.2,存活 | ||
| MRD | 25 | - | MTX | - | NR | 无 | ||||
| MRD | 27 | - | MTX | CD22a | NR | 无 | ||||
| MRD | 29 | - | MTX | CD123b | NR | 无 | ||||
| MRD | 32.5 | - | MTX | - | NR | 无 | ||||
| 血液学复发(97%) | 38 | - | FLU+Cy | 39.7c | NR | 第6天发热,皮疹 | ||||
| 10 | MRD | 14 | - | VDS+IDA+Cy | 9.1 | CR | 37 | 2 | 第5天发热、血压下降 | 12.7,死亡 |
| MRD | 16.8 | - | - | - | CR | 14 | 5.3 | 第8天发热 | ||
| CR | 18.3 | - | - | - | CR | 第2天发热 | ||||
| CR | 20.8 | - | - | - | CR | 无 | ||||
| MRD | 22.8 | - | - | 22.7 | NR | 无 | ||||
| MRD | 24 | - | HD-ARA-C | 33.9 | NR | - |
注:括号中为骨髓中幼稚细胞所占百分比;治疗开始时间指输注CAR-T细胞距allo-HSCT的时间;a输注针对CD22抗原的CAR-T细胞,但数据缺失;b输注针对CD123抗原的CAR-T细胞,但数据缺失;c输注针对CD123抗原的CAR-T细胞;CR为完全缓解,PR为部分缓解,NR为未缓解,MRD为微小残留病变,—为无数据;Hyper-CVAD A:环磷酰胺+长春地新+阿霉素+地塞米松;CHOP:环磷酰胺+长春地新+阿霉素+泼尼松;CODP:环磷酰胺+长春地新+柔红霉素+泼尼松;CONP:环磷酰胺+长春地新+米托蒽醌+泼尼松;Cy+VDS:环磷酰胺+长春地新;COP:环磷酰胺+长春地新+泼尼松;FLU+Cy:环磷酰胺+氟达拉滨;MTX+VDS:甲氨蝶呤+长春地新;VDS+IDA:长春地新+去甲氧柔红霉素;MTX:甲氨蝶呤;VDS+IDA+Cy:甲氨蝶呤+去甲氧柔红霉素+环磷酰胺;HD-ARA-C:大剂量阿糖胞苷
分为血液学复发和微小残留病变、(MRD)阳性两种情况。血液学复发是指外周血中出现幼稚B淋巴细胞,或骨髓中幼稚细胞>5%,且流式细胞仪检测证实为白血病细胞或除外其他原因所致,或出现骨髓外复发。MRD阳性指骨髓中幼稚细胞≤5%,但流式细胞仪检测到白血病细胞(八色流式细胞仪检测到7.5×105~10×105个细胞,淋系白血病敏感度为0.001%),且Wilms肿瘤基因(WT1)>0.6%;或2次骨髓穿刺(间隔2周以上),其中任何一次均有一项结果阳性[7];或白血病特异性基因(BCR/ABL、E2A/PBX1、TEL/AML1)持续阳性。
完全缓解(CR)指MRD阴性;部分缓解(PR)指血液学复发转变为MRD阳性;无效(NR)指疾病进展、维持原来血液学复发或MRD阳性状态。
采用SPSS(16.0版)软件进行统计学处理,分析幼稚细胞数目比例、输注CAR-T细胞数量与疗效的关系时,应用非参数秩和检验。计数资料采用卡方检验,生存率的统计用Kaplan-Meier生存曲线。
首次输注CAR-T细胞的指征为血液学复发者7例,MRD阳性者3例。首次输注时间为allo-HSCT后的6~66个月,中位数为24个月,回输CAR-T细胞(4.4~55)×105/kg,中位数为2.53×106/kg。
1.患者均在第1次CAR-T细胞治疗后获得最佳疗效,5例达CR,3例获得PR,总有效率为80%(8/10)。
2.按治疗例次计算,25例次中,2例次为巩固治疗,2例次未达评估时间点,21例次可评估疗效,CR率为28.6%(6/21),PR率为14.3%(3/21),总有效率为42.9%(9/21)。起效的时间为CAR-T细胞治疗后第14~37天,中位数为第24天;疗效维持时间为1.3~6.3个月,中位数为4.75个月。
CAR-T细胞治疗前有11例次血液学复发,经CAR-T细胞治疗后,3例次达CR,其中2例次(例4、例7)疗效分别维持6.3、1.9个月后均再次血液学复发,1例次(例6)截稿前1天评估刚获得CR;3例次达PR,疗效分别维持1.3、5、5个月,其中2例(例2、例5)最后血液学复发,仅1例(例3)目前仍处于MRD阳性状态;5例次NR,总的有效率为60%(6/10,1例次未达评估时间)。此11例次血液学复发的CAR-T细胞治疗,有效者CAR-T细胞治疗前骨髓幼稚细胞中位数为28.5%,低于无效组的90%(P=0.010),而二者输注的CAR-T细胞数的差异无统计学意义(P=0.538)。
CAR-T细胞治疗前MRD阳性的12例次中,经CAR-T细胞治疗后,3例次达CR,疗效维持时间分别为2、4.5、5.3个月,其中疗效维持5.3个月的受者(例10)在缓解期间输注过2次CAR-T细胞作为巩固治疗;8例次NR;1例次无法评估疗效(表2,图1)。
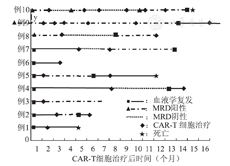

3.受者的随访时间为首次接受CAR-T细胞治疗后0.9~17个月,中位数为7.5个月。10例中,死于复发者3例,复发后失访1例,复发状态下存活3例,MRD阳性状态下存活2例,CR 1例。随访结束时,全部患者的总体累积存活率为49.4%。
22例次可评估不良反应的治疗中,输注后发热13例次,出现发热的中位时间为输注后第6天(第0~8天),12例次发热考虑由细胞因子释放综合征(CRS)所致,其中11例次为Ⅰ级CRS,1例次为Ⅱ级CRS,伴头痛、呕吐、血压下降及转氨酶升高,症状持续时间的中位数为5 d(1~10 d)。1例应用1剂肿瘤坏死因子α拮抗剂(商品名:益赛普)治疗。CRS多出现在治疗有效的患者中,治疗有效的9例次中发生CRS 7例次,治疗无效的9例次(不含无法评估不良反应的3例次)中仅发生CRS 2例次(P=0.028)。9例次在输注CAR-T细胞前后2周内行一系列急性时相蛋白(CRP)监测,其中未发生CRS等不良反应的3例次,输注CAR-T细胞后2周内的CRP均在正常范围内,而出现发热并诊断为CRS的6例次中,有4例次出现CRP升高,较输注前升高1.5~8.8倍。
仅1例次出现少许皮疹,诊断为Ⅰ度GVHD,未予特殊治疗,自行缓解。
Spyridonidis等[8]总结欧洲骨髓移植登记组(EBMT)465例移植后复发的ALL患者资料,复发后的中位存活时间仅有5.5个月,复发后1年的总体存活率为30%,对于该类复发患者迫切需要新的治疗措施。本研究纳入的研究对象原发病均为B-ALL,allo-HSCT后复发,经常规化疗联合DLI治疗无效,患者DLI治疗最多达6次,中位数为2次。相对于DLI,CAR-T细胞加强了对有特定靶点的细胞的杀伤强度,但也失去了DLI治疗具有多靶点的优势。因此,对于该类经过多次免疫治疗无效的患者,探讨采用CAR-T细胞治疗的疗效和安全性具有重要意义。Maude等[5]报道了30例血液学复发的ALL患者,其中18例为allo-HSCT后复发,接受CAR-T细胞治疗后27例获得CR,疗效与是否接受过allo-HSCT无关,但其未详细描述这类患者的复发状况。本组10例经CAR-T细胞治疗,有效率为80%(8/10),结果较为满意。本研究另外发现CAR-T细胞治疗效果与肿瘤负荷相关,治疗有效者及无效者的骨髓幼稚细胞中位数分别为28.5%、90%(P=0.010)。有效者中有1例的骨髓幼稚细胞比例为70%,在CAR-T细胞治疗前23 d施行过DLI,在未评估DLI疗效的情况下回输CAR-T细胞,21 d后骨髓穿刺检查提示获得CR,不能排除DLI在其中所起的作用。
对于肿瘤负荷高的患者,加强回输前的化疗强度有可能提高疗效。Turtle等[9]报道了28例非霍奇金淋巴瘤患者接受抗CD19的CAR-T细胞治疗,其中12例患者采用环磷酰胺(Cy,60 mg/kg)联合氟达拉滨(25 mg/m2,用2~3 d)的化疗方案,总有效率为67%,CR率为42%,其疗效优于单用Cy化疗的12例患者(CR率为8%),同时前者体内CAR-T细胞增殖的数量及持续时间均优于后者。提示回输CAR-T细胞前的化疗不仅起到直接杀伤肿瘤细胞的作用,其淋巴细胞清除和免疫抑制作用有利于CAR-T细胞在体内的扩增,优化回输前的化疗方案可能是改善CAR-T细胞治疗效果的一个途径。本研究80%(20/25)在CAR-T细胞回输前进行了化疗,大部分化疗方案含有Cy,但具体方案繁杂,无法判断化疗与疗效的关系。
对于allo-HSCT后复发而使用CAR-T细胞治疗的患者,如何维持疗效是需要面临的问题。Porter等[10]报道,CAR-T细胞可以在慢性淋巴细胞白血病患者体内存活,并维持疗效4年以上,但无论是本研究还是绝大多数文献都显示,对于ALL患者CAR-T细胞治疗的效果无法持久,这可能与CAR-T细胞的构建及原发疾病的种类不同有关。本组有一例患者在达CR后继续连续输注2次CAR-T细胞作为巩固治疗,但最终在疗效维持5.3个月后仍然发生血液学复发。另一例Ph+ALL患者,BCR/ABL基因持续阳性,在9个多月内输注了5次CAR-T细胞,最终在CAR-T细胞治疗满1年时全面复发,提示对于CAR-T细胞输注频率或后续治疗仍需进一步研究。
本研究中获得疗效的8例患者均为第1次CAR-T细胞治疗后获得。6例患者复发后再次接受CAR-T细胞治疗,可评估疗效的4例中仅1例达到短暂缓解。这些提示,如果初次治疗效果不佳,没有必要重复应用同一种CAR-T细胞治疗。
Maude等[9]报道,18例allo-HSCT患者CAR-T细胞治疗后未发生GVHD,证实了CAR-T细胞治疗的高度靶向性和安全性。Brudno等[7]报道,20例B-ALL的患者在allo-HSCT后进行CAR-T细胞治疗,其中8例有效,无新发急性GVHD者。Kebriaei等[11]甚至将CAR-T细胞治疗作为allo-HSCT后的抢先治疗,他们的21例患者在移植后41~92 d(中位时间为64 d)接受了CAR-T细胞治疗,结果仅3例发生了Ⅱ—Ⅳ度GVHD,肝脏、上消化道及皮肤GVHD各1例,CAR-T细胞治疗并未增加GVHD的发生率。本组25例次的治疗中,仅1例次发生了轻度的GVHD,未予特殊处理,自行缓解。
与大多数免疫细胞过继治疗相类似,CAR-T细胞应用过程中,会释放多种细胞因子,临床上会出现寒战、发热、白细胞减少、肿瘤溶解综合征、细胞因子风暴、B淋巴细胞缺乏引起的低免疫球蛋白血症等不良反应。Maude等[6]报道的50例患者均发生了CRS,非重度CRS(22例)发生时间的中位数为输注CAR-T细胞后第4天,重度CRS(8例)发生时间的中位数为CAR-T细胞输注后第1天。发生CRS时伴随着白细胞介素(IL)6、CRP、γ干扰素、可溶性IL-2受体、铁蛋白等水平升高。CRS的严重程度与肿瘤负荷及体内CAR-T细胞增殖水平相关。本研究中55%(12/22)发生了CRS,仅1例次为中度CRS,其余为轻度CRS,发生于CAR-T细胞输注后第6天(中位数),相对于Maude等[6]报道的程度较轻,发生时间也偏晚,这可能与CAR-T细胞的构建不同有关。因为CRS可以反映T淋巴细胞的激活,并与维持T淋巴细胞功能相关,因此认为CRS与CAR-T细胞的功能相关。我们也发现发生CRS的患者,输注后CRP升高,且CAR-T细胞治疗有效者更易发生CRS,但可能由于病例数少的缘故,未体现出统计学意义。Rouce等[12]报道了47例输注CAR-T细胞2次以上者的临床资料,证实了重复输注CAR-T细胞是安全的,最常见的Ⅲ—Ⅳ度不良反应是血液学毒性和电解质紊乱,无需特殊干预,且绝大多数不良反应与输注本身无关。本组10例患者中,有7例接受过1次以上的CAR-T细胞治疗,但未发现多次输注CAR-T细胞的患者出现过敏反应或不良反应增加的情况。
CAR-T细胞疗法作为一种新的肿瘤免疫治疗方法,其疗效在血液肿瘤的治疗中获得了肯定,本研究证实CAR-T细胞治疗移植后复发且DLI无效的B-ALL患者,其初步疗效令人满意,且安全性好,不会诱发出严重的GVHD,但需要增加病例做进一步的验证。



























