
探讨房间隔缺损修补术同期双肺移植术治疗房间隔缺损合并艾森曼格综合征的可行性及围手术期的处理方法。
2016年5月24日为1例先天性房间隔缺损合并艾森曼格综合征患者在体外循环下行房间隔缺损修补同期体外膜肺氧合(ECMO)辅助下双侧序贯式肺移植术。严格按照流程行供肺切取,并采用HTK液灌注和保存供肺。手术过程顺利,术中右肺冷缺血时间120 min,左肺冷缺血时间260 min。术后采用他克莫司+吗替麦考酚酯+肾上腺皮质激素的三联免疫抑制方案。
受者术后60 h循环稳定、氧合良好后撤除ECMO,术后7 d成功拔除气管插管。术后12~20 d痰细菌培养阳性,予敏感抗生素治疗后治愈。出院前复查心脏超声检查示房间隔缺损修补术后无残余分流,出院后1个月受者心肺功能恢复良好,胸部X线片示双侧移植肺清晰,生活质量得到明显改善。
对终末期双向分流的艾森曼格综合征实施心脏畸形修补同期双肺移植术是可行的治疗方法,充分的术前准备、顺利的手术过程以及术后及时有效的并发症处理是成功的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
长期以来,艾森曼格综合征(ES)被认为是常规心脏矫形手术的禁忌证,随着胸部器官移植技术的发展,上世纪90年代,心肺联合移植曾是外科治疗ES的热点手术方式,而有关心脏矫形联合肺移植术治疗ES的报道不多,国内有关心脏矫形联合肺移植术治疗房间隔缺损(ASD)合并ES的病例报道较少[1,2,3]。我院1例在体外膜肺氧合(ECMO)辅助下房间隔缺损修补同期双肺移植术治疗房间膈缺损合并艾森曼格综合征的成功手术,我们总结相关手术体会及处理经验,现报道如下。
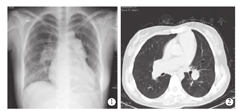
受者为女性,26岁,体重52 kg,身高167 cm,5岁时发现心脏杂音,当时诊断"先天性心脏病,房间隔缺损" ,无明显缺氧体征未予特殊处理,10岁后出现反复气促,14岁始出现活动耐力下降、紫绀等症状,外院诊断"先天性心脏病(艾森曼格综合征,房间隔缺损,重度肺动脉高压)" 。受者于2015年5月25日入院,经胸部X线片(图1)、胸部CT检查(图2)、心脏彩色超声检查等影像学相关检查以及其他实验室相关检查后,明确诊断:(1)先天性心脏病:房间隔缺损(下腔型),肺动脉高压(重度), 三尖瓣关闭不全(重度),窦性心律,完全型右束支传导阻滞,心功能Ⅳ级;(2)艾森曼格综合征。拟行房间隔缺损修补术同期双肺移植术。术前肺功能检测显示:极重度限制性通气功能障碍,用力肺活量(FVC)占预计值26.5%,一秒用力呼气容积(FEV1)占预计值22.5%,FEV1与FVC比值(FEV1/FVC)为84.9%。术前漂浮导管测得数据:肺动脉阻力12 Wood,平均肺动脉压92 mmHg,肺毛细血管楔压100 mmHG。

供者为男性,36岁,体重75 kg,身高175 cm。平素健康,因严重颅脑外伤被明确判定为脑死亡,供者的近亲亲属均知情同意捐献器官。供者无心、肺疾病病史,供、受者ABO血型相同,体形匹配,群体反应性抗体(PRA)及供、受者补体依赖淋巴细胞毒性试验均为阴性。按规范切取供肺,采用HTK液灌注和保存供肺。
日间面罩间断中流量吸氧,夜间持续面罩低流量吸氧;波生坦125 mg,每天2次,术前用药时间共约20个月;每隔1个月复查血常规及肝、肾功能,无异常。
双腔气管插管、全麻后,肝素化,右侧股动静脉插管,改左侧卧位,右侧第5肋间外侧切口,见右肺颜色略暗红,表面粗燥感,弹性差。切开心包并悬吊,留取部分心包组织。上腔静脉插管,建立体外循环,心肺转流,升主动脉插排气管,部分阻断升主动脉,阻断上腔静脉、下腔静脉,右心房斜切口切开右心房,暴露房间隔缺损,用心包补片间断缝合修补缺损,左心排气后闭合缺损,缝合右心房切口。开放升主动脉及上、下腔静脉,拔除上腔静脉插管,经右股动静脉插管建立ECMO循环,鱼精蛋白中和肝素。
(1)切除右侧病肺并右肺移植:游离肺动静脉,分别切断肺动脉第一分支和降支,远心端切断肺静脉,于上叶开口近端切断主支气管,移除右肺;植入右肺,支气管吻合用4-0可吸收单丝线连续缝合支气管膜部及软骨部,肺动脉吻合用5-0 prolene线连续缝合,吻合心房袖。开放右肺动、静脉,检查无出血,右侧胸腔止血,经第7肋间右腋中线及右侧腋后线戳空放置右上及右下胸管,常规关胸。(2)切除左侧病肺并左肺移植:受者改左侧卧位,同右侧方法切除左侧病肺和左肺移植,并留置左上及左下胸管各1根。术中右肺冷缺血时间120 min,左肺冷缺血时间260 min。受者术前肺动脉压为135/93 mmHg,心脏修补结束后为100/72 mmHg,右肺移植结束后为75/41 mmHg,左肺移植结束后为40/26 mmHg。
术毕将受者送入重症监护室(ICU),监测生命体征,呼吸机呼吸支持,多巴胺、肾上腺素、去甲肾上腺素及异丙肾上腺素辅助循环,并继续予以ECMO辅助支持,随着心率、血压等稳定后,至术后第3天逐渐减少血管活性药的用量至停用,采用他克莫司+吗替麦考酚酯(MMF)+肾上腺皮质激素的三联免疫抑制方案预防排斥反应。术后限制液体摄入,48 h内尽可能负平衡以防止移植肺水肿。通过输血、输胶体液和应用利尿剂等维持适当的尿量,并监测肾功能和免疫抑制剂血药浓度。适当予镇静、镇痛处理来预防疼痛引起的咳嗽抑制和胸廓运动减少。加强气道管理,体位引流,病情稳定后逐步脱离呼吸机。受者顺利通过自主呼吸试验后拔除气管插管,拔管前用气管镜清除呼吸道内分泌物,拔管后检查胸腔闭式引流是否漏气,确认无漏气方可考虑拔除胸腔闭式引流管。
受者于术后2 h清醒,术后1 d行气管镜检查示吻合口良好,未见明显狭窄,第2天因右侧胸管引流血性液较多(>100 ml/h),果断送手术室行胸腔镜下右侧胸腔探查、止血,术中明确右侧气管吻合口小动脉分支缓慢出血,经电凝成功止血,24 h后循环稳定、氧合良好后撤除ECMO,术后7 d成功拔除气管插管。术后19 d转出ICU,术后12~20 d痰培养陆续检测到铜绿假单胞菌、革兰阳性菌,根据痰培养及药物敏感试验结果选择敏感抗生素(哌拉西林他唑巴坦抗细菌、泊沙康唑抗真菌、口服复方磺胺甲噁唑、阿奇霉素及更昔洛韦抗病毒治疗),复查痰培养逐渐转阴,并预防性应用两性霉素B脂质体雾化吸入抗真菌、更昔洛韦抗病毒治疗1个月,复查痰培养阴性后出院。出院前复查心脏超声检查示房间隔缺损修补术后无残余分流,肺动脉压降为41 /26 mmHg,术后活动耐力明显改善,术后50 d出院。
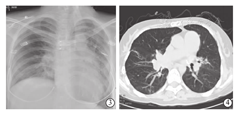
随访至术后147 d,受者心、肺功能恢复良好,术后98 d时胸部X线片显示:右下肺野及左侧肺纹理增粗、模糊,两肺门影尚清晰,心影稍增大,肺动脉段稍突起,双膈面及双肋膈角清晰(图3)。术后113 d胸部CT检查显示:双下肺炎症(右下肺为主),心脏增大,肺动脉高压(主干横径达35 mm),纵隔及肺门淋巴结钙化(图4)。肺功能检查显示:极重度限制性通气功能障碍,FVC占预计值32.2%,FEV1占预计值26.8%,FEV1/FVC 86.4%。生活质量得到明显改善,6分钟步行试验明显改善(由术前250 m提高至560 m),步行试验后Borg呼吸困难评分为2分;纤维支气管镜检查显示:双侧支气管炎症表现,黏膜轻度水肿,少量黄白色膜状物覆盖,左侧支气管吻合口稍微狭窄。

ASD合并ES的移植手术适应证及手术时机是一个长期富于争议的问题[4]。近年来药物治疗ES取得长足进步,针对ES的肺动脉高压(PAH)形成的3个主要过程(血管收缩、血管重塑及血管原位血栓形成)出现较多的药物,并显示出良好作用,其中内皮素受体拮抗剂如波生坦等效应最为明显 [5,6,7],本例受者术前遂长期口服波生坦治疗。尽管现有药物治疗在降低肺动脉压力方面体现出作用,然而,它们并没有改变肺血管病变的病理进程,没有改善ES患者的临床结局[8]。对于ES患者,由于错失移植手术时机而发生的死亡率高达29%[9],而移植术后短期死亡率不超过20%[10],故整体上移植手术的安全性是可靠的。对于病情严重的ES患者,生活质量也是不可回避的问题,受限于运动耐量,非手术者其生活质量低下,而手术成功后受者的生活质量得到明显改善[11]。移植仍然是治疗ES的最终方式,而移植前的重要辅助治疗是必要的[11]。至于术后是否继续应用降肺压药物也是有待进一步探究。
就外科技术而言,术式选择至今仍困扰着外科医生。理论上,心肺联合移植同时替换了存在病变的心、肺两个器官,外科治疗上是彻底的,术后通气/血流匹配程度最佳,但是对比心脏矫形手术联合肺移植术,却增加了一个免疫排斥反应的靶器官,相应增加了由排斥反应导致的移植物功能丧失的机会,可能影响长期存活率。Januszewska等[12]研究提示,单独的VSD合并ES患者采用心肺联合移植术较心脏矫形手术联合肺移植术获益更多;也有研究显示,对于孤立的心脏解剖缺陷,如PDA、ASD、VSD,采用心脏矫形手术联合双肺移植术,术后的中位存活率、死亡率与心肺联合移植术或肺移植应用于其他适应证相仿[13]。事实上,除左心功能外,患者的右心功能也是决定行心肺联合移植还是心脏矫形手术联合肺移植术需要考虑的极为重要的因素,遗憾的是对右心功能的评价尚无可靠一致的检查手段,考虑到供者器官的短缺,目前更多的倾向于采用心脏矫形手术联合双肺移植术。至于单肺移植与双肺移植的比较,从治疗彻底性及通气/血流匹配程度来看,双肺移植显然会更理想。Cassivi等[14]报道,双肺移植受者术后5年存活率(66.7%)比单肺移植受者(44.9%)高。另外,对比双肺移植,由于单肺移植在操作上相对简单,手术创伤较少,移植肺的冷缺血时间短,围手术期的死亡率及并发症少[15]。因而目前尚不能明确双肺移植比单肺移植更优越。鉴于本例受者较为年轻,营养状况可,以及可耐受相对长的手术时间,同时考虑到双肺移植术后双侧肺通气/血流比值一致性较单肺移植佳,故选择施行双肺移植。
近年来,在肺移植中ECMO的应用明显增多。Yu等[16]报道,与常规体外循环(CPB)相比,肺移植术中应用ECMO作为辅助的受者术后30 d、90 d及半年的存活率均较高,这可能与ECMO减少了对凝血功能及炎症因子激活等相关,故他提倡在肺移植中将ECMO作为常规措施使用。本例受者手术中主要考虑到原有心脏存在畸形,先在CPB下修补房缺,后应用了股动-静脉(V-A)的转流方式,预防术中、术后存在和发生急性心功能不全的可能。
结合本例成功手术,我们认为,体外循环下行房间隔缺损修补同期ECMO辅助下双侧序贯式肺移植术是治疗房间隔缺损合并艾森曼格综合征的可行方法,良好的供肺质量、精细的手术操作过程及术后及时有效的治疗相关并发症是成功的关键,术前降肺压药物治疗是系统治疗的重要组成部分;心肺联合移植、心脏矫形手术联合双肺移植、单肺移植等术式,孰优孰劣,还需多中心、更多病例的分析方能得出结论。但是,如何通过优化免疫抑制方案及合理抗感染来提高肺移植术后远期存活率及生活质量是临床迫需解决的问题。



























