
探讨转染血管内皮生长因子165(VEGF165)基因对胰岛移植物血管再生及移植效果的影响。
将含有VEGF165基因的慢病毒-VEGF165(LV-VEGF165)体外转染大鼠胰岛细胞,移植于近交系SD雄性糖尿病大鼠肾包膜下,设未含有VEGF165基因的LV-AcGFP1为空载体对照组(LV-AcGFP1组)和单独胰岛细胞为空白对照组。ELISA检测VEGF165的体内外表达,胰岛素、CD31免疫组化双染观察胰岛移植物血管化程度及胰岛细胞活性,并比较各组糖尿病大鼠血糖、胰岛素水平及胰岛移植物存活时间。
LV-VEGF165组胰岛细胞体内外分泌的VEGF165浓度均显著高于LV-AcGFP1组和空白对照组(P<0.01)。免疫组化检测LV-VEGF165组每平方毫米胰岛移植物平均微血管密度(MVD)为(24.3±3.7),显著大于LV-AcGFP1组(12.4±2.5)及空白对照组(12.7±2.1,P<0.01),胰岛素染色强度于LV-VEGF165组高于LV-AcGFP1组及空白对照组。多元分析糖尿病大鼠血糖、胰岛素水平,LV-VEGF165组优于LV-AcGFP1组和空白对照组(P<0.01);LV-VEGF165组胰岛移植物于移植术后平均生存时间(MST)经log-rank检验长于LV-AcGFP1组及空白对照组(P<0.01)。
转染VEGF165基因具有促进胰岛移植物的血管再生及提高胰岛移植效果的作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前胰岛移植物微血管破坏后血管再生程度不足仍是影响胰岛移植效果的重要原因[1,2]。血管内皮生长因子(VEGF)是血管内皮细胞特异性的生长因子,具有显著促进血管内皮细胞增殖及新生血管形成的功能;但是VEGF在体内代谢快、半衰期极短(VEGF165<6 min),直接注射难以在移植局部维持有效的血药浓度[3,4]。基因治疗可以通过目的基因的细胞内导入实现目的基因产物的持续稳定表达。本研究拟在前期构建慢病毒-VEGF165(lentivirus-VEGF165, LV-VEGF165)载体及其转染脂肪干细胞后表达的研究基础上[5],应用LV-VEGF165转染胰岛细胞,以期实现胰岛细胞持续稳定表达VEGF165蛋白,并观察转染VEGF165基因对胰岛移植物血管重建程度及移植效果的影响。
近交系雄性SD大鼠,体重100~150 g,西安交通大学医学部实验动物中心提供。
胶原酶P购自Roche公司,脲链酶素(STZ)购自Sigma公司,胎牛血清(FBS)及RPMI 1640培养基购自Gibico公司,质粒pLVX-EF1α-IRES2-AcGFP1及Lenti-X™ HTX Packaging System购自Clontech公司,胰岛素、CD31单克隆抗体购自北京中杉公司,VEGF165、胰岛素ELISA试剂盒购自Bender公司。
应用RT-PCR技术克隆目的基因VEGF165片段,用以构建慢病毒主体质粒pLVX-EF1α-VEGF165-IRES2-AcGFP1,大肠杆菌TOP10内转化,并与辅助质粒gag-pro、vpr-pol、Tet-Off®、tat-IRES-rev和包膜质粒env(VSV-G)共转染Lenti-X 293T包装细胞,培养上清液内收集LV-VEGF165,同法制备LV- AcGFP1[5]。
按Lacy方法稍加改良[6]。SD雄性大鼠胆总管内逆行注入含1 mg/ml胶原酶P(PH值7.4)的Hanks液10 ml原位灌注,取下胰腺并剪碎,加入胶原酶P Hanks液10 ml在38 ℃震荡消化20 min,Ficoll 400非连续密度梯度离心法纯化。以胰岛直径类别与换算指数换算成直径150μm的胰岛当量(IEQ)。
将LV-VEGF165按病毒/细胞的感染复数(multiplicity of infection, MOI)为1、10、20、50的比例分别加入到含100 IEQ胰岛细胞的RPMI 1640完全培养基(含体积分数10% FBS、100 μg/L青霉素、100 μg/L链霉素)中,37 ℃、饱和湿度、体积分数5%CO2的条件下培养24 h。荧光显微镜下观察胰岛细胞。每个样品设6个平行孔。以未含有VEGF165基因的LV-AcGFP1转染胰岛细胞,作为空载体对照组(LV-AcGFP1组);RPMI 1640完全培养基处理的单独胰岛细胞作为空白对照组。ELISA试剂盒测定胰岛细胞培养上清液中VEGF165的浓度,确定最佳MOI。
取体重100~150 g近交系SD大鼠,按150 mg/kg体重单剂量经腹腔注射20 mg/ml STZ,注射前后非禁食状态下每天尾静脉采血测定血糖浓度,血糖浓度连续≥16.7 mmol/L并维持3 d以上,定义为成功的糖尿病模型[7]。
糖尿病模型大鼠随机分为3组行肾包膜下胰岛移植,每组6只,LV-VEGF165组为转染VEGF165基因的胰岛移植,LV- AcGFP1组为转染空载体的胰岛移植,空白对照组为单独胰岛移植。糖尿病模型大鼠用100 g/L水合氯醛按2 mg/kg剂量进行腹腔注射麻醉。麻醉满意后,无菌操作打开腹腔显示左肾包膜下极,无菌注射500 IEQ的胰岛于肾包膜内,烧灼封闭肾包膜的刺口,关腹[8]。移植前,移植后每天尾静脉采血测定血糖浓度,同时ELISA试剂盒测定血清胰岛素、VEGF165浓度。随机血糖浓度连续2 d≤11.1 mmol/L定义为移植胰岛存活,超过3 d≥16.7 mmol/L定义为移植胰岛功能丧失。记录每组胰岛移植物平均存活时间(Mean survival time, MST)。
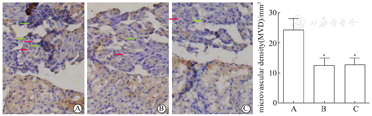
取移植后第14天的胰岛移植物,4 g/L的多聚甲醛中固定24 h,然后制作4 μm的石蜡切片,行兔抗鼠胰岛素单克隆抗体及羊抗鼠CD31单克隆抗体免疫组化双染。微血管密度(microvascular density, MVD)的测量参照Sakata报道的实验方法[9],根据移植物CD31免疫组化染色,在100倍光镜下记录5个视野内CD31阳性血管的数目,计算单位面积的平均MVD。
数据以均数±标准差( ±s)表示,应用SPSS 19.0软件进行统计学处理,采用One-way ANOVA伴随LSD-t检验分析各组数据,血糖及血清胰岛素变化水平采用多元分析,胰岛移植后对胰岛移植效果进行Kaplan-Meier生存分析和log-rank检验。P<0.05时认为差异有显著性。
±s)表示,应用SPSS 19.0软件进行统计学处理,采用One-way ANOVA伴随LSD-t检验分析各组数据,血糖及血清胰岛素变化水平采用多元分析,胰岛移植后对胰岛移植效果进行Kaplan-Meier生存分析和log-rank检验。P<0.05时认为差异有显著性。
纯化后收获的胰岛形态完整,直径50~350 μm,80%集中在100~300 μm范围,平均直径为(155±86)μm。每个胰腺可获得(673±124)个胰岛,换算成每个胰腺的平均当量为(1 283±436)IEQ;计算每个胰腺所收获胰岛的纯度为(87.61±7.78)%。
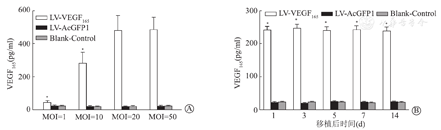
LV-VEGF165转染胰岛细胞24 h后,LV-VEGF165成功转染胰岛细胞,荧光显微镜下可见胰岛细胞内绿色荧光表达(AcGFP1)表达(图1),胰岛细胞感染率达90%以上。ELISA检测各组胰岛细胞分泌入上清液中VEGF165浓度结果显示,MOI为1、10、20、50时,VEGF165浓度于LV-VEGF165组均高于LV-AcGFP1组及空白对照组(P<0.01),LV-AcGFP1组与空白对照组比较,差异无统计学意义(P>0.05),说明LV-VEGF165转染胰岛细胞后体外成功表达目的基因VEGF165蛋白;不同MOI时LV-VEGF165组VEGF165浓度结果显示,MOI=20、50时分别为(478.64±89.31)pg/ml、(486.14±77.42)pg/ml均高于MOI=1、10时(45.76±8.47)pg/ ml、(281.46±63.16)pg/ml(P<0.01),MOI=20、50时VEGF165浓度差异均无显著性(P>0.05),结合不同MOI时胰岛细胞内绿色荧光表达强度,说明LV-VEGF165体外转染胰岛细胞的最佳MOI=20(图2A)。ELISA检测胰岛细胞移植后第1、3、5、7、14天LV-VEGF165组血清VEGF165浓度分别为(241.67±10.34)pg/ml、(247.81±11.78)pg/ml、(239.74±12.21)pg/ml、(242.83±11.24)pg/ml、(238.52±12.71)pg/ml均高于LV-AcGFP1组的(21.37±2.43)pg/ml、(19.24±2.41)pg/ml、(24.38±2.74)pg/ml、(22.44±3.04)pg/ml、(23.21±2.62)pg/ml及空白对照组的(22.74±2.31)pg/ml、(23.31±2.47)pg/ml、(22.81±2.97)pg/ml、(20.14±2.84)pg/ml、(22.73±2.42)pg/ml(P<0.01),各组血清VEGF165浓度结果显示,转染LV-VEGF165的胰岛细胞在体内能够稳定表达VEGF165蛋白(图2B)。


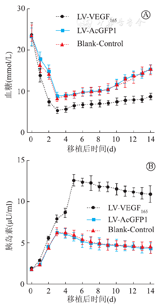
多元分析结果显示,胰岛细胞移植后,LV-VEGF165组血糖及血清胰岛素浓度与LV-AcGFP1组及空白对照组比较,差异均有显著性(P<0.01);LV-AcGFP1组与空白对照组比较,无统计学意义(P>0.05,图3)。LV-AcGFP1组及空白对照组血糖浓度于移植术后下降3 d后均逐渐升高,后分别波动于8.98~15.31 mmol/L及8.83~15.08 mmol/L;LV-VEGF165组血糖浓度于移植术后第2天恢复到正常水平(图3A)。LV-VEGF165组血清胰岛素浓度于移植术后第5天达到峰值,后保持在12.57~10.91μU/ml的高水平;LV-AcGFP1组及空白对照组于移植术后升高3 d后分别维持在4.04~6.08 μU/ml及4.43~6.32 μU/ml的相对较低水平(图3B)。

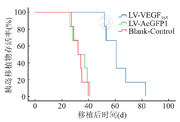
LV-VEGF165组胰岛移植术后胰岛移植物平均存活时间(MST)为(63.33±4.54)d,LV-AcGFP1组及空白对照组胰岛移植术后胰岛移植物MST分别为(34.83±2.55)d、(33.50±2.50)d。经log-rank检验,LV-VEGF165组胰岛移植物MST与LV-AcGFP1组及空白对照组比较,差异均有显著性(P<0.01);LV-AcGFP1组胰岛移植物MST与空白对照组比较无明显差异(P>0.05,图4)。

胰岛移植后第14天,经CD31和胰岛素免疫组化酶双染,分泌胰岛素的活性胰岛细胞被染成棕色,表达CD31的ECs被染成蓝色,结果显示,LV-VEGF165组胰岛移植物的胰岛素染色强度高于LV-AcGFP1组及空白对照组,LV-AcGFP1组及空白对照组比较无明显差别。LV-VEGF165组胰岛移植物的ECs密度大于LV-AcGFP1组及空白对照组,并可见血管腔形成;LV-AcGFP1组及空白对照组比较胰岛移植物的ECs密度无明显差别,较少血管形成(图5)。对各组光镜下CD31阳性血管计数结果显示,LV-VEGF165组平均每平方毫米移植物微血管密度(MVD)为24.3±3.7,显著高于LV-AcGFP1组的12.4±2.5及空白对照组的12.7±2.1(P<0.01);LV-AcGFP1组的MVD与空白对照组比较,差异无统计学意义(P>0.05)。

胰岛移植Edmonton方案提出至少需要2个或2个以上的胰腺消化的胰岛才能满足糖尿病患者的需要,这提示有胰岛细胞在移植以后可能发生大量丢失[10,11]。胰岛的分离纯化过程中移植物微血管的破坏,移植早期胰岛血管再生尚未完成阶段造成的缺血缺氧损伤所致胰岛细胞的坏死或凋亡可能是其主要原因之一[12]。Olsson等[13]发现,由于缺血缺氧等因素的影响,胰岛移植后大约只有30%~50%的胰岛移植物能够稳定地植入受体移植部位。同时Carlsson等[14]发现,相对于实体器官(如肾脏、肝脏、胰腺等)移植的血管吻合后血流快速恢复至正常,胰岛移植的移植物血流则更低,即使移植的中晚期其血流量也仅为原位胰岛的25%~50%,并且不随时间而增加。因此,促进胰岛移植物血管重建,减少其缺血缺氧损伤所致的胰岛细胞丢失及功能受损已成为胰岛移植面临的一个重要课题。
血管生成受血管生成素(angiopoietin)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、肝细胞生长因子(hepatocyte growth factor, HGF)、表皮生长因子(epidermal growth factor, EGF)、血小板源性生长因子(platelet derived growth factor, PDGF)及血管内皮生长因子(VEGF)等多种生长因子的调节[15,16]。其中VEGF是血管内皮细胞特异性的生长因子,具有显著促进新生血管形成的功能,而VEGF165是其最主要的异构体及生物学作用的主要形式,能够在正常组织及病理组织中广泛表达[17,18]。但是,由于VEGF体内应用存在代谢快、半衰期极短(VEGF165<6 min),直接体内注射又难以在移植局部维持有效的血药浓度,且受移植部位的限制(只能在皮下等容易注射的部位进行治疗)等不利因素,限制了其在体内实验及临床研究中的直接应用[3,4]。同时研究发现组织在受到缺血、缺氧刺激时,内源性VEGF表达虽有所增加,但其表达量不足以尽快恢复微循环内皮细胞的完整性[19]。Sigrist等亦在胰岛移植物血管再生的研究中证明了上述观点[20]。为克服VEGF体内应用的不利因素,有研究应用改良微囊等VEGF缓释系统以促进胰岛移植物血管重建,但结果发现VEGF在体内持续时间仍较短(1~3 d),不能满足移植胰岛血管重建的需要[21]。基因治疗的研究进展为VEGF的体内应用提供了新的选择,其中用于基因治疗的慢病毒载体具有转染稳定,可以整合目的基因到宿主细胞基因组中,实现目的基因的稳定长期表达的特点,近年来在基因治疗的研究中应用日益广泛[22,23,24]。我们前期已进行的构建LV-VEGF165载体及其转染脂肪干细胞后表达的研究发现,LV-VEGF165转染脂肪干细胞后能够实现VEGF165蛋白的体内外持续稳定表达,转染VEGF165脂肪干细胞可以作为VEGF165的载体细胞用于基因治疗[5]。
本研究应用LV-VEGF165直接转染胰岛细胞并大鼠肾包膜下移植发现,在移植后第1、3、5、7、14天,LV-VEGF165转染胰岛细胞组的血清VEGF165浓度均高于LV-AcGFP1空载体转染组及单独胰岛移植的空白对照组(P<0.01),说明LV-VEGF165胰岛细胞内转染,能够实现VEGF165蛋白的体内持续稳定表达。同时本研究免疫组化发现,LV-VEGF165组胰岛移植物的血管内皮细胞密度、平均每平方毫米胰岛移植物微血管密度(MVD)及胰岛移植物的胰岛素染色强度均高于LV-AcGFP1组及空白对照组;多元分析糖尿病大鼠胰岛移植后血糖和胰岛素浓度结果显示,LV-VEGF165组血糖控制水平及血清胰岛素分泌水平优于LV-AcGFP1组及空白对照组(P<0.01);移植胰岛的生存分析显示,LV-VEGF165组胰岛移植物平均存活时间(MST)长于LV-AcGFP1组及空白对照组(P<0.01)。以上实验结果表明,VEGF165基因转染胰岛细胞能够通过胰岛细胞持续稳定分泌VEGF165蛋白促进胰岛移植物的血管再生、减少胰岛移植物缺血缺氧损伤,从而提高胰岛移植的效果。



























