
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自启动器官捐献工作以来,我国器官捐献例数逐年增加,累积已超过一万例,已成为移植器官的主要来源[1]。器官捐献工作的快速推进在拯救大量器官功能衰竭患者生命的同时,也给移植界带来了一个重大挑战,即供者来源性感染(Donor-derived Infection,DDI)[2]。DDI是指在器官捐献后,捐献者体内存在的病原体通过器官移植过程使受者罹患相同的感染。
绝大部分捐献者入住过重症监护病房(ICU),可能经历重大手术,持续气管插管或切开行机械通气,留置深静脉导管、导尿管等各种导管,时常需要血液透析、人工肝、体外膜肺氧合(ECMO)等治疗,因此发生院内感染,特别是多重耐药菌感染的风险明显增高。部分捐献者可能携带多重耐药菌而不发病,但其体内的定植菌可以导致相应受者发生DDI。同时,捐献者大多病情危重,可以用于筛查潜在或活动性感染的时间窗很短。这给DDI的诊治带来极大的困难。
鉴于DDI的发生、诊断、治疗和预防与多个学科密切相关,为应对DDI的挑战,由中华医学会器官移植学分会感染学组发起,并召集中华器官移植杂志、北京协和医院、广州中山大学附属第一医院、上海华山医院、上海中山医院、上海长海医院在重症医学、院感防控、微生物学和抗感染药物等方面的专家共同拟定了本共识,并向中国移植界专家广泛征询意见,以期为各移植中心和器官获取组织(OPO)提供可借鉴的DDI防控措施,降低我国DDI发生率和死亡率。
需要说明的是,第一、本共识内容主要关注潜在捐献者("供者")感染的筛查与控制,不涉及捐献者生命状态及器官功能的评估与维护;第二、由于我国器官捐献起步比较晚,在DDI方面缺乏全面的监控数据和临床证据,所以本共识推荐意见暂时未给出推荐等级。
目前,欧美等多个国家已建立了DDI的监测系统[3,4,5,6],但DDI的真实发病率很难确定,文献报道发病率低于1%[3],虽然DDI的发病率不高,但累及的受者并发症发生率和死亡率将明显升高[7]。已报道的DDI病原体见表1。2005年至2011年美国器官获取和移植网(OPTN)报道的DDI病原体中病毒比例最高,占33.1%,其他依次为细菌(23.4%)、真菌(21.4%)、寄生虫(15.2%)和分枝杆菌(6.9%),145例确诊的DDI病例中,病死率高达55.7%[8]。由于不同地区感染的流行病学以及供者感染传播风险不同,DDI的病原体也不尽相同[9]。
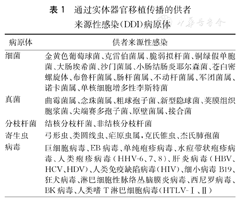
通过实体器官移植传播的供者来源性感染(DDI)病原体
通过实体器官移植传播的供者来源性感染(DDI)病原体
| 病原体 | 供者来源性感染 |
|---|---|
| 细菌 | 金黄色葡萄球菌、克雷伯菌属、脆弱拟杆菌、铜绿假单胞菌、大肠埃希菌、沙门菌属、小肠结肠炎耶尔森菌、苍白密螺旋体、布鲁杆菌属、肠杆菌属、不动杆菌属、军团菌属、诺卡菌属、单核细胞增多性李斯特菌 |
| 真菌 | 曲霉菌属、念珠菌属、粗球孢子菌、新型隐球菌、荚膜组织胞浆菌、尖端赛多孢子菌、原壁菌属、接合菌 |
| 分枝杆菌 | 结核分枝杆菌、非结核分枝杆菌 |
| 寄生虫 | 弓形虫、类圆线虫、疟原虫属,克氏锥虫、杰氏肺孢菌 |
| 病毒 | 巨细胞病毒、EB病毒、单纯疱疹病毒、水痘带状疱疹病毒、人类疱疹病毒(HHV-6、7、8)、肝炎病毒(HBV、HCV、HDV)、人类免疫缺陷病毒(HIV)、细小病毒B19、狂犬病毒、淋巴细胞性脉络丛脑膜炎病毒、西尼罗病毒、BK病毒、人类嗜T淋巴细胞病毒(HTLV-Ⅰ、Ⅱ) |
我国尚未建立DDI监测系统,目前只有各移植中心零散的DDI病例报告。为了解目前我国DDIs的流行病学现状,本共识撰写组撰写前在全国范围内选取了具有代表性的11家移植中心(所有中心都自愿参加并确认数据真实),回顾性调查了DDI相关严重不良事件的发生情况,调查时间从2015年1月1日至2016年12月31日,DDI相关严重不良事件定义为因DDI接受二次手术、移植物切除和受者死亡。结果显示,在此期间11家中心共有4 419例肝肾移植受者,发生DDIs相关严重不良事件45例,发生率为1.02%;感染部位依次为手术部位27例(占60%,其中器官/腔隙22例,深部手术切口5例),血流感染16例(占35.6%),狂犬病毒感染2例(占4.4%);其中死亡18例(40%)。
明确的48例次感染的病原体中,细菌41例,占85.4%(其中耐碳青霉烯肺炎克雷伯菌17例(41.5%),耐万古霉素肠球菌7例(17.1%),耐碳青霉烯铜绿假单孢菌5例(12.2%),耐碳青霉烯大肠埃希菌4例(9.8%),耐碳青霉烯鲍曼不动杆菌4例(9.8%),耐甲氧西林金黄色葡萄球菌3例(7.3%),凝固酶阴性葡萄球菌1例(2.4%));真菌5例,占10.4%,其中念珠菌4例(80%);狂犬病毒2例,占4.2%。由于本次调查以严重不良事件为对象,乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)及结核等DDI事件可能存在漏报。在引起上述DDI相关严重不良事件的17例供者中,9例(52.9%)送检血培养,其中1例培养阳性(11.1%),余为阴性;3例(17.6%)行尿培养,均为阴性;3例(17.6%)行痰培养,其中2例阳性;6例行保存液培养(35.3%),均为阳性(100%)。
推荐意见:
1.目前多重耐药细菌,特别是耐碳青霉烯肠杆菌科细菌是我国DDI严重不良事件的主要病原体,其次为真菌,病毒感染引起严重不良事件发生率不高,但狂犬病毒不可忽视。
2.DDI防控重在源头,必须从供者筛查和维护入手,重症医学、院感防控、微生物学、感染病学等多学科密切协作才能达到良好效果。
在许多情况下DD供者的生命体征极度不稳定,留给捐献工作的时间窗很有限,此时需要在短时间(经常在24 h内)内完成必要的感染相关筛查和评估,以确定供器官的可用性。虽然在如此短时间内不可能完全消除感染传播的风险,但是通过详细的病史询问、全面的临床评估和必要的实验室筛查,可以尽可能对DDI风险进行有效的评估,审慎权衡减少感染风险和器官弃用浪费之间的关系[10,11,12,13]。
病史询问包括供者的现病史、既往史、个人史、手术和外伤史。对昏迷患者必须明确其病因,询问病史时应特别关注是否有感染性疾病、血制品的应用、疫苗的接种及职业暴露情况等。注意供者的旅游史,尤其是地方性感染(如组织胞浆菌、芽生菌、球孢子菌、南美稚虫、线虫等)暴露的风险。如果有明确的地方性感染暴露,需要采取额外增加供者筛查手段或者受者预防措施。了解供者有无结核病、人类免疫缺陷病毒(HIV)、HBV、HCV或其他传染性疾病的接触史,非法药物的使用史,冶游史,有无监禁史以及与动物(特别是狗、猫、蝙蝠及啮齿类等动物)的接触史等,为进一步的实验室筛查提供依据[10]。
推荐意见:
1.不明原因的脑死亡,或已知的致病因素不足以解释脑死亡时,建议放弃捐献。
2.近期有狗、猫、蝙蝠及啮齿类等动物咬伤或抓伤史需排除狂犬病等相关疾病。
3.需重视某些可能增加传播HIV、HBV和HCV风险的行为(表2)。

供者可增加传播人类免疫缺陷病毒(HIV)、HBV和HCV风险的行为
供者可增加传播人类免疫缺陷病毒(HIV)、HBV和HCV风险的行为
| 编号 | 传播人类免疫缺陷病毒(HIV)、HBV和HCV风险的行为 |
|---|---|
| (1) | 在之前的12个月与已知或怀疑有HIV、HBV或HCV的人有性行为 |
| (2) | 在之前的12个月男男性行为(MSM) |
| (3) | 在之前的12个月女人与发生过男男性行为的男人进行性接触 |
| (4) | 在之前的12个月卖淫 |
| (5) | 在之前的12个月与静脉注射、肌注、皮下注射毒品的人发生性关系 |
| (6) | 生母患有HIV、HBV或HCV(婴儿捐赠者≤2岁) |
| (7) | 在之前的12个月静脉注射、肌注、皮下注射毒品药物 |
| (8) | 在之前的12个月进行过梅毒、淋病、衣原体治疗,或发生过生殖器溃疡 |
临床评估包括体格检查和必要的辅助检查,应重点监测供者的生命体征包括体温、心率、血压、呼吸、血氧饱和度和尿量等。识别供者可能发生感染的表现,判断有无感染的发生[13]。
体格检查应重点关注体表有无脓肿、溃疡、淋巴结肿大、创伤部位或伤口及引流液等有无感染表现,对于可疑感染的部位或体液应留取标本以便进一步筛查。对于有手术或外伤病史的供者应明确有无肠内容物的溢出,有无明显的脓液或感染的器官或血管等[10]。此外,检查供者体表有无针眼、纹身、耳洞或身体穿洞等情况,如有应列为血源性传播疾病如HIV、HBV和HCV等的高危供者,并予以相应病原学的筛查[12,14]。
对可能发生感染的部位和(或)捐献的器官进行相应的影像学检查,如胸部X线片、肝肾B型超声、心脏彩色超声、头颅及胸、腹部CT等,为进一步的病原学检查提供依据[10]。
推荐意见:
1.对于突发意识障碍、体温≥38 ℃或≤36 ℃、呼吸加快(RR≥22次/分)、血压下降(SBP≤90 mmHg、DBP≤60 mmHg或MAP≤65 mmHg,1 mmHg=0.133 kPa)、血氧饱和度下降(SpO2≤90%)、尿量减少(≤0.5~1.0 ml·kg-1·h-1)的供者,应积极寻找可能的感染因素[13]。
2.全面细致的体格检查对感染状态及可能致病原的评估具有不可替代的作用。
3.胸部X线片和腹部B型超声是必不可少的检查,关注肺部活动性结核的表现和腹部器官有无脓肿形成,必要时增加胸、腹部CT,心脏彩色超声、头颅CT或磁共振成像(MRI)等。
对所有供者都应常规监测血常规和C反应蛋白(C-reactive protein,CRP),前者主要是白细胞计数(WBC)和分类计数(包括粒细胞NE、淋巴细胞LY和单核细胞MO)。对于WBC增多(≥10.0×109/L)或减少(≤3.0×109/L),NE%增多或者出现"核左移"时,提示可能有感染发生。CRP是敏感但特异性不高的炎症指标。CRP≥40 mg/L多提示感染的存在,≥100 mg/L多提示脓毒症或侵袭性感染可能。除此之外还应酌情开展下列检测[15]。
由于病毒培养技术要求高,一些常见血源性传播的病毒性疾病主要依靠血清学检测发现。核酸检测(nucleic acid tests,NAT)可用于发现常规血清学筛查漏诊的感染[10,11,12]。
目前供者必需进行筛查的血清学检查包括:(1)HIV抗体;(2)HBV的血清学检测,包括HBsAg、HBsAb、HBeAg、HBeAb、HBcAb;(3)HCV抗体;(4)梅毒螺旋体和非梅毒螺旋体检测(TPHA或TPPA或FTA-Abs+快速血浆反应素试验RPR);(5)巨细胞病毒(CMV)抗体。(6)EB病毒抗体[10,11,12]。
其他可以进行筛查的检测包括:(1)HIV、HCV和(或)HBV的NAT(对于具有高危病史/个人史的供者);(2)人类嗜T淋巴细胞病毒(HTLV-1/2)抗体(主要针对日本西南部岛屿等特定地区);(3)单纯疱疹病毒IgG抗体;(4)水痘带状疱疹病毒(VZV)抗体;(5)弓形虫抗体(仅针对心脏移植的供者);(6)西尼罗河病毒(WNV)的血清学检测或NAT(主要针对高发地区或高发季节时);(7)球孢子虫血清学、类园线虫血清学和克氏锥虫血清学检测(针对来自有地方性疾病的供者);(8)BK病毒血清学检测(针对肾移植供者)[10,11,12]。
针对以上供(受)者血清学和核酸检测结果应给予的措施(表3) [10]。
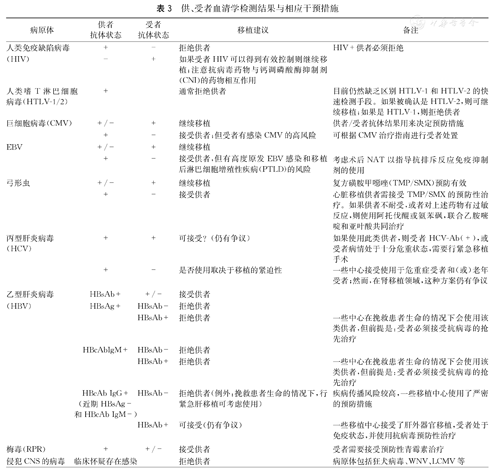
供、受者血清学检测结果与相应干预措施
供、受者血清学检测结果与相应干预措施
| 病原体 | 供者抗体状态 | 受者抗体状态 | 移植建议 | 备注 |
|---|---|---|---|---|
| 人类免疫缺陷病毒 | + | - | 拒绝供者 | HIV+供者必须拒绝 |
| (HIV) | - | + | 如果受者HIV可以得到有效控制则继续移植;注意抗病毒药物与钙调磷酸酶抑制剂(CNI)的药物相互作用 | |
| 人类嗜T淋巴细胞病毒(HTLV-1/2) | + | 通常拒绝供者 | 目前仍然缺乏区别HTLV-1和HTLV-2的快速检测手段。如果被确认是HTLV-2,则可继续移植;如果是HTLV-1,则拒绝供者 | |
| 巨细胞病毒(CMV) | +/- | + | 继续移植 | 供者/受者抗体结果用来决定预防措施 |
| + | - | 接受供者;但受者有感染CMV的高风险 | 可根据CMV治疗指南进行受者处置 | |
| EBV | +/- | + | 继续移植 | |
| + | - | 接受供者,但有高度原发EBV感染和移植后淋巴细胞增殖性疾病(PTLD)的风险 | 考虑术后NAT以指导抗排斥反应免疫抑制剂的使用 | |
| 弓形虫 | +/- | + | 继续移植 | 复方磺胺甲噁唑(TMP/SMX)预防有效 |
| + | - | 接受供者 | 心脏移植供者需接受TMP/SMX的预防性治疗。如果供者不耐受,或者对上述药物有过敏反应,则使用阿托伐醌或氨苯砜,联合乙胺嘧啶和亚叶酸共同治疗 | |
| 丙型肝炎病毒(HCV) | + | + | 可接受?(仍有争议) | 如果使用此类供者,则受者HCV-Ab(+),或受者病情处于十分危重状态,需要行紧急移植手术 |
| + | - | 是否使用取决于移植的紧迫性 | 一些中心接受使用于危重症受者和(或)老年受者;然而,在肾移植领域,这种方案仍有争议 | |
| 乙型肝炎病毒 | HBsAb+ | +/- | 接受供者 | |
| (HBV) | HBsAg+ | HBsAb- | 拒绝供者 | |
| HBsAb+ | 拒绝供者 | 一些中心在挽救患者生命的情况下会使用该类供者,但前提是:受者必须接受抗病毒的抢先治疗 | ||
| HBcAbIgM+ | HBsAb- | 拒绝供者 | ||
| HBsAb+ | 拒绝供者 | 一些中心在挽救患者生命的情况下会使用该类供者,但前提是:受者必须接受抗病毒的抢先治疗 | ||
| HBcAb IgG+(近期HBsAg-和HBcAb IgM-) | HBsAb- | 拒绝供者(例外:挽救患者生命的情况下,行紧急肝移植可考虑使用) | 疾病传播风险较高,一些移植中心使用了严密的预防措施 | |
| HBsAb+ | 可接受(仍有争议) | 一些移植中心接受了肝外器官移植,受者处于免疫状态,并使用抗病毒预防性治疗 | ||
| 梅毒(RPR) | + | +/- | 接受供者 | 受者需要接受预防性青霉素治疗 |
| 侵犯CNS的病毒 | 临床怀疑存在感染 | 拒绝供者 | 病原体包括狂犬病毒、WNV、LCMV等 |
(1)降钙素原(Procalcitonin,PCT):是目前临床常用的判断脓毒症的生物标记物,PCT≥2 μg/L多提示有脓毒症存在,PCT浓度与感染严重程度呈正相关。(2)(1,3)-β-D-葡聚糖试验(G试验):适用于除隐球菌和接合菌(毛霉、根霉)外的所有深部真菌感染的早期诊断,但它只能提示有无真菌侵袭性感染,并不能确定为何种真菌,其敏感性较高但下列情况易出现假阳性:①使用纤维素膜进行血透,标本或患者暴露于纱布或其他含有葡聚糖的材料;②静脉输注免疫球蛋白、白蛋白、凝血因子或血液制品;③链球菌血症;④操作者处理标本时存在污染。故目前认为其阴性预测值高,动态监测意义更大。(3)半乳甘露聚糖试验(GM试验):为侵袭性曲霉菌感染的早期诊断提供依据。常可在患者临床症状出现前5-8天获得阳性结果,并可对血清、脑脊液、支气管肺泡灌洗液进行检测,也可以作为治疗效果的参考指标之一。使用半合成青霉素尤其是哌拉西林/他唑巴坦可出现假阳性,临床上通常与G试验联合检测可以提高对侵袭性真菌病的诊断能力。(4)隐球菌荚膜多糖抗原测定:可取脑脊液或血液进行检测,是新型隐球菌检测的生物标记物,可早期、快速诊断隐球菌感染,其滴度高通常提示预后不良。(5)γ-干扰素释放试验(IGRAs):对辅助诊断活动性结核病与潜伏性结核感染(LTBI)有一定参考价值。仅凭IGRAs阳性不能区分活动性结核病与LTBI。
应常规留取供者的外周血、尿液、痰液或气道分泌物进行病原微生物检查,有条件时可采集组织、脑脊液、引流液、胸腹水或肺泡灌洗液等标本,积极寻找可能的病原微生物,为后续治疗提供指导。
此外,供者器官保存液的细菌和真菌培养也可列为供者感染评估的常规,但由于存在污染的可能,且受到污染的保存液造成的感染传播较为少见,其培养结果是否有实际意义仍存争议[10]。有些中心将器官灌洗前和灌洗后的保存液分别培养,以鉴别保存液自身污染。
(1)直接凃片染色镜检:革兰染色检查普通细菌、抗酸染色检查抗酸杆菌、弱抗酸染色检查奴卡菌、墨汁染色检查新型隐球菌、六胺银染色检查肺孢子菌等,涂片检查能快速提供可能病原体的信息,但一般不能作为确诊依据。(2)培养:尽可能采集供者无菌体液、组织或分泌物等进行细菌、真菌培养。对于可疑感染的供者出现以下任一体征时,均应采集血培养:①发热(≥38 ℃)或低温(≤36 ℃);②寒战;③白细胞计数增加或减少;④皮肤黏膜出血;⑤突发意识障碍;⑥多器官功能衰竭;⑦血压下降;⑧呼吸增快;⑨CRP、PCT增高;⑩G试验和(或)GM试验阳性。怀疑感染性心内膜炎时应重复采集血培养。(3)基于分子技术的病原菌快速检测方法:可以明显缩短病原菌的鉴定时间,目前临床尚未广泛开展,在有特殊需求时可以选择性应用,详见表4。
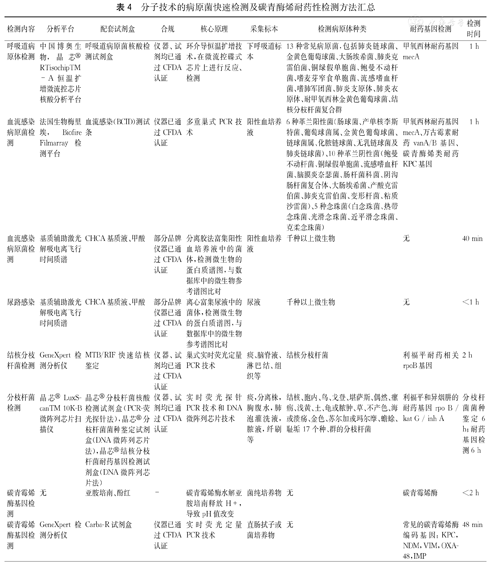
分子技术的病原菌快速检测及碳青酶烯耐药性检测方法汇总
分子技术的病原菌快速检测及碳青酶烯耐药性检测方法汇总
| 检测内容 | 分析平台 | 配套试剂盒 | 合规 | 核心原理 | 采集标本 | 检测病原体种类 | 耐药基因检测 | 检测时间 |
|---|---|---|---|---|---|---|---|---|
| 呼吸道病原体检测 | 中国博奥生物,晶芯® RTisochipTM-A恒温扩增微流控芯片核酸分析平台 | 呼吸道病原菌核酸检测试剂盒 | 仪器、试剂均已通过CFDA认证 | 环介导恒温扩增技术,在微流控碟式芯片上进行反应、检测 | 下呼吸道标本 | 13种常见病原菌,包括肺炎链球菌、金黄色葡萄球菌、大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、流感嗜血杆菌、嗜肺军团菌、肺炎支原体、肺炎衣原体、耐甲氧西林金黄色葡萄球菌、结核分枝杆菌复合群 | 甲氧西林耐药基因mecA | 1 h |
| 血流感染病原菌检测 | 法国生物梅里埃,Biofire Filmarray检测平台 | 血流感染(BCID)测试条 | 仪器已通过CFDA认证 | 多重巢式PCR技术 | 阳性血培养液 | 6种革兰阳性菌(肠球菌、产单核李斯特菌、葡萄球菌属、金黄色葡萄球菌、链球菌属、化脓链球菌、无乳链球菌及肺炎链球菌)、10种革兰阴性菌(鲍曼不动杆菌、铜绿假单胞菌、流感嗜血杆菌、脑膜炎奈瑟菌、肠杆菌科菌、阴沟肠杆菌复合体、大肠埃希菌、产酸克雷伯菌、肺炎克雷伯菌、变形杆菌、粘质沙雷菌)、5种念珠菌(白念珠菌、热带念珠菌、光滑念珠菌、近平滑念珠菌、克柔念珠菌) | 甲氧西林耐药基因mecA、万古霉素耐药vanA/B基因、碳青酶烯类耐药KPC基因 | 1 h |
| 血流感染病原菌检测 | 基质辅助激光解吸电离飞行时间质谱 | CHCA基质液、甲酸 | 部分品牌仪器已通过CFDA认证 | 分离胶法富集阳性血培养液中的菌体,检测微生物的蛋白质谱图,与数据库中的微生物参考谱图比对 | 阳性血培养液 | 千种以上微生物 | 无 | 40 min |
| 尿路感染 | 基质辅助激光解吸电离飞行时间质谱 | CHCA基质液、甲酸 | 部分品牌仪器已通过CFDA认证 | 离心富集尿液中的菌体,检测微生物的蛋白质谱图,与数据库中的微生物参考谱图比对 | 尿液 | 千种以上微生物 | 无 | <1 h |
| 结核分枝杆菌检测 | GeneXpert检测分析仪 | MTB/RIF快速结核鉴定 | 仪器、试剂均已通过CFDA认证 | 巢式实时荧光定量PCR技术 | 痰、脑脊液、淋巴结、组织等 | 结核分枝杆菌 | 利福平耐药相关rpoB基因 | 2 h |
| 分枝杆菌检测 | 晶芯®LuxScanTM 10K-B微阵列芯片扫描仪 | 晶芯®分枝杆菌核酸检测试剂盒(PCR-荧光探针法),晶芯®分枝杆菌菌种鉴定试剂盒(DNA微阵列芯片法),晶芯®结核分枝杆菌耐药基因检测试剂盒(DNA微阵列芯片法) | 仪器、试剂均已通过CFDA认证 | 实时荧光探针PCR技术和DNA微阵列芯片技术 | 痰,分离株,胸腹水,肺泡灌洗液,脓液,纤刷等 | 结核、胞内、鸟、戈登、堪萨斯、偶然、瘰疬、浅黄、土、龟或脓肿、草、不产色、海或溃疡、金色、苏尔加或玛尔摩、蟾蜍、耻垢17个种、群的分枝杆菌 | 利福平和异烟肼的耐药基因rpo B / kat G / inh A | 分枝杆菌菌种鉴定6 h;耐药基因检测6 h |
| 碳青霉烯酶基因检测 | 无 | 亚胺培南、酚红 | - | 碳青霉烯酶水解亚胺培南释放H+,导致pH值改变 | 菌纯培养物 | 无 | 碳青霉烯酶 | <2 h |
| 碳青霉烯酶基因检测 | GeneXpert检测分析仪 | Carba-R试剂盒 | 仪器已通过CFDA认证 | 实时荧光定量PCR技术 | 直肠拭子或菌培养物 | 无 | 常见的碳青霉烯酶编码基因:KPC,NDM,VIM,OXA-48,IMP | 48 min |
推荐意见:
1.基于供者病毒血清学和核酸检测结果给予的措施见表3。NAT阳性率高,但假阳性可能导致可用器官丢弃损失,建议仅在有高风险行为而血清学检测阴性的人群中使用。
2.建议常规检测血常规、CRP、PCT、G试验和GM试验,根据病史酌情选做隐球菌荚膜多糖抗原和IGRAs等。
3.建议第一时间留取供者的外周血、尿液、气道分泌物进行细菌和真菌培养,必要时可采集组织、脑脊液、引流液、胸腹水或肺泡灌洗液等标本。
上述病史、临床表现和实验室检查三方面的信息对快速评估潜在捐献者感染状态缺一不可,应综合分析,对供者感染状态进行风险分层,分为不可接受风险、高风险和低风险(表5)。对于不可接受风险的供者(表6),应禁止器官捐献,除非用于个别的没有其他治疗措施的挽救生命的移植手术;高风险供者应尽可能在捐献前采集标本送检并密切关注结果,尽早明确病原体种类及其耐药状况,以便及时调整对供(受)者的抗感染治疗方案。

供者的风险分层
供者的风险分层
| 供者风险级别 | 内 容 |
|---|---|
| 不可接受风险 | 具有器官捐献禁忌证的供者(表6) |
| 高风险 | (1)评估过程中发现传染性病原体,但受者的健康状况和临床病情严重程度需要移植,此时允许移植给患同种病或有血清学保护的受者或受者移植后予以抢先治疗或预防治疗的情况 |
| (2)患菌血症和(或)细菌性脑膜炎的供者经过至少24~48 h的针对性抗生素治疗后病情缓解的 | |
| (3)无法对传染性疾病的风险进行适当的评估 | |
| 低风险 | 评估过程中未发现传染性疾病,供者也无急性感染表现 |

罹患有下列疾病的供者禁止行器官捐献
罹患有下列疾病的供者禁止行器官捐献
| 编号 | 疾病名称 | ||
|---|---|---|---|
| (1) | 多重耐药菌特别是耐碳青霉烯肠杆菌菌血症 | ||
| (2) | 活动性结核 | ||
| (3) | 未经治疗的细菌或真菌脓毒症(如念珠菌血症) | ||
| (4) | 地方流行性真菌病的活动性感染(如芽生菌、孢子菌、组织孢浆菌) | ||
| (5) | 未经治疗的梅毒 | ||
| (6) | 潜在的中枢性感染 | ||
| ① | 不明原因的中枢神经系统的感染(脑炎、脑膜炎) | ||
| ② | 单纯疱疹病毒性脑炎或其他脑炎 | ||
| ③ | 曾有多瘤病毒JCV感染的病史 | ||
| ④ | WNV感染 | ||
| ⑤ | 狂犬病 | ||
| ⑥ | 克雅氏病 | ||
| ⑦ | 未经治疗的隐球菌感染 | ||
| ⑧ | 其他真菌或病毒性脑炎 | ||
| (7) | 活动性病毒血症:疱疹病毒(HSV、CMV、VZV)、急性EBV感染(单核细胞增多症) | ||
| (8) | 活动性肝炎(甲型肝炎必须排除,乙型肝炎、丙型肝炎的供者器官使用必须获得知情同意) | ||
| (9) | 血清学或分子学诊断人类嗜T细胞病毒(HTLV-1/2)感染 | ||
| (10) | HIV感染(血清学或分子学诊断) | ||
| (11) | 未经治疗的寄生虫感染(克氏锥虫、利什曼原虫、圆线虫) | ||
潜在捐献者往往处于或濒临脑死亡状态,大部分需要在重症监护病房(ICU)内维护。其基础疾病的病理状态、使用呼吸机等各类侵入性操作与治疗手段,均为发生院内感染的高危因素,且病原体可能是多重耐药菌(Multidrug-Resistant Organism,MDRO)。因此,在完成快速评估后、捐献实施前,对供者进行感染的预防、筛查及治疗十分重要,是ICU内供者维护的必要环节。
大部分医院的ICU均是MDRO的流行区域,各单位ICU应参照2017年开始执行的我国《重症监护病房医院感染预防与控制规范》WS 509-2016[17],严格执行ICU医院感染预防与控制的基本要求,包括建筑布局与必要设施及管理要求、人员管理、医院感染的监测、器械相关感染的预防和控制措施、手术部位感染的预防与控制措施、手卫生要求、环境清洁消毒方法与要求、床单元的清洁与消毒要求、便器的清洗与消毒要求、空气消毒方法与要求等。特别是收治潜在捐献者的ICU一定要加强对MDRO传播的控制,具体方案如下。
建议将MDRO定植或感染患者尽可能单间隔离,不宜将此类患者与潜在捐献者安置在同一房间。若条件限制无法单间隔离时可采取床边隔离。下达接触隔离医嘱,床旁有明显隔离标识,接触患者时医务人员应该穿戴隔离衣并且带一次性手套和口罩[18]。
MDRO感染或定植患者床边应单独配备含有乙醇的速干手消毒剂消毒。医护人员接触患者后应及时认真做好手卫生。
使用专用的抹布对环境物品进行清洁和消毒,推荐使用具有高水平消毒的一次性湿巾纸擦拭。在MDRO感染或定植患者诊疗过程中产生的医疗废物,应当用双层黄色医疗废物袋收集。相关低值医疗器械、器具及物品要专人专用,并及时消毒处理。
MDRO主动筛查通常选择细菌定植率较高,且方便采样的2个或2个以上部位采集标本以提高检出率。耐甲氧西林金黄色葡萄球菌(MRSA)主动筛查常选择鼻前庭拭子,并结合肛拭子或伤口取样标本;耐万古霉素的肠球菌(VRE)主动筛查常选择粪便、肛拭子样本;多重耐药革兰阴性菌主动筛查标本为肛拭子,并结合咽喉部、会阴部、气道内及伤口的标本[18]。
严格掌握抗菌药物应用指征,通过分级管理限制抗菌药物使用。
做到一人一衣一探视,避免交叉感染。
推荐意见:
1.ICU应严格遵循各项院内感染控制措施,预防潜在捐献者感染MDRO。
2.预防性抗感染药物的使用目前尚缺乏循证医学证据,可参考各ICU的微生物流行现状制定方案。
供者在ICU发生感染的高危因素包括:入住时间长(≥2 d)、有外伤或手术史、气管插管或气管切开行机械通气、深静脉置管、导尿管留置、血液透析或ECMO支持治疗、心肺复苏术后、血管活性药物的应用等[19]。对于此类具有发生感染高危因素的潜在供者应加强感染性疾病的动态监测。
推荐意见:
1.实时监测生命体征,第一时间进行感染标志物检测和各种体液微生物培养(具体见第二节),每2~3天复查,定期对感染部位行影像学检查(表7)。
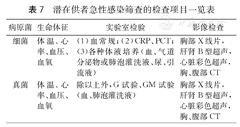
潜在供者急性感染筛查的检查项目一览表
潜在供者急性感染筛查的检查项目一览表
| 病原菌 | 生命体征 | 实验室检验 | 影像检查 |
|---|---|---|---|
| 细菌 | 体温、心率、血压、血氧 | (1)血常规;(2)CRP、PCT;(3)各种体液培养(血、气道分泌物或肺泡灌洗液、尿、引流液) | 胸部X线片,肝肾B型超声,心脏彩色超声,胸、腹部CT |
| 真菌 | 体温、心率、血压、血氧 | 除以上外,G试验、GM试验(血、肺泡灌洗液) | 胸部X线片,肝肾B型超声,心脏彩色超声,胸、腹部CT |
尽管通过严格的感染防控措施可以减少部分外源性医院感染的发生,但危重患者自身内源性感染常难以避免,对潜在捐献者应密切观察有无感染表现,及时识别菌血症,尽早留取微生物检查标本,尽可能根据微生物结果指导抗菌药物治疗,提高器官的可利用率。针对不同的病原菌治疗和供者捐献评估策略如下:
如病原菌为非耐药菌,供者经过≥24 h适当的广谱抗菌药物治疗,可以捐献器官。
对多重耐药菌感染者器官捐献需审慎,其中感染碳青霉烯敏感的供者,应选择敏感的抗菌药物给予足量的标准治疗,临床反应良好者可以捐献。
碳青霉烯耐药的革兰阴性杆菌局部感染时,则可考虑参考(表8)进行治疗,非感染部位的器官可谨慎使用,如为血行感染则不能捐献[20]。
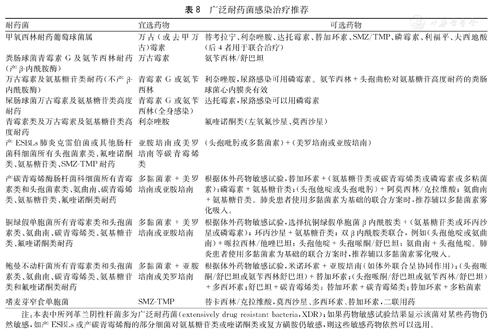
广泛耐药菌感染治疗推荐
广泛耐药菌感染治疗推荐
| 耐药菌 | 宜选药物 | 可选药物 |
|---|---|---|
| 甲氧西林耐药葡萄球菌属 | 万古(或去甲万古)霉素 | 替考拉宁、利奈唑胺、达托霉素、替加环素、SMZ/TMP、磷霉素、利福平、夫西地酸(后4者用于联合治疗) |
| 粪肠球菌青霉素G及氨苄西林耐药(产β-内酰胺酶) | 万古霉素 | 氨苄西林/舒巴坦 |
| 万古霉素及氨基糖苷类耐药(不产β-内酰胺酶) | 青霉素G或氨苄西林 | 利奈唑胺,尿路感染可用磷霉素。氨苄西林+头孢曲松对氨基糖苷高度耐药的粪肠球菌心内膜炎有效 |
| 屎肠球菌万古霉素及氨基糖苷类高度耐药 | 青霉素G或氨苄西林(全身感染) | 达托霉素,尿路感染可以用磷霉素 |
| 青霉素类及万古霉素及氨基糖苷类高度耐药 | 利奈唑胺 | 氟喹诺酮类(左氧氟沙星、莫西沙星) |
| 产ESBLs肺炎克雷伯菌或其他肠杆菌科细菌所有头孢菌素类、氟喹诺酮类、氨基糖苷类、SMZ-TMP耐药 | 亚胺培南或美罗培南等碳青霉烯类 | (头孢吡肟或多黏菌素)+(美罗培南或亚胺培南) |
| 产碳青霉烯酶肠杆菌科细菌所有青霉素类和头孢菌素类、氨曲南、碳青霉烯类、氨基糖苷类、氟喹诺酮类耐药 | 多黏菌素+美罗培南或亚胺培南 | 根据体外药物敏感试验,替加环素+(氨基糖苷类或碳青霉烯类或磷霉素或多粘菌素);磷霉素+氨基糖苷类;(头孢他啶或头孢吡肟)+阿莫西林/克拉维酸;氨曲南+氨基糖苷类。肺炎患者使用多黏菌素为基础的联合方案时,推荐辅以多黏菌素雾化吸入。 |
| 铜绿假单胞菌所有青霉素类和头孢菌素类、氨曲南、碳青霉烯类、氨基糖苷类、氟喹诺酮类耐药 | 多黏菌素+美罗培南或亚胺培南 | 根据体外药物敏感试验,选择抗铜绿假单胞菌β内酰胺类+(氨基糖苷类或环丙沙星或磷霉素);环丙沙星+氨基糖苷类;双β内酰胺类联合,例如(头孢他啶或氨曲南)+哌拉西林/他唑巴坦;头孢他啶+头孢哌酮/舒巴坦;氨曲南+头孢他啶。肺炎患者使用多黏菌素为基础的联合方案时,推荐辅以多黏菌素雾化吸入。 |
| 鲍曼不动杆菌所有青霉素类和头孢菌素类、氨曲南、碳青霉烯类、氨基糖苷类和氟喹诺酮类耐药 | 多黏菌素+亚胺培南或美罗培南 | 根据体外药物敏感试验,米诺环素+亚胺培南(如体外联合呈协同作用);(头孢哌酮/舒巴坦或氨苄西林舒巴坦)+替加环素;(头孢哌酮/舒巴坦或氨苄西林/舒巴坦)+多西环素;舒巴坦+碳青霉烯类;替加环素+碳青霉烯类;替加环素+多粘菌素 |
| 嗜麦芽窄食单胞菌 | SMZ-TMP | 替卡西林/克拉维酸,莫西沙星、多西环素、替加环素,二联用药 |
注:本表中所列革兰阴性杆菌多为广泛耐药菌(extensively drug resistant bacteria,XDR);如果药物敏感试验结果显示该菌对某些药物仍然敏感,如产ESBLs或产碳青霉烯酶的部分细菌对氨基糖苷类或喹诺酮类或复方磺胺仍敏感,则这些敏感药物依然可以选用。
供者器官获取前耐药的革兰阳性球菌检出率较高,包括耐万古霉素的肠球菌(VRE)以及耐甲氧西林金黄色葡萄球菌(MRSA),前者更容易从供者传播给受者[21]。VRE感染的供者可参照相应指南进行规范化治疗,并在治疗后予以评估。
细菌性脑膜炎患者,如果病原菌是肺炎链球菌、脑膜炎奈瑟菌、流感嗜血杆菌、大肠杆菌或B组链球菌,在接受针对性抗菌药物治疗后可以进行器官捐献;如果是高毒性病原体(如李斯特菌),则不适于进行器官捐献。活动性结核感染是移植禁忌证。无活动性结核感染证据的LTBI供者可用于移植。有残余结核病灶的肺不应作为供器官[22]。
处理供者来源真菌感染的核心原则为活动性念珠菌血症以及由隐球菌、曲霉菌、毛霉菌和球胞子菌引起的活动性感染是移植禁忌证[24]。
地方流行性真菌病由于诊断困难、表现隐匿,目前尚无较为规范统一的针对地方性真菌病的供者筛查流程指南。
(1)念珠菌属:尿液/支气管分泌物培养念珠菌阳性的肾/肺移植供者经过恰当的抗真菌治疗后可以考虑器官捐献。气道有念珠菌属定植的肺移植供者,建议使用棘白菌素类药物;氟康唑可用于大多数念珠菌属尿路感染的供者。(2)丝状真菌:侵袭性丝状真菌感染供者不宜捐献器官。参考相应指南进行治疗后的供者是否可以捐献,尚无足够证据说明。(3)隐球菌:经过治疗的供者,只有证实隐球菌感染已经被根治才可行器官捐献。如果供者有神经系统症状如脑膜炎相关症状或者有肺部结节且存在隐球菌感染的高危因素(如合并血液系统肿瘤、接受激素治疗或存在细胞免疫功能障碍等) ,应考虑隐球菌感染的可能。
推荐意见:
1.供者所有部位的感染,都应积极治疗,MDR菌的感染治疗应结合药物敏感试验结果依据PK/PD合理选择抗菌药物。
2.对于病因不明的脓毒症休克供者,不建议进行器官捐献。
3.菌血症供者,由于器官日益紧缺需要慎重考虑弃用此类器官。多重耐药菌感染,例如耐碳青霉烯革兰阴性菌菌血症,特别是CRE,由于此类细菌发生DDI的风险高,受者发病后缺乏有效抗菌药物治疗,死亡率高,不宜进行器官捐献。非碳青霉烯类耐药MDR菌感染者,应在评估治疗效果后审慎决定器官的取舍。
4.对于痰或尿液检出耐药菌的供者是否可以捐献尚无统一意见,但若待移植器官(如肺或者肾脏)检测出耐药菌(特别是碳青霉烯类耐药菌)定植或感染应列为器官捐献禁忌,而其他未累及器官在全身使用敏感抗菌药物基础上,谨慎决定非感染部位的器官使用。
5.原因不明的脑炎供者的器官应避免使用。高毒性菌株或胞内病原体如李斯特菌、结核分枝杆菌引起的脑膜炎是移植禁忌。已知病原体的细菌性脑膜炎和福氏耐格里阿米巴脑膜脑炎的供者,经积极治疗后其捐献的器官可以考虑使用。细菌性脑膜炎供者在移植前需进行抗菌药物治疗24~48 h,最好有临床改善的证据[25]。
6.播散性感染(如栓塞性感染)或活动性心内膜炎供者建议慎重使用。如病原菌为金黄色葡萄球菌或铜绿假单胞菌,一般不建议捐献器官。如果使用,受者应接受不少于6周的抗菌药物治疗。
7.供者仅有呼吸道分泌物细菌或真菌培养阳性,可能为定植,并非是供者捐献除肺之外其他器官的禁忌。
8.活动性结核感染是移植禁忌证。无活动性结核感染证据的LTBI供者可用于移植。有残余结核病灶的肺不应作为供器官。
9.供者发生口腔、皮肤或黏膜的浅表性真菌感染,不是器官捐献的禁忌。但若罹患侵袭性真菌感染,且未接受正规抗真菌治疗是移植禁忌。
10.未经治疗的播散性或中枢神经系统隐球菌感染者不宜捐献器官。
11.某些寄生虫(如克氏锥虫、类圆线虫)为地方性疾病,只需针对特定人群的供者开展检测。在受者知情的情况下,克氏锥虫感染或检测阳性的供者捐献的肝脏或肾脏可以应用,但心脏则不能使用。
由于仅凭临床表现无法确定感染及其病原体,常规培养报告时间滞后,部分非无菌部位标本如痰、尿、引流液培养阳性结果意义解读困难,很多地区尚无能力开展针对病原的分子检测,针对特定地理分布病原体(如克氏锥虫、西尼罗病毒)的筛查试验在非流行地区并非常规开展等原因,供者的感染有漏诊的可能。
另外,部分供者感染病原体明确并已经接受了针对病原体的有效治疗或受者已有主动免疫保护,也会决定使用其捐献的器官进行移植。
对接受感染高风险供者器官移植的受者应采取有效的感染防控措施。
供者HBsAg阳性或HBcAb-IgM阳性,提示HBV感染。此类供肝可在知情同意的前提下,用于挽救HBsAg阳性的肝衰竭受者的生命,并在移植术后继续行核苷类似物治疗。同时,此类供者的肝外器官亦可用于HBsAg阳性的潜在受者,术后需持续核苷类似物治疗。
如术前血清学阴性并已建立HBV主动免疫的潜在受者正处于终末期器官衰竭急需移植挽救生命,在知情同意前提下应用此类器官,可使用乙型肝炎免疫球蛋白及核苷类似物(恩替卡韦ETV、替诺福韦酯TDF等)进行预防[25,26]。
HCV阳性供器官的使用目前存在争议。HCV-RNA阳性提示病毒复制较活跃,病毒传播力也较高;RNA阴性而抗体阳性的供器官,其传播风险尚未定论。直接抗病毒(direct-acting antiviral agents,DAA)小分子药物对受者的预防性使用目前正处于探索阶段。必须在充分告知并签署知情同意后才考虑移植HCV阳性的供器官。
推荐意见:
1.接受HBV阳性器官移植的受者,无论其HBV血清学阳性或阴性,都需进行预防性治疗。
2.HCV阳性供器官的使用目前存在争议,其受者预防性使用DAA小分子药物目前正处于探索阶段。
建议受者在移植术后即刻及有发热等临床症状怀疑感染时行血、移植物相关部位、尿、痰等部位病原学检查;并接受广谱抗菌药物治疗,在确认供者特异性病原体后,根据药物敏感试验结果调整用药方案。疗程常为7~14 d[25],可根据病原体种类(MDR菌)及感染部位(如侵犯血管吻合口或者血管内皮)等具体情况适当延长疗程。
建议受者需接受敏感抗菌药物治疗至少2周。金黄色葡萄球菌或铜绿假单胞菌感染性心内膜炎供者的器官,一般不建议应用,但若各种原因选择应用后,建议抗菌疗程至少6周[23]。
因很难保证器官获取当时,呼吸道病原体是否已移行入血,对此类供者推荐在移植前留取外周血和器官保存液送培养,关注其结果是否与呼吸道分泌物一致。必要时给予受者针对性的药物治疗。
受者在移植后通常需要接受7~14 d的针对性抗菌药物治疗[25]。
如果供者有明确的福氏耐格里阿米巴脑膜脑炎,感染风险很小,只要告知受者风险、密切监测即可。
对于面临MDRO DDI感染风险的受者,预防性治疗的报道较少。供者存在菌血症或活动性细菌感染累及待捐献的器官,其受者应接受至少14天的敏感的抗菌药的治疗。如果为毒力较低的细菌感染、受者临床情况良好且移植后血培养阴性可考虑更短的疗程,但至少7天。如果为碳青霉烯耐药革兰阴性菌,建议采用两药联合预防治疗(具体方案参见表8),治疗时间应根据治疗反应、感染源控制情况以及不良反应来决定。
控制供者来源结核感染应提高对结核感染的警惕性及识别能力。目前针对受者术后潜伏或者无症状的活动性结核分枝杆菌感染,尚无有效可靠的筛查手段,因此临床出现疑似感染,需要进行仔细的问诊及体格检查,结合实验室、肺部影像学等多种检查,全面仔细地进行分析。接受未经正规治疗的LTBI供者的受者,尤其是肺移植受者应该接受预防性抗结核治疗[19,22]。
推荐意见:
1.接受细菌感染供者器官的受者处理核心原则(表9)。

接受不同细菌感染风险器官受者的防治原则
接受不同细菌感染风险器官受者的防治原则
| 供者细菌感染情况 | 受者监测措施 | 受者抗感染治疗 | |
|---|---|---|---|
| 临床排除细菌感染 | 常规尿、痰、引流液培养,取样频次一般每周2次 | 按切口类型,常规预防性使用抗生素 | |
| 非耐药菌局部感染 | 未累及移植器官 | 常规尿、痰、引流液培养,取样频次一般每周2次 | 按切口类型,常规预防性使用抗生素。脑膜炎因经常引起隐匿性菌血症,参照菌血症处理 |
| 累及移植器官 | 常规尿、痰、引流液培养,血CRP、PCT检查,每周2次。移植部位B型超声,每周1~2次 | 敏感抗生素针对性治疗7 d | |
| 多重耐药菌(MDRO)局部感染 | 未累及移植器官 | 常规尿、痰、引流液培养,血CRP、PCT检查,每周2次 | 需接受针对性药物治疗2周;若病原体致病力较低,可缩短疗程 |
| 累及移植器官 | 常规血、尿、痰、引流液培养,血CRP、PCT,G/GM实验,1次/2~3 d。移植部位B型超声,每周1~2次,必要时CT检查 | 针对性药物治疗,CRGN建议两药联合治疗至少两周,建议预防性抗真菌治疗。治疗时间应个体化,根据治疗反应、感染控制情况以及不良反应来决定 | |
| 菌血症 | 非耐药菌 | 常规血、尿、痰、引流液培养,血CRP、PCT检查,每周2次 | 针对性药物治疗7~14 d |
| MDRO | 常规血、尿、痰、引流液培养,血CRP、PCT,G/GM实验,1次/2~3 d。移植部位B超,每周1~2次,必要时CT检查 | 针对性药物治疗,CRGN建议两药联合治疗至少两周,建议预防性抗真菌治疗。治疗时间应个体化,根据治疗反应、感染控制情况以及不良反应来决定 | |
如器官保存液涂片看到酵母菌或念珠菌属培养阳性,或已知供者有肠穿孔/肠破裂,或由于各种原因应用伴念珠菌血症的受者需行进一步的微生物评估包括血、尿及移植相关部位引流液等培养;基线时以及移植后第7天行影像学检查如多普勒超声[27],必要时行CT或MRI血管造影监测是否有吻合口动脉瘤等血管并发症,决定是否需要外科干预措施;并接受抗真菌治疗。
经验性抗真菌治疗疗程一般为2周。如果有感染证据,治疗过程中需多次复查影像学,根据受者的临床表现、影像学和培养结果而决定疗程,一般应延长到4至6周;如感染累及到血管,疗程至少6周[19,27]。
抗真菌药物应根据念珠菌种类选择。棘白菌素类推荐用于念珠菌种类尚未明确,或高度怀疑是非白色念珠菌感染的移植受者。治疗泌尿道念珠菌病时应以氟康唑为首选药物;其他唑类尿液浓度较低,不推荐常规使用,但有报道用于治疗实质移植器官感染。两性霉素B抗真菌谱广,但肾毒性限制了其临床应用。肺移植受者可在全身用抗真菌药物基础上行两性霉素B雾化吸入[27]。
供者呼吸道分泌物培养阳性但不伴念珠菌血症或感染临床表现时,可在谨慎评估后捐献器官;但肺移植受者必须在移植术后接受至少2周的预防性抗真菌治疗或直至移植术后1周气管镜证实吻合口已达到良好解剖学吻合[19,27]。双侧或右侧肺移植受者、接受强诱导治疗的受者、有吻合口感染风险的受者可考虑延长抗真菌疗程。
供者念珠菌菌尿不是肾移植的绝对禁忌证,接受此类供肾受者的临床处理与保存液阳性受者相仿[27]。
心脏移植:保存液污染或供者来源念珠菌感染在心脏移植受者不常见[27]。
捐献后才发现供者有隐球菌感染,则应上报OPO并给予所有受者预防性治疗。怀疑隐球菌感染时,受者应接受脑脊液常规检查、血清及脑脊液隐球菌荚膜抗原检测;血、脑脊液、其他临床感染部位的墨汁染色及真菌培养、鉴定和药敏;头颅、肺部影像学检查(头颅MRI检查比CT阳性率更高,通常较脑脊液检查更敏感);必要时可考虑细针抽吸或活检行微生物培养及病理学检查评估[19]。
国际指南推荐对于中重度隐球菌病,播散性隐球菌病以及中枢神经系统感染者先予以两性霉素B脂质体联合5氟胞嘧啶诱导治疗,继以氟康唑巩固治疗和维持治疗。轻中度且为中枢神经系统以外的感染可单用氟康唑治疗。经典疗程为6~12月,但病情未缓解或出现排异需要加大免疫抑制剂剂量者疗程应延长[19,27,28]。
曲霉菌(71%)、毛霉菌(21%)、帚霉菌(8%)为DDFFIs(donor-derived filametous fungal infections,DDFFIs)最常见的病原体[24]。高度怀疑供者来源的丝状真菌感染时,应考虑更积极甚至有创的诊断方法包括真菌生物标志物如GM试验、移植物影像学评估、经皮移植物穿刺行组织真菌培养或病理诊断、早期外科手术探查等以明确;必要时及时进行外科手术干预(包括及时切除移植物和处理血管并发症等),积极进行有针对性抗真菌治疗。
此外,在评估受者潜在DDFFIs时,远程获得供者最新的信息及数据至关重要。来源于供者的丝状真菌感染必需在怀疑或知晓后24 h内及时向器官获取组织及网络报告。如果器官捐献后供者拟诊或确诊为曲霉病,受者应立即接受预防治疗,全身应用伏立康唑、棘白菌素类或两性霉素B脂质体等抗真菌药物。许多肺移植中心术后常规应用抗曲霉药物直至受者支气管镜检没有曲霉感染或定植的证据。其他移植受者如果发生曲霉病,通常治疗至临床和影像学检查缓解或稳定,通常至少6~12周[24,29]。
推荐意见:
1.器官保存液涂片查到酵母菌或念珠菌属培养阳性,或已知供者有肠穿孔/肠破裂,受者需立即进行抗真菌治疗,推荐初始治疗方案为棘白菌素类药物,肾移植受者怀疑尿路念珠菌感染时,氟康唑作为首选药物。
2.受者抗真菌治疗应尽可能在明确病原菌基础上,参考表10选择药物,并根据治疗结果,个体化指导疗程。
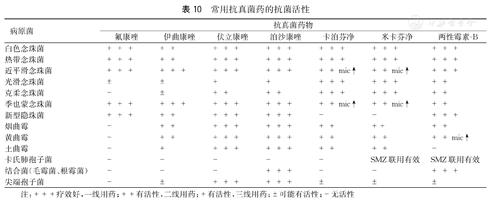
常用抗真菌药的抗菌活性
常用抗真菌药的抗菌活性
| 病原菌 | 抗真菌药物 | ||||||
|---|---|---|---|---|---|---|---|
| 氟康唑 | 伊曲康唑 | 伏立康唑 | 泊沙康唑 | 卡泊芬净 | 米卡芬净 | 两性霉素-B | |
| 白色念珠菌 | + + + | + + | + + + | + + + | + + + | + + + | + + + |
| 热带念珠菌 | + + + | + + | + + + | + + + | + + + | + + + | + + + |
| 近平滑念珠菌 | + + + | + + + | + + + | + + + | + + mic↑ | + + mic↑ | + + + |
| 光滑念珠菌 | ± | ± | + | + | + + + | + + + | + + |
| 克柔念珠菌 | - | ± | + + | + + | + + + | + + + | + + |
| 季也蒙念珠菌 | + + + | + + + | + + + | + + + | + + mic↑ | + + mic↑ | + + |
| 新型隐珠菌 | + + + | + + | + + + | + + + | - | - | + + + |
| 烟曲霉 | - | + + | + + + | + + + | + + | ++ | + + |
| 黄曲霉 | - | + + | + + + | + + + | + + | + + | + + mic↑ |
| 土曲霉 | - | + | + + + | + + + | + + | + + | - |
| 卡氏肺孢子菌 | - | - | - | - | - | SMZ联用有效 | SMZ联用有效 |
| 结合菌(毛霉菌、根霉菌) | - | - | - | + + + | - | - | + + + |
| 尖端孢子菌 | - | ± | + + + | + + + | ± | ± | ± |
注:+++疗效好,一线用药;++有活性,二线用药;+有活性,三线用药;±可能有活性;-无活性
3.治疗过程中应重视影像学检查,并决定是否需要外科干预措施。
弓形虫在心脏移植中是一个重要的问题。但供者弓形虫阳性并非心脏移植的禁忌证,甲氧苄胺嘧啶/磺胺甲噁唑(TMP/SMX)可有效预防弓形虫感染。在患病率低的地区不必行血清学试验。供者弓形虫病的筛查在非心脏移植中心不必常规开展[20,30]。
推荐意见:
1.在弓形虫病流行地区的心脏移植中心,建议对供者行血清学筛查。供者阳性时,受者需要用甲氧苄胺嘧啶/磺胺甲噁唑(TMP/SMX)预防治疗。
此外,移植受者术后发生感染时,要根据感染严重程度,降低免疫抑制强度。同时,在应用抗菌药物时还应依据其与免疫抑制剂之间的相互作用(表11)调整免疫抑制剂的药物剂量并实时监测药物浓度。
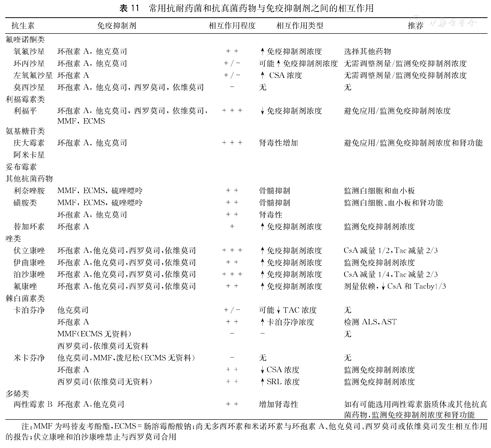
常用抗耐药菌和抗真菌药物与免疫抑制剂之间的相互作用
常用抗耐药菌和抗真菌药物与免疫抑制剂之间的相互作用
| 抗生素 | 免疫抑制剂 | 相互作用程度 | 相互作用类型 | 推荐 | |
|---|---|---|---|---|---|
| 氟喹诺酮类 | |||||
| 氧氟沙星 | 环孢素A,他克莫司 | ++ | ↑免疫抑制剂浓度 | 选择其他药物 | |
| 环丙沙星 | 环孢素A,他克莫司 | +/- | 可能↑免疫抑制剂浓度 | 无需调整剂量/监测免疫抑制剂浓度 | |
| 左氧氟沙星 | 环孢素A | +/- | ↑ CSA浓度 | 无需调整剂量/监测免疫抑制剂浓度 | |
| 莫西沙星 | 环孢素A,他克莫司,西罗莫司,依维莫司 | - | 无 | 无 | |
| 利福霉素类 | |||||
| 利福平 | 环孢素A,他克莫司,西罗莫司,依维莫司,MMF, ECMS | +++ | ↓免疫抑制剂浓度 | 避免应用/监测免疫抑制剂浓度 | |
| 氨基糖苷类 | |||||
| 庆大霉素 | 环孢素A,他克莫司 | +++ | 肾毒性增加 | 避免应用/监测免疫抑制剂浓度和肾功能 | |
| 阿米卡星 | |||||
| 妥布霉素 | |||||
| 其他抗菌药物 | |||||
| 利奈唑胺 | MMF, ECMS,硫唑嘌呤 | ++ | 骨髓抑制 | 监测白细胞和血小板 | |
| 磺胺类 | MMF, ECMS,硫唑嘌呤 | ++ | 骨髓抑制 | 监测白细胞、血小板和肾功能 | |
| 环孢素A,他克莫司 | ++ | 肾毒性 | |||
| 替加环素 | 环孢素A | + | ↑免疫抑制剂浓度 | 监测免疫抑制剂浓度 | |
| 唑类 | |||||
| 伏立康唑 | 环孢素A,他克莫司,西罗莫司,依维莫司 | +++ | ↑免疫抑制剂浓度 | CsA减量1/2,Tac减量2/3 | |
| 伊曲康唑 | 环孢素A,他克莫司,西罗莫司,依维莫司 | ++ | ↑免疫抑制剂浓度 | 监测免疫抑制剂浓度 | |
| 泊沙康唑 | 环孢素A,他克莫司,西罗莫司,依维莫司 | +++ | ↑免疫抑制剂浓度 | CsA减量1/4,Tac减量2/3 | |
| 氟康唑 | 环孢素A,他克莫司,西罗莫司,依维莫司 | ++ | ↑免疫抑制剂浓度 | 剂量依赖,↓CsA和Tacby1/3 | |
| 棘白菌素类 | |||||
| 卡泊芬净 | 他克莫司 | +/- | 可能↓TAC浓度 | 无 | |
| 环孢素A | ++ | ↑卡泊芬净浓度 | 检测ALS,AST | ||
| MMF(ECMS无资料) | - | - | 无 | ||
| 西罗莫司,依维莫司无资料 | |||||
| 米卡芬净 | 他克莫司,MMF,泼尼松(ECMS无资料) | - | 无 | 无 | |
| 环孢素A | ++ | ↓CSA浓度 | 监测免疫抑制剂浓度 | ||
| 西罗莫司(依维莫司无资料) | ++ | ↑SRL浓度 | 监测免疫抑制剂浓度 | ||
| 多烯类 | |||||
| 两性霉素B | 环孢素A,他克莫司 | ++ | 增加肾毒性 | 如有可能选用两性霉素脂质体或其他抗真菌药物,监测免疫抑制剂浓度和肾功能 | |
注:MMF为吗替麦考酚酯,ECMS=肠溶霉酚酸钠;尚无多西环素和米诺环素与环孢素A、他克莫司、西罗莫司或依维莫司发生相互作用的报告;伏立康唑和泊沙康唑禁止与西罗莫司合用
新形势下SOT面临的DDI,特别是耐药菌感染风险陡增,形势严峻,开展实体器官供者感染状态的规范评估迫在眉睫。如何控制感染风险,珍惜来之不易的捐献器官资源,需要移植、重症、感染、微生物和感控等多学科团队的通力合作,共同应对。希望本共识能指导我国DDI的规范化监测和管理流程优化,相关从业人员应在实践中不断积累循证医学证据,进一步完善DDI的防控策略,以保障实体器官移植的安全开展。
本共识的发布不存在与任何公司、机构或个人之间的利益冲突。
执笔专家:蔡常洁,中山大学附属第一医院;范欣,北京协和医院;黄海辉,复旦大学附属华山医院;马玉燕,复旦大学附属中山医院;童荔,中山大学附属第一医院;王婷,复旦大学附属华山医院,张雷,海军军医大学长海医院
统稿人:张雷
参与审定人员(按姓氏汉语拼音字母排序):蔡明,解放军第309医院;陈知水,华中科技大学同济医学院附属同济医院;陈刚,华中科技大学同济医学院附属同济医院;傅志仁,海军军医大学长征医院;黄洁,中国医学科学院阜外医院;黄勋,中南大学湘雅医院;景鸿恩,青海大学附属医院;林涛,四川大学华西医院;刘永锋,中国医科大学附属第一医院;刘振文,解放军第302医院;马俊杰,广州医科大学附属第二医院;门同义,山东省千佛山医院;石炳毅,解放军第309医院;眭维国,解放军第一八一医院;田普训,西安交通大学附属第一医院;王祥慧,上海交通大学医学院附属瑞金医院;王长希,中山大学附属第一医院;王振迪,华中科技大学同济医学院附属协和医院;吴波,无锡市人民医院;吴建永,浙江大学医学院附属第一医院;吴安华,中南大学湘雅医院;夏强,上海交通大学医学院附属仁济医院;薛武军,西安交通大学附属第一医院;张水军,郑州大学第一附属医院;张伟杰,华中科技大学同济医学院附属同济医院
共识编写发起人:陈忠华,华中科技大学同济医学院附属同济医院;管向东,中山大学附属第一医院;胡必杰,复旦大学附属中山医院;黄怡,海军军医大学长海医院;王明贵,复旦大学附属华山医院;徐英春,北京协和医院;曾力,海军军医大学长海医院;朱有华,海军军医大学长海医院

























