
探讨公民逝世后器官捐献(DCD)供者供肾移植术后远期移植肾的功能状况。
分析2016年7月前接受DCD供肾移植,且术后发生移植肾功能恢复延迟(DGF)的38例受者作为DGF组,随机选取同期实施肾移植术后正常恢复的肾功能稳定(IGF)组受者80例,分析两组受者术后3年内移植肾相关指标血肌酐、估算肾小球滤过率(eGFR)及尿蛋白的情况。
术后1、2、3年两组受者间血肌酐的差异均无统计学意义(P>0.05);两术后1年组和两术后2年组受者间eGFR的差异均无统计学意义(P>0.05),两术后3年组间eGFR的差异有统计学意义(P=0.042);术后2年和3年,DGF3年组的尿蛋白阳性率较IGF3年组均显著提高,差异均有统计学意义(P=0.028,P=0.037)。
DCD供肾移植术后发生DGF对于远期移植肾功能有显著影响,主要表现在术后2和3年eGFR降低和尿蛋白阳性率升高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,公民逝世后器官捐献(DCD)是我国供者器官的主要来源[1]。由于捐献前供者器官功能受损、捐献过程中缺血损伤及器官保存方式等原因,肾移植术后近期及远期肾功能仍待观察及研究。移植肾功能主要由术后血清肌酐、肾小球滤过率等评价,此外,尿蛋白作为提示肾脏病变的重要指标纳入观察。肾移植术后并发症严重影响移植肾功能的恢复,其中最为常见的是移植肾功能恢复延迟(DGF)。多研究证实,DGF与受者术后近期及远期移植物功能相关联[2,3,4],本文旨在观察和分析DCD供肾移植受者术后发生DGF对远期移植肾功能的影响。
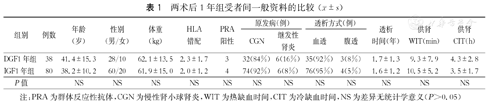
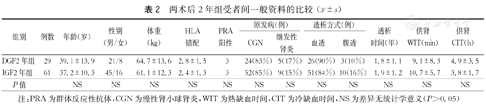
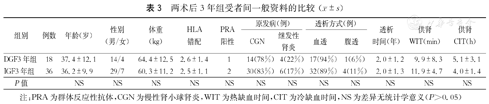
纳入2016年7月前在我院接受DCD供肾移植后发生DGF的受者38例,随机选取同期接受DCD供肾移植后肾功能恢复正常的受者80例,纳入IGF组,随访其术后1年的资料进行分析,分别作为DGF1年组和IGF1年组;将上述DGF受者和IGF受者中随访满2年(2015年7月前手术)的29例和61例,分别作为DGF2年组和IGF2年组进行分析;将上述DGF受者和IGF受者中随访满3年(2014年7月前手术)的18例和36例,分别作为DGF3年组和IGF3年组进行分析。各DGF组与相应IGF组间供者年龄、体重指数、原发病(包括颅脑损伤、脑出血及其他),供肾冷缺血时间和热缺血时间,以及受者年龄、性别、群体反应性抗体(PRA)、HLA抗原错配数、原发疾病、透析方式和时间等一般资料的比较,差异均无统计学意义(P>0.05,表1、表2、表3)。收集受者术后1、2和3年的血清肌酐、估算肾小球滤过率(eGFR)及尿蛋白结果,以评估移植肾功能。
两术后1年组受者间一般资料的比较( ±s)
±s)
两术后1年组受者间一般资料的比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 性别(男/女) | 体重(kg) | HLA错配 | PRA阳性 | 原发病(例) | 透析方式(例) | 透析时间(年) | 供肾WIT(min) | 供肾CIT(h) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CGN | 继发性肾炎 | 血透 | 腹透 | ||||||||||
| DGF1年组 | 38 | 41.4±15.3 | 28/10 | 62.1±13.5 | 2.3±1.7 | 3 | 32(84%) | 6(16%) | 35(92%) | 3(8%) | 1.7±1.3 | 9.3±7.9 | 4.3±2.8 |
| IGF1年组 | 80 | 38.2±10.2 | 60/20 | 61.9±15.0 | 2.0±1.2 | 4 | 74(92%) | 6(8%) | 76(95%) | 4(5%) | 1.6±1.2 | 10.5±5.2 | 3.5±1.7 |
| P值 | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | |
注:PRA为群体反应性抗体,CGN为慢性肾小球肾炎,WIT为热缺血时间,CIT为冷缺血时间,NS为差异无统计学意义(P>0.05)
两术后2年组受者间一般资料的比较( ±s)
±s)
两术后2年组受者间一般资料的比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 性别(男/女) | 体重(kg) | HLA错配 | PRA阳性 | 原发病(例) | 透析方式(例) | 透析时间(年) | 供肾WIT(min) | 供肾CIT(h) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CGN | 继发性肾炎 | 血透 | 腹透 | ||||||||||
| DGF2年组 | 29 | 39.1±13.9 | 21/8 | 64.7±13.6 | 2.8±1.5 | 3 | 24(83%) | 5(17%) | 26(90%) | 3(10%) | 1.8±1.1 | 9.1±8.3 | 4.9±3.5 |
| IGF2年组 | 61 | 37.2±10.3 | 45/16 | 61.1±12.3 | 2.4±1.3 | 3 | 52(85%) | 9(15%) | 51(84%) | 10(16%) | 1.9±1.2 | 10.7±5.7 | 3.8±1.7 |
| P值 | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | |
注:PRA为群体反应性抗体,CGN为慢性肾小球肾炎,WIT为热缺血时间,CIT为冷缺血时间,NS为差异无统计学意义(P>0.05)
两术后3年组受者间一般资料的比较( ±s)
±s)
两术后3年组受者间一般资料的比较( ±s)
±s)
| 组别 | 例数 | 年龄(岁) | 性别(男/女) | 体重(kg) | HLA错配 | PRA阳性 | 原发病(例) | 透析方式(例) | 透析时间(年) | 供肾WIT(min) | 供肾CIT(h) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CGN | 继发性肾炎 | 血透 | 腹透 | ||||||||||
| DGF3年组 | 18 | 37.4±12.1 | 14/4 | 64.4±12.5 | 2.6±1.4 | 1 | 14(78%) | 4(22%) | 17(94%) | 1(6%) | 2.0±1.2 | 9.9±8.3 | 5.1±3.1 |
| IGF3年组 | 36 | 36.2±9.9 | 29/7 | 60.3±11.2 | 2.5±1.1 | 2 | 30(83%) | 6(17%) | 32(89%) | 4(11%) | 2.0±1.3 | 11.9±4.7 | 4.0±1.4 |
| P值 | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | |
注:PRA为群体反应性抗体,CGN为慢性肾小球肾炎,WIT为热缺血时间,CIT为冷缺血时间,NS为差异无统计学意义(P>0.05)
所有受者自手术当天起应用抗人T淋巴细胞兔免疫球蛋白(ATG,200 mg,连用3~5 d)或兔抗人胸腺细胞免疫球蛋白(75 mg,连用3 d;部分受者加用50 mg,连用2 d),并联合甲泼尼龙行免疫诱导,各DGF组与相应IGF组间免疫诱导方案无差异。所有受者均应用钙调磷酸酶抑制剂(CNI,包括他克莫司或环孢素A)+霉酚酸类(MPA类,包括吗替麦考酚酯或麦考酚钠肠溶片)+泼尼松的三联免疫抑制剂方案,MPA类药物起始剂量为2.0 g,他克莫司起始剂量为0.06~0.08 mg·kg-1·d-1,CsA起始剂量为4~4.5 mg·kg-1·d-1,根据血药浓度调整用量,各DGF组与相应IGF组间用药方案及血药浓度无差异。
本研究中符合以下任一条件即判定为DGF[5,6,7,8]:(1)术后1周内恢复透析;(2)术后10 d后血肌酐水平高于400 μmol/L;(3)术后2周后血肌酐水平高于300 μmol/L;(4)术后1周后因移植肾功能原因需恢复透析。根据MDRD公式计算eGFR,eGFR(ml·min-1·1.73 m-2)=186×血肌酐-1.154×年龄-0.203×0.742(女性)。
应用SPSS(22.0版)软件对数据进行统计处理,数据用均数±标准差( ±s)表示,组间比较应用t检验,阳性率的比较应用χ2检验,P<0.05为差异有统计学意义。
±s)表示,组间比较应用t检验,阳性率的比较应用χ2检验,P<0.05为差异有统计学意义。
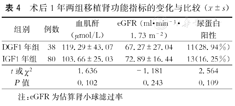
DGF1年组与IGF1年组间术后1年时血肌酐、eGFR的差异均无统计学意义(P>0.05);DGF1年组尿蛋白阳性11例,IGF1年组13例,两组尿蛋白发生率的差异无统计学意义(P=0.109,表4)。
术后1年两组移植肾功能指标的变化与比较( ±s)
±s)
术后1年两组移植肾功能指标的变化与比较( ±s)
±s)
| 组别 | 例数 | 血肌酐(μmol/L) | eGFR (ml·min-1·1.73 m-2) | 尿蛋白阳性 |
|---|---|---|---|---|
| DGF1年组 | 38 | 119.29±43.07 | 67.27±27.04 | 11(28.94%) |
| IGF1年组 | 80 | 103.66±25.03 | 72.89±16.44 | 13(16.25%) |
| t或χ2 | 1.636 | -1.181 | 2.564 | |
| P值 | 0.102 | 0.243 | 0.109 |
注:eGFR为估算肾小球滤过率
DGF2年组术后1年和2年血肌酐均高于IGF2年组,eGFR均低于IGF2年组,但两组间差异均无统计学意义(P>0.05,图1、图2,表5);两组术后1年和2年血肌酐和eGFR的组内比较,差异均无统计学意义(P>0.05,表5)。DGF2年组术后1年和2年尿蛋白阳性分别为7例和10例,IGF2年组分别为11例和10例,两组间尿蛋白阳性率的比较,差异均无统计学意义(P=0.499,P=0.054,表5)。



两术后2年组移植肾功能指标的变化与比较( ±s)
±s)
两术后2年组移植肾功能指标的变化与比较( ±s)
±s)
| 组别 | 例数 | 血肌酐(μmol/L) | eGFR(ml·min-1·1.73 m-2) | 尿蛋白阳性(例) | |||
|---|---|---|---|---|---|---|---|
| 术后1年 | 术后2年 | 术后1年 | 术后2年 | 术后1年 | 术后2年 | ||
| DGF2年组 | 29 | 107.62±29.74 | 114.07±41.21 | 71.44±25.98 | 70.72±22.60 | 7(24.14%) | 10(34.48%) |
| IGF2年组 | 61 | 103.66±26.17 | 106.74±32.30 | 72.83±16.98 | 72.69±21.50 | 11(18.03%) | 10(16.39%) |
| t或χ2 | 0.513 | 0.760 | -0.262 | -0.4 | 0.458 | 3.721 | |
| P值 | 0.609 | 0.449 | 0.795 | 0.690 | 0.499 | 0.054 | |
注:eGFR为估算肾小球滤过率
DGF3年组与IGF3年组间术后1、2和3年血肌酐的差异均无统计学意义(P>0.05,图3,表6);术后1、2和3年组内血肌酐的比较,差异亦均无统计学意义(P>0.05,表6)。两组间术后1年和2年eGFR的差异均无统计学意义(P>0.05),但术后3年DGF3年组eGFR显著低于IGF组,两组比较,差异有统计学意义(P=0.042,图4,表6);两组组内术后1、2和3年间eGFR的比较,差异均无统计学意义(P>0.05,表6)。术后1、2和3年,DGF3年组尿蛋白阳性分别为5例、8例和7例,IGF3年组分别为5例、6例和5例,两组间术后1年尿蛋白阳性率的差异无统计学意义(P=0.215),两组间术后2和3年蛋白阳性率的差异均有统计学意义(P=0.028,P=0.037,表6)。


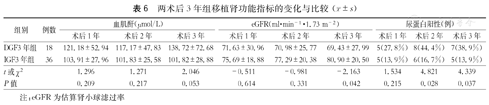
两术后3年组移植肾功能指标的变化与比较( ±s)
±s)
两术后3年组移植肾功能指标的变化与比较( ±s)
±s)
| 组别 | 例数 | 血肌酐(μmol/L) | eGFR(ml·min-1·1.73 m-2) | 尿蛋白阳性(例) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 术后1年 | 术后2年 | 术后3年 | 术后1年 | 术后2年 | 术后3年 | 术后1年 | 术后2年 | 术后3年 | ||
| DGF3年组 | 18 | 121.18±52.94 | 117.17±47.83 | 138.72±72.68 | 71.63±30.96 | 70.98±25.77 | 69.43±27.99 | 5(27.8%) | 8(44.4%) | 7(38.9%) |
| IGF3年组 | 36 | 103.91±27.96 | 101.83±25.58 | 101.82±28.88 | 75.69±18.88 | 77.29±20.38 | 80.90±20.50 | 5(13.9%) | 6(16.7%) | 5(13.9%) |
| t或χ2 | 1.296 | 1.271 | 2.046 | -0.511 | -0.981 | -2.163 | 1.534 | 4.821 | 4.339 | |
| P值 | 0.209 | 0.217 | 0.053 | 0.614 | 0.331 | 0.042 | 0.215 | 0.028 | 0.037 | |
注:eGFR为估算肾小球滤过率
DGF是肾移植术后常见的并发症,是影响肾移植术后近期和远期效果的重要因素[2]。已有多项研究证实,DGF的发生可以增加近期移植肾的急性排斥反应发生率[9]。本研究中,我们选取了我中心2016年7月前实施的DCD供肾移植受者536例,其中58例术后发生DGF,发生率为10.82%,国内文献报道肾移植术后DGF的发生率为14%~40%[1],国外研究报道的发生率为20%~50%[10]。本中心肾移植术后发生DGF的受者中20例肾功能未恢复,移植物功能丧失发生率为34.5%,直接影响肾移植术后早期效果。
肾小球滤过率(GFR)是评价肾小球滤过功能的直接指标,菊糖清除率、同位素、肌酐清除率、eGFR、血肌酐均为肾小球滤过功能的评估方法,但因实际操作原因,前3种方法无法广泛应用于临床实践及随访,目前临床上主要根据血肌酐值评价肾功能,但血肌酐与年龄,性别、肌肉量及蛋白质摄入等因素相关,考虑上述原因,结合性别、年龄、体重等指标估算出来的eGFR,作为目前最主要的肾功评价指标。正常情况下,肾小球滤过膜对血浆蛋白有选择性滤过作用,绝大多数血浆蛋白不能从肾脏滤过,在移植肾病理状态下,由于肾小球滤过膜分子屏障和电荷屏障的损伤,肾小球滤过膜通透性增高,大量蛋白滤过到肾小球滤液中,超过肾小管的重吸收能力,造成蛋白尿,所以蛋白尿的出现提示肾小球滤过膜的损伤,即肾小球滤过能力的损伤。一般肾小球滤过率功能小于50%时血肌酐才开始升高,所以尿蛋白可以提示早期肾小球滤过功能的下降。此外,尿蛋白也作为独立因素与肾功能损害及慢性肾脏病的预后相关。
本研究中,肾移植受者术后1、2、3年间,两组血肌酐及eGFR未见术后时间分组间差异;但在不同时间点,DGF组血肌酐均高于IGF组,eGFR均低于IGF组。术后1年及2年两组受者中未见血肌酐及eGFR的差异有统计学意义,随访术后3年的受者中,术后1、2年未见血肌酐及eGFR的差异有统计学意义,术后3年两组间血肌酐未见明显差异(P=0.053),两组间eGFR可见明显差异(P=0.042)。两组间术后2、3年尿蛋白阳性率的差异具有统计学意义,提示相较于血肌酐及eGFR,尿蛋白更为敏感。本研究结果与国内外多研究一致,证实发生DGF受者肾移植术后3~4年有较高的血肌酐水平及较低的移植肾存活率[11,12],同时,也有研究结果不支持上述观点[13],这可能由于目前DGF定义尚不统一,不同中心入选标准不一致所致。
肾移植受者术后肾功能与多个因素相关,其中包括免疫因素如HLA错配,急、慢性排斥反应,以及非免疫因素如供者年龄、原发病、供肾质量、供肾保存(冷缺血时间和热缺血时间),免疫抑制剂不良反应等,其损伤机制为缺血再灌注损伤及肾小管损伤[14],这些因素也是DGF及急性排斥反应的高危因素[9,15],引起移植肾近期器质性损伤,影响功能,并持续作用于移植肾,增加移植肾排斥及慢性移植物肾病的风险,进而引起远期移植肾的功能下降。
本研究证实,DGF发生显著影响近期移植肾存活率,也对远期移植肾功有不利影响,通过控制DGF的危险因素,如严格筛选供者,优化手术及移植肾保存方法减少供肾冷缺血及热缺血时间,根据HLA抗原错配优选受者,合理应用免疫抑制剂避免排斥反应等手段降低DGF的发生,从而改善肾移植术后近、远期移植肾功能。



























