
比较传统试管法和流式细胞术(Flow Cytometry,FCM)检测ABO血型抗体滴度,试图建立标准的流式细胞术检测方案,为临床ABO血型不相容肾移植和用药方案提供更准确的参考。
对30份移植受者样本的ABO血型抗体滴度,分别采用试管法、流式细胞术检测抗IgM-A/B,抗IgG-A/B抗体滴度,对结果进行分析比较。
无论是术前以及ABO血型不合已接受肾移植术后,通过对相同样本同时测血型抗体抗IgM-A/B,抗IgG-A/B用流式细胞术检测结果的滴度总体高于试管法(P<0.05)。
流式细胞法敏感性明显高于传统试管法,能更精准有效的监测患者血型抗体滴度变化,为临床治疗与用药方案提供更好的判断依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,随着器官移植临床技术进展以及免疫抑制药物的研发,医学界逐渐克服了血型不相容器官移植这一难关[1,2]。ABO血型不相容肾移植被认为是减少患者等待移植时间较好的策略,已成为终末期肾病的有效替代治疗手段[3]。据报道,对于ABO血型不相容移植患者,保持较低的血型抗体滴度,可以有效提高移植的存活率[4]。这就要求在治疗过程中,有更敏感的检测方法对血型抗体滴度进行监测。目前应用于临床的检测方法较广泛,常用的有试管法、凝胶卡片及酶标仪法等[5],每种方法都存在明显差异并且本身也有技术的缺陷,比如操作者主观判断因素影响大,方法重复性不好和精准度不够[6]。近年来使用流式细胞术检测血型抗体滴度逐渐被人们所接受,流式细胞术检测具备较高的精确性、客观性以及便捷性,为建立更优质临床治疗方案提供了基础。我中心建立了更加简单和规范的操作流程,通过与传统试管法对比,对移植患者进行血型抗体监测,为临床开展血型不相容移植提供更精准的参考依据。
人来源标准红细胞(上海血液生物医药有限责任公司,人ABO血型反定型用试剂盒):A1型,B型,O型;AB型人来源混合血清(SIGMA,H5667-20ML);O型人来源混合血清(实验人员提供);Anti-IgM-FITC抗体(Jackson Immunoresearch,109-095-043),Anti-IgG-PE(Jackson Immunoresearch,109-115-098)抗体;磷酸盐缓冲液(PBS缓冲液)(吉诺生物医药技术有限公司,20012);移植患者待测血型样本30份。
美国BD FACSCalibur全自动双激光四色流式细胞分析分选系统,德国Eppendorf Centrifuge 5810 R离心机。
1.待测样本准备:检测待测样本血型抗体滴度,放入离心机280×g,离心10 min。取血清,进行4倍梯度稀释:1∶4,1∶16,1∶64,1∶256,1∶1 024,最终取50 μl稀释液待测。另准备AB、O型人来源混合血清各50 μl作为阴性、阳性对照。
2.标准红细胞制备:取人来源标准红细胞,A1型,B型,红细胞8~10倍稀释,50 μl/孔分装在96孔板中。
3.凝集反应:将准备的样本血清(已做好梯度稀释1∶4,1∶16,1∶64,1∶256,1∶1 024),AB型血清和O型血清与标准红细胞分别1∶1充分混匀,室温下反应30 min。30 min后加200 μl的PBS缓冲液,放入离心机280×g,离心5 min,弃去上清液,重复清洗三次,最后弃去液体备用。
4.流式抗体反应:取IgM-FITC,IgG-PE抗体,1∶50稀释,20 μl孔。加入步骤3中的96孔板,轻轻吹打散红细胞,避光室温30 min。30 min后加200 μl PBS缓冲液,放入离心机280×g,离心5 min,弃去上清液,重复清洗三次,最后弃去液体并加入200 μl PBS缓冲液重悬,转移至流式管中。
5.流式细胞仪上机,检测抗A/B-IgM,抗A/B-IgG的Gmean值,统计结果。
1.分别取3支已标记A型、B型和O型的试管。用移液器加入待测血清50 ul于各试管中,再吸取50 ul A1、B、O型5%标准红细胞悬液,轻轻充分摇匀。
2.放入离心机400×g离心1 min后取出试管,轻轻振动重悬底部沉淀。
3.底部沉淀重悬后肉眼观察有无凝集(或溶血)现象,如凝集肉眼不可见,则以低倍镜镜检凝集情况。判断标准:(1)凝集,固态颗粒或沉淀物成团飘起;(2)非凝集,固态颗粒或沉淀物完全打散,恢复或接近标准红细胞悬液状态。
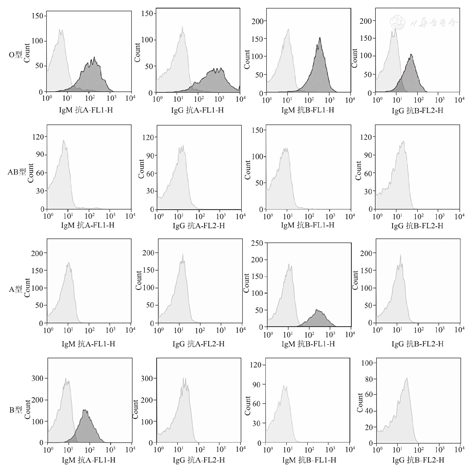
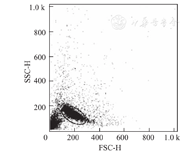
在B型和O型血清中可测得抗红细胞表面抗原A的IgM抗体,但在A型和AB型血清中并未测得该抗体;在A型和O型血清中可测得抗红细胞表面抗原B的IgM抗体,但在B型和AB型血清中并未测得该抗体。并且,抗红细胞表面抗原A或B的IgG抗体仅在O型血清中测得,该抗体在A型和B型血清中很少检出(图1)。另外,在流式FSC-SSC散点图中可见(图2),红细胞群落和红细胞碎片有明显的分群。进行流式数据获得与分析处理时,能通过设门(gate)的方式区分两种群落。针对性分析目标红细胞群落,从而排除红细胞碎片对结果的干扰。


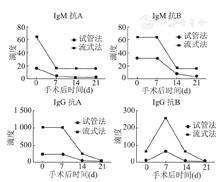
患者(O型血)入院以后开始检测ABO血型抗体滴度(图3),并进行常规术前用药治疗。手术当天再进行1次滴度检测,术后常规用药治疗,并每隔7天检测1次血型抗体滴度,以便监控体内抗体水平。同样1份患者血样同时用传统试管法和流式细胞术进行检测,我们发现用流式细胞仪检测的滴度均高于传统试管法。并且,经过免疫抑制剂治疗,术后的14 d和21 d患者抗体滴度均稳步下降,但是通过流式细胞术检测的滴度也均高于传统检测法。我们认为,荧光抗体与红细胞表面抗原表位结合的血型抗体特异性结合,再通过流式细胞仪的荧光检测系统来获得信号,这一特点导致对血型抗体的检测精确度更高。

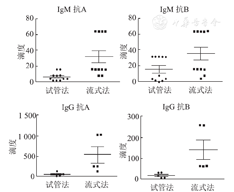
先后统计了入院进行ABO血型不相容移植的A型血,B型血患者。相同样本同时检测抗A/B-IgM抗体,用流式细胞术检测的滴度总体高于试管法,有统计学意义(抗A-IgM,P=0.004 3,P<0.01;抗B-IgM,P=0.048 5,P<0.05;N=11)。同样检测O型血患者抗A/B-IgG抗体(图4),呈现相同结果(抗A-IgG,P=0.044 5,P<0.05;抗B-IgG,P=0.033 2,P<0.05;N=5)。我们认为流式细胞仪有更高的灵敏度,同样的样本在更高的稀释度下仍能检测到阳性结果。

根据流式细胞仪测得的几何平均值(geometric mean value,Gmean)值,将阴性对照的两倍视为阳性,对应的稀释度则为阳性判定点:大于阳性判定点均视为阳性,小于该值均视为阴性。高于且最接近判定点的样本稀释度认为是该样本的抗体滴度。用流式细胞仪分别检测用PBS缓冲液梯度稀释(1∶4,1∶16,1∶64,1∶256,1∶1 024)的患者血样本,以及阳性(O型血)和阴性(AB型血)对照(图5)。
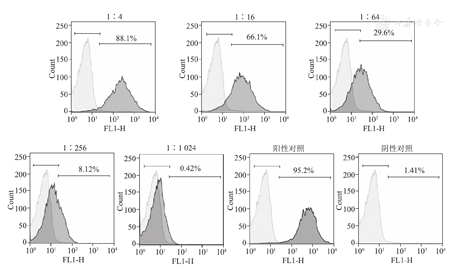

按照判断方法分析测得的Gmean值,1∶256的稀释度下Gmean值大于阴性对照的两倍,故认为1:256是该样本的滴度(表1)。可以看到,将阴性对照的两倍视为阳性设为判定点,有利于避免被接近的数值误导。如表1中阴性样本和1∶1 024的Gmean值十分接近,以阴性两倍为判定点可以避免误判1∶1 024是阳性。且从图4中能发现1∶1 024实际上阳性细胞非常少,滴度为1∶256更加准确。
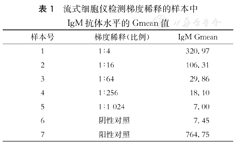
流式细胞仪检测梯度稀释的样本中IgM抗体水平的Gmean值
流式细胞仪检测梯度稀释的样本中IgM抗体水平的Gmean值
| 样本号 | 梯度稀释(比例) | IgM Gmean |
|---|---|---|
| 1 | 1∶4 | 320.97 |
| 2 | 1∶16 | 106.31 |
| 3 | 1∶64 | 29.86 |
| 4 | 1∶256 | 18.10 |
| 5 | 1∶1 024 | 7.00 |
| 6 | 阴性对照 | 7.45 |
| 7 | 阳性对照 | 764.75 |
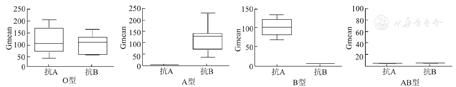
IgM抗体均能检测到,但IgG抗体只能在O型血样本中检得(图6)。其中,抗A-IgM型抗体阳性强度在O型与B型血中的差异无统计学意义(P>0.05);抗B-IgM型抗体阳性强度在O型与A型血中的差异无统计学意义(P>0.05,图7)。



本文研究中表明了流式细胞仪检测ABO血型抗体滴度,更加准确获得患者血型变化情况。通过对比传统试管法,流式细胞仪检测具备以下优势:(1)流式细胞仪较高的检测精度配合特异性标记的荧光抗体,使检测更为灵敏;(2)流式细胞仪通过检测不同荧光抗体标记便能获得不同抗体分型数据,比传统方法简便,因而耗时少,大批量的精确检测优势更明显;(3)流式细胞仪将检测结果量化,利于判定的客观性和重复性。而传统试管法通过观察凝集块大小以及背景透明程度(悬浮细胞数量)的判定方法主观性强,不同操作者容易产生偏差。故流式细胞仪检测更容易订立统一标准。另外,IgM和IgG的检测使用流式细胞仪较为容易,而传统法测定IgG要抑制IgM活性(控制温度或者加入IgM抑制剂)避免结果被干扰[7]。流式细胞仪应用抗IgM和抗IgG荧光二抗标记,简化了血型抗体的亚型检测,有效解决其他方法上的一些技术缺陷。
临床上对ABO血型不相容移植是否能开展,以及手术前后治疗方案的实施,受血型抗体滴度测定结果直接影响。更精准的检测结果,有助于临床用药和治疗方案的制订和开展。并且,我们通过样本荧光强度制定滴度的判定标准,以Gmean值大于两倍阴性对照值的最小值对应血样稀释度作阳性判定点,理论上较为客观准确,且不容易产生误判,更有利于临床工作。
综上所述,我们建立了一种敏感性较传统方法更高的流式细胞仪检测法来监测患者血型抗体滴度的变化。该方法有利于临床ABO血型不相容的移植治疗用药方案的建立。对术前检测分析患者血型抗体滴度水平能否达到安全移植的标准,且对术后的血型抗体监测以及对可能发生的移植物排斥风险进行预测,提供了更好的依据。这也从另一方面,提高了血型不相容移植的成功率,使其真正的能成为解决器官短缺的有效方案之一。流式细胞术正在成为国内外ABO血型不合移植更有效的血型抗体检测手段。当然本研究样本数偏少,其对临床的指导作用仍然需要临床长期随访病例的进一步证实。



























