
总结和探讨胰肾联合移植(SPK)手术的手术适应证、术式选择、免疫抑制方案制定及并发症防治的经验。
回顾分析2002年至2018年145例SPK的临床资料,按不同阶段分为A组(2002—2010年)15例、B组(2011—2014年)46例及C组(2015—2018年)84例,比较三组受者及移植物存活、手术方式、免疫抑制剂方案、并发症发生情况,分析移植物功能丧失的危险因素。
三组受者及移植物术后1、3、5年存活率(C组为术后1、3年存活率)均在75%以上,B组和C组受者存活率高于A组(P<0.001),B组移植胰腺存活率最低,C组最高(P=0.004)。C组更倾向采用胰肾同侧移植、胰腺静脉体循环回流和肠外分泌引流手术方式(SE-ED术式)。B组术后移植物血管血栓形成发生率最高(10.9%);A组肠梗阻发生率最高(35.7%)。采用阿加曲班抗凝方案的移植胰腺功能丧失风险是无阿加曲班抗凝方案的0.28倍(OR为0.28,95%可信区间0.09~0.86);1型糖尿病受者SPK术后移植肾功能丧失风险是2型糖尿病受者的4.08倍(OR为4.08,95%可信区间为1.37~12.15)。
胰肾联合移植是治疗糖尿病合并终末期肾病的最有效手段;严格标准选择合适的2型糖尿病合并终末期肾病患者进行SPK;围手术期的管理及并发症的防治对SPK受者及移植物存活的至关重要。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自Kelly和Lillehei在1966年开展第1例胰肾联合移植(Simultaneous Pancreas-kidney transplantation, SPK)手术以来,经数十年发展,SPK术已逐渐发展成熟。2005至2014国际上累计实施胰腺移植48 000例[1],近年来国际上胰腺移植(PTX)的四大趋势为[2]:(1)SPK和单独胰腺移植(PTA)器官分配的比例无变化;(2)2型糖尿病胰腺移植的比例仍低于10%;(3)2015年6月通过关于移植胰腺功能丧失的定义,胰腺移植预后数字的跟踪困难;(4)为增加器官的利用,增加了ABO血型不相容胰腺移植[2]。我器官移植中心于1998年开展胰腺移植工作,截至2018年,共完成SPK手术200余例,历经4种手术方式的变化,2型糖尿病合并慢性肾功能衰竭的患者占开展SPK术的70%以上。经过10余年发展历程,结合患者手术适应证、手术方式选择、免疫抑制剂方案制定及并发症防治,回顾性地分析本中心自2002年至2018年开展SPK术的临床资料,为今后改进手术措施及改善受者预后提供依据。
选择本中心自2002年1月至2018年12月接受SPK术的145例受者。排除实施肾移植后胰腺移植术(PAK)、PTA、肝移植后胰腺移植术(PAL)及肝胰肾联合移植手术受者外。根据不同时间阶段将受者分为三组,分别为A组(2002—2010年)15例、B组(2011—2014年)46例及C组(2015—2018年)84例。三组受者的临床资料相见表1。对每组受者临床基本资料,治疗方案(药物治疗,外科手术方案),临床预后(受者和移植物存活),临床并发症(近期和远期)等资料进行分析。
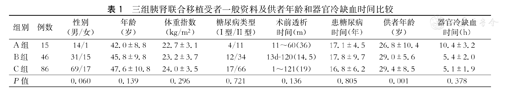
三组胰肾联合移植受者一般资料及供者年龄和器官冷缺血时间比较
三组胰肾联合移植受者一般资料及供者年龄和器官冷缺血时间比较
| 组别 | 例数 | 性别(男/女) | 年龄(岁) | 体重指数(kg/m2) | 糖尿病类型(I型/II型) | 术前透析时间(m) | 患糖尿病时间(年) | 供者年龄(岁) | 器官冷缺血时间(h) |
|---|---|---|---|---|---|---|---|---|---|
| A组 | 15 | 14/1 | 42.0±8.8 | 22.7±3.1 | 4/11 | 11~60(36) | 17.1±4.5 | 26.8±10.4 | 10.4±3.2 |
| B组 | 46 | 31/15 | 45.8±9.8 | 23.2±3.7 | 12/34 | 13d-120(14.5) | 17.8±9.7 | 29.0±5.6 | 5.4±2.0 |
| C组 | 86 | 69/17 | 47.6±10.8 | 24.0±3.5 | 17/66 | 1~121(19) | 16.8±6.2 | 29.4±8.5 | 5.1±1.9 |
| P值 | 0.060 | 0.139 | 0.296 | 0.721 | 0.136 | 0.805 | 0.001 | 0.378 |
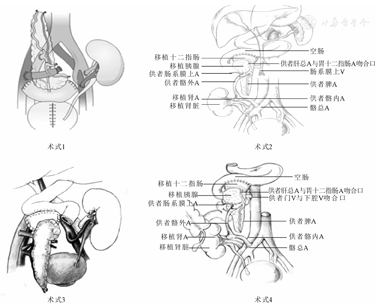
2002—2018年我中心采用过四种手术方式[3],分别为:(1)术式Ⅰ:胰腺静脉体循环回流(SE)和胰腺外分泌经膀胱引流(BD);(2)术式Ⅱ:胰腺静脉经门静脉回流(PE)和胰腺外分泌经肠道引流(ED);(3)术式Ⅲ:胰肾异侧移植、胰腺静脉体循环回流和肠外分泌引流手术方式(SE-ED术式);(4)术式Ⅳ:胰肾同侧移植、SE-ED术式(图1)。

曾采用两种方案。(1)巴利昔单抗;(2)抗胸腺细胞球蛋白(ATG)6 mg/kg。
曾采用4种激素剂量方式,分别为:(1)方案Ⅰ:静脉滴注甲泼尼龙,术中1000 mg,术后1~3 d 500 mg/d,术后4~5 d 250 mg/d;(2)方案Ⅱ:静脉滴注甲泼尼龙,术中1000 mg,术后1~3 d 500 mg/d;(3)方案Ⅲ:静脉滴注甲泼尼龙,术中及术后1~3 d分别500 mg/d;(4)方案Ⅳ:静脉滴注甲泼尼龙,术中及术后1~3 d分别80 mg。
采用两种方案,分别为术后第4天起给予他克莫司(或环孢素A)+吗替麦考酚酯(MMF)+泼尼松的三联免疫抑制方案,及早期激素撤除治疗,即他克莫司(或环孢素A)+MMF。
抗凝方案分为四种。(1)方案Ⅰ:拜阿司匹林或联合硫酸氢氯吡格雷;(2)方案Ⅱ:低分子肝素(40~60 iu/kg,连用4~6 d)+拜阿司匹林与硫酸氢氯吡格雷交替;(3)方案Ⅲ:阿加曲班(1~3 mg/h,连用4~6 d)+拜阿司匹林与硫酸氢氯吡格雷交替;(4)方案IV:阿加曲班(1~3 mg/h,连用4~6 d)+低分子肝素(40-60 iu/kg,连用2~3 d)+拜阿司匹林与硫酸氢氯吡格雷交替。方案Ⅱ、Ⅲ、Ⅳ,拜阿司匹林与硫酸氢氯吡格雷在药物转换期间均重叠用药2日。凝血功能监测为术后连续7 d进行血常规、弥散性血管内凝血(DIC)指标检查及超声检查监测血流,同时术后第4天进行超声造影,预防出血及血栓发生。
我中心将移植胰腺存活定义为移植胰腺可独立工作,受者无需使用外源性胰岛素,如需胰岛素介入则说明胰腺失活;移植肾存活定义为术后受者无需进行透析治疗。
使用SPSS(20.0版)进行统计处理,计量资料采用均数±标准差(Mean±SD)表示,组间比较采用方差分析;计数资料用率表示,采用χ2检验或Fisher法进行比较。危险因素分析采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
A组、B组和C组随着年代推近,接受SPK术的受者依次增多。三组受者性别、移植时年龄、体重指数、糖尿病类型、术前透析时间及患糖尿病时间的差异均无统计学意义(P>0.05,表1);A组供者年龄低于B组和C组(P<0.05);三组间供者器官冷缺血时间的差异无统计学意义(P>0.05)。
A组受者术后1、3、5年存活率分别为93.3%、81.7%、81.7%,B组均为97.8%,C组均为100%(图2)。B组和C组受者术后1、3、5年存活率均显著高于A组(P<0.001),B组与C组受者间存活率的差异无统计学意义(P>0.05)。
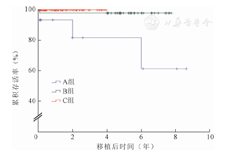

A组移植胰腺术后1、3、5年存活率分别为93.3%、81.7%、81.7%,B组均为78.3%,C组均为97.6%(图3)。三组中B组移植胰腺存活情况最差,C组最好(P=0.004)。
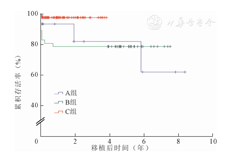

A组移植肾术后1、3、5年存活率分别为100%、87.5%、87.5%,B组均为88.9%,C组移植肾术后1、3年存活率分别为96.4%、91.7%。三组间术后移植肾存活率的差异均无统计学意义(P=0.773)。
三组间激素方案的差异较大(P<0.001),A组和B组侧重使用方案Ⅳ的减激素方案,近3年来受者侧重使用方案Ⅲ。三组间免疫诱导方案、免疫抑制维持方案的应用未呈现出明显差异(P>0.05,表2)。
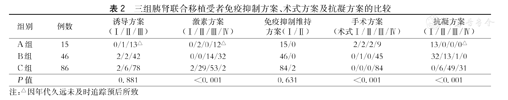
三组胰肾联合移植受者免疫抑制方案、术式方案及抗凝方案的比较
三组胰肾联合移植受者免疫抑制方案、术式方案及抗凝方案的比较
| 组别 | 例数 | 诱导方案(Ⅰ/Ⅱ/Ⅲ) | 激素方案(Ⅰ/Ⅱ/Ⅲ/Ⅳ) | 免疫抑制维持方案(Ⅰ/Ⅱ) | 手术方案(术式Ⅰ/Ⅱ/Ⅲ/Ⅳ) | 抗凝方案(Ⅰ/Ⅱ/Ⅲ/Ⅳ) |
|---|---|---|---|---|---|---|
| A组 | 15 | 0/1/13△ | 0/2/0/12△ | 15/0 | 2/2/2/9 | 13/0/0/0△ |
| B组 | 46 | 2/2/42 | 0/0/14/32 | 46/0 | 0/1/0/45 | 32/13/1/0 |
| C组 | 86 | 2/6/78 | 2/29/53/2 | 84/2 | 0/0/0/84 | 0/6/49/31 |
| P值 | 0.881 | <0.001 | 0.631 | <0.001 | <0.001 |
注:△因年代久远未及时追踪预后所致
三组受者间采用术式方案的差异较大(P<0.001,表2)。采用方案Ⅳ及SE-ED术式较其他三个方案的受者较多。方案Ⅰ、Ⅱ、Ⅲ在A组受者实施最为普遍,方案Ⅳ则多实施在C组受者。
三组受者间抗凝方案存在明显差异(P<0.001,表2),其中方案Ⅰ在A组和B组占比最高,在C组占比最低;方案Ⅲ、Ⅳ在C组应用占比最高。
B组受者术后血栓形成发生率较A组和C组显著增高(P=0.0028),A组肠梗阻发生率较B组和C组显著增高(P=0.0016)。三组受者间其他外科并发症发生率的差异均无统计学意义(P>0.05,表3)。
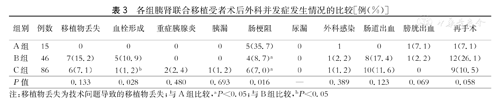
各组胰肾联合移植受者术后外科并发症发生情况的比较[例(%)]
各组胰肾联合移植受者术后外科并发症发生情况的比较[例(%)]
| 组别 | 例数 | 移植物丢失 | 血栓形成 | 重症胰腺炎 | 胰漏 | 肠梗阻 | 尿漏 | 外科感染 | 肠道出血 | 膀胱出血 | 再手术 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| A组 | 15 | 0 | 0 | 0 | 0 | 5(35.7) | 0 | 1 | 0 | 1(7.1) | 1(7.1) |
| B组 | 46 | 7(15.2) | 5(10.9) | 0 | 0 | 4(8.7)a | 0 | 1(2.2) | 8(17.4) | 1(2.2) | 12(26.1) |
| C组 | 86 | 6(7.1) | 1(1.2)b | 2(2.4) | 1(1.2) | 6(7.0)a | 0 | 1(1.2) | 10(11.6) | 0 | 9(10.5) |
| P值 | 0.133 | 0.028 | 0.480 | 0.693 | 0.016 | — | 0.389 | 0.123 | 0.069 | 0.058 |
注:移植物丢失为技术问题导致的移植物丢失;与A组比较,aP<0.05;与B组比较,bP<0.05
B组和C组感染发生率显著高于A组,原因可能为A组样本量过少、年代久远未及时追踪预后所致。三组受者间移植物功能恢复延迟、细胞介导排斥反应、抗体介导排斥反应等方面的差异均无统计学意义(P>0.05,表4)。
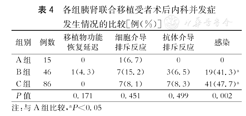
各组胰肾联合移植受者术后内科并发症发生情况的比较[例(%)]
各组胰肾联合移植受者术后内科并发症发生情况的比较[例(%)]
| 组别 | 例数 | 移植物功能恢复延迟 | 细胞介导排斥反应 | 抗体介导排斥反应 | 感染 |
|---|---|---|---|---|---|
| A组 | 15 | 0 | 1(6.7) | 0 | 0 |
| B组 | 46 | 1(4.3) | 7(15.2) | 3(6.5) | 19(41.3)a |
| C组 | 86 | 0 | 7(8.1) | 7(8.3) | 41(47.7)a |
| P值 | 0.171 | 0.451 | 0.499 | 0.002 |
注:与A组比较,aP<0.05
结合受者一般资料及手术信息,将受者年龄、性别、糖尿病类型、患糖尿病时间、应用单克隆抗体或多克隆抗体、正常激素剂量及减激素剂量、阿加曲班应用与否、不同开展手术阶段、供者年龄等因素进行多因素Logistic分析,结果显示,应用阿加曲班可有效降低移植胰腺功能丧失的危险,采用阿加曲班抗凝方案的移植胰腺功能丧失风险是无阿加曲班抗凝方案的0.28倍(OR为0.28,95%可信区间0.09~0.86);1型糖尿病受者SPK术后移植肾功能丧失风险是2型糖尿病受者的4.08倍(OR为4.08,95%可信区间为1.37~12.15)。
临床上对2型糖尿病是否适合进行胰肾联合移植存在争议。鉴于此,2017年Gruessner等[4]在其研究中总结了1型及2型糖尿病患者开展SPK的适应证,认为1型糖尿病的适应证为存在频发低血糖、糖尿病肾脏病变和/或视网膜病变、酮症酸中毒、糖尿病肾病终末期(ESRD)、血液透析等严重糖尿病相关并发症。同时通过国际上部分中心及美国糖尿病协会建议[5],总结出2型糖尿病的手术适应证为受者年龄<60岁、体重指数<32 kg/m2、胰岛素治疗5年以上、空腹C肽<10 ng/ml及难以控制的高血糖。Weems等[6]、Singh等[7]、Esmatjes等[8]及Light等[9]多位研究者亦提出根据受者年龄、体重指数、胰岛素依赖、空腹C肽水平、是否存在肾功能衰竭、是否低心血管疾病风险等因素提出的SPK适应移植标准。通过Mittal等[10]及Meirelles等[11]的研究确定包括长期损害的脑血管意外、广泛的主动脉/髂动脉和(或)外周血管疾病、活动性乙型或丙型肝炎病毒感染、体重指数>30 kg/m2等6项手术相对禁忌证,以及包括严重的心血管风险、无法治愈的恶性肿瘤、活动性败血症或消化性溃疡、不能耐受手术和免疫抑制等5项绝对禁忌证。我中心根据以上适应证,建立2型糖尿病患者入选SPK手术标准:年龄<60岁,体重指数<32 kg/m2,胰岛素治疗5年以上且胰岛素用量<1 u·kg-1·d-1,C肽水平<10 ng/ml。
经过10余年的手术方案探索及技术总结,我中心胰肾联合移植预后情况得到明显改善。近3年来,SPK术后受者、胰腺移植、肾移植1、3年存活率均得到显著提高。自2002年起,我中心SPK受者术后5年存活率未低过80%以下,其中2011—2014年SPK受者术后1、3、5年存活率分别为97.8%、97.8%及97.8%,近3年来SPK受者术后1、3年存活率均达到100%。与国外情况相比,我中心与国际SPK受者术后存活率及移植物存活率相比相差不大。美国器官共享联合网络(UNOS)最新年报显示,2009—2011年接受胰腺移植的受者,SPK、PAK和PTA三种术式的术后5年存活率均相似,处于89.2%~91.0%之间[12]。Gondolesi等[13]在其开展的拉丁美洲单中心回顾性研究中显示,2008—2016年2型糖尿病SPK术后1年和5年受者存活率分别为100%和74.1%。Wiseman等[14]通过移植受者科学登记(SRTR)2000—2008年数据发现,424例SPK术后1、5年移植胰腺存活率分别为83.7%与71.0%。Margreiter等[15]研究显示,2型糖尿病患者胰肾联合移植术后1、5年移植胰腺存活率分别为81.0%和75.9%。Sampaio等[16]研究显示,2型糖尿病患者SPK术后5年移植肾存活率为73.5%。
国外曾报道,胰腺移植手术存在胰腺静脉体循环回流和胰腺膀胱外分泌引流、胰腺移植与门静脉引流和肠外分泌引流、胰腺移植门静脉(PE)和十二指肠胃引流等九种术式,其中最常用的为SE-ED术式[17]。研究显示,91%的SPK采用肠道引流,原因为与膀胱引流相比,肠道引流更符合生理要求,且肠道吻合口位于距离回盲部80 cm回肠,远期并发症较少[12,18]。而在膀胱引流术式中,由于存在大量碱性胰液丢失引起的代谢性酸中毒及大量碱性胰液流经膀胱引起的泌尿系感染、血尿及十二指肠段-膀胱漏等并发症,导致采用该术式者逐渐减少[3]。我中心在采用BD术式的18例受者中,膀胱出血的发生率为27.8%,与Stratta等[3]文献报道的28%相近,而自2003年12月起我中心采取供者十二指肠置管冲洗后(共12例),膀胱出血发生率降至8.3%[3,19]。
我中心经过2011-2014年探索期后倾向选择将供者髂血管进行动脉搭桥血管重建,开展胰肾同侧移植、SE-ED术式(术式Ⅳ)。其优势在于:(1)利用同侧血管进行手术,可以为受者保留另外一侧髂血管;(2)动脉搭桥后减小移植胰腺动脉吻合的难度;(3)缩短了手术耗时及供胰的冷缺血时间。但我中心采用术式Ⅳ的患者随访时间短于术式I至Ⅲ的患者,需进一步进行临床随访观察。
SPK手术并发症常表现为静脉血栓形成、胰腺炎、肠漏、胰漏、腹腔内出血、消化道出血及感染等。我中心术后外科并发症主要表现为技术问题导致移植物丢失、移植物血栓形成、肠梗阻、肠道出血与再次手术。术后内科感染主要表现为呼吸道感染和尿路感染。国内外研究显示,SPK术后大多数并发症与移植胰腺有关。术后60 d内容易发生移植胰腺炎(3%~12%),感染/脓肿(1%~5%),局灶性/弥漫性坏死(12%),移植物血管血栓形成(6%~17%),吻合口漏(0.5%~2%)和腹腔内出血(0~0.5%)[20]。我中心采用低分子肝素或阿加曲班预防移植物血管血栓形成。国外有研究表明,应用肝素可使受者的移植物血管血栓形成和移植物丢失发生率显着降低[21]。抗感染治疗覆盖革兰阳性菌和阴性菌、厌氧菌及真菌。使用迅速补液、输血,止血及停用抗凝药物的治疗措施应对消化道出血。泌尿道感染则根据尿培养结果使用针对性的抗生素进行治疗。
自2002年我中心开展SPK以来,免疫诱导倾向使用ATG,免疫抑制剂维持倾向使用术后4天起给予他克莫司(或环孢素A)+MMF+泼尼松的三联免疫抑制方案。UNOS最新年报显示,T淋巴细胞清除抗体(如ATG)应用最多,并呈上升趋势,2016年这一数字为84.8%,为近10年来最高值[12]。国内也有文献支持90%的受者术后诱导治疗使用ATG[22]。在国际上免疫抑制剂使用方面,他克莫司尽管存在肾毒性与致糖尿病性,仍成为钙调磷酸酶抑制剂(CNI)的首选,应用占比达到95.5%。麦考酚酸(MPA)类药物成为抗增殖药物的首选,占比94%,包括MMF及麦考酚钠肠溶片(EC-MPS)。哺乳动物雷帕霉素靶蛋白抑制剂(mTORi)使用基本稳定在术后1年时占比9%~10%,在移植时应用较少,可能是担忧mTORi会影响伤口愈合,并且多数在术后1个月后才使用。尽管早期倾向于采用无激素方案,然而72.5%的受者在术后1年时仍然把激素作为维持期用药之一。
胰肾联合移植是治疗糖尿病合并终末期肾病的最有效手段;严格标准选择合适的2型糖尿病合并终末期肾病患者进行SPK;围手术期的管理及并发症的防治对SPK受者及移植物存活的至关重要。
所有作者均声明不存在利益冲突



























