
探讨ABO血型不相容肝移植(ABOi-LT)治疗肝癌患者的效果及安全性。
运用倾向性评分匹配(PSM)方法以1∶2的比例,将44例接受ABOi-LT的肝癌受者与88例ABO血型相容肝移植(ABOc-LT)的肝癌受者进行匹配。比较两组间受者及移植物的存活情况及并发症发生情况。
ABOi组和ABOc组受者术后第7天血清肌酐水平分别为(89.1±36.9)和(74.8±26.2)μmol/L(P=0.001);术后第14天分别为(77.9±27.6)和(67.6±18.6)μmol/L(P=0.002)。术后肝动脉血栓形成发生率分别为9.1 %和1.1 %(P=0.024),胆道并发症发生率分别为25.0 %和8.0 %(P=0.007),移植物早期功能不全发生率分别为52.3 %和31.8 %(P<0.001),急性肾损伤发生率分别为68.1 %和36.4 %(P<0.001)。ABOc组受者的术后累积存活率、无瘤存活率和移植物存活率均显著高于ABOi组(P<0.001)。按是否符合杭州标准进行亚组分类后显示,符合杭州标准的两组术后存活率及并发症发生率并无差异,而在不符合杭州标准的ABOi组累积存活率、无瘤存活率及移植物存活率均显著低于ABOc组(P<0.001)。
ABOi-LT受者术后存活率显著低于ABOc-LT受者。但符合杭州标准的肝癌患者,其ABOi-LT预后与ABOc-LT相近;不符合杭州标准的肝癌患者的ABOi-LT预后显著劣于ABOc-LT,对于此类患者在ABOi-LT前应精准评估、谨慎实施,或通过降期等多种治疗手段使更多患者获得移植机会以及改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,ABO血型不相容肝移植(ABOi-LT)已成为扩大供肝来源的一大选择,并且随着相关治疗手段如利妥昔单抗、IVIG、血浆置换、免疫吸附、脾切除和移植肝局部灌注等的应用,使得ABOi-LT的预后得到大幅改善,ABOi-LT受者及移植物术后存活率可与ABO血型相合肝移植(ABOc-LT)相媲美。目前,ABOi-LT主要应用于紧急移植治疗急性肝功能衰竭,或者病情危及受者生命需要紧急肝移植但无ABO相容性供肝[1]。随着"杭州标准"等肝癌肝移植选择标准的应用,肝癌患者接受ABOi-LT逐渐增加,因此对肝癌ABOi-LT的预后进行有效评估至关重要。本文中,我们回顾性分析了浙江大学医学院附属第一医院和树兰(杭州)医院近年因肝细胞肝癌(HCC)行ABOi-LT受者相关临床数据,评价ABOi-LT治疗肝癌的可行性及预后。
本研究采用倾向性评分匹配模型对移植受者进行配对,以减少由受者基线数据差异而导致的选择偏倚。选取2015年1月至2018年12月于浙江大学医学院附属第一医院、树兰(杭州)医院接受肝移植的受者,排除术前合并有其他器官功能衰竭、器官联合移植、术后1周内死亡以及儿童肝移植的受者。根据1:2的配对比例将ABOi-LT与ABOc-LT分为ABOi组(44例)和ABOc组(88例),两组供、受者相关临床基线资料详见表1、表2。ABOi组血型分配情况:A型供O血9例、A型供B型3例、B型供O型8例、B型供A型3例、AB型供O型13例、AB型供A型3例、AB型供B型5例。本研究全部供肝均来源于死亡后器官捐献,并经医院伦理委员会审批同意。
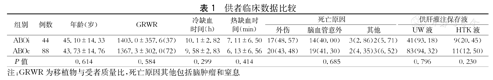
供者临床数据比较
供者临床数据比较
| 组别 | 例数 | 年龄(岁) | GRWR | 冷缺血时间(h) | 热缺血时间(min) | 死亡原因 | 供肝灌注保存液 | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 外伤 | 脑血管意外 | 其他 | UW液 | HTK液 | ||||||
| ABOi | 44 | 45.10±14.33 | 1403.0±357.6(37) | 10.1±2.82 | 7.11±6.50 | 17(48.57) | 14(40.00) | 3(2.86)2(5.71) | 41(93.18) | 9(20.45) |
| ABOc | 88 | 43.73±14.76 | 1367.3±302.0(72) | 9.58±2.83 | 6.13±6.56 | 20(43.48) | 19(41.30) | 2(4.35)3(6.52) | 83(94.32) | 11(12.50) |
| P值 | 0.614 | 0.584 | 0.299 | 0.414 | 0.685 | 0.796 | 0.230 | |||
注:GRWR为移植物与受者质量比,死亡原因其他包括脑肿瘤和窒息
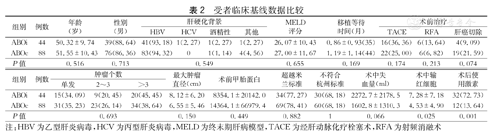
受者临床基线数据比较
受者临床基线数据比较
| 组别 | 例数 | 年龄(岁) | 性别(男) | 肝硬化背景 | MELD评分 | 移植等待时间(月) | 术前治疗 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HBV | HCV | 酒精性 | 其他 | TACE | RFA | 肝癌切除 | ||||||
| ABOi | 44 | 50.32±9.74 | 39(88.64) | 41(93.18) | 1(2.27) | 1(2.27) | 1(2.27) | 26.07±10.43 | 0.86±0.93(35) | 16(36.36) | 6(13.64) | 4(9.09) |
| ABOc | 88 | 51.55±10.43 | 76(86.36) | 83(94.32) | 0 | 1(1.14) | 4(4.56) | 27.00±11.67 | 1.19±1.14(44) | 22(25.00) | 6(6.82) | 19(21.59) |
| P值 | 0.516 | 0.713 | 0.549 | 0.655 | 0.169 | 0.174 | 0.213 | 0.074 | ||||
| 组别 | 例数 | 肿瘤个数 | 最大肿瘤直径(cm) | 术前甲胎蛋白 | 超越米兰标准 | 不符合杭州标准 | 术中失血量(ml) | 术中输红细胞 | 术后使用激素 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 单发 | 2~3 | >3 | |||||||||
| ABOi | 44 | 15(34.09) | 9(20.45) | 20(45.45) | 8.12±6.20 | 8354.1±20142.0 | 34(77.27) | 30(68.18) | 2272.7±2178.5 | 7.28±7.18 | 32(72.73) |
| ABOc | 88 | 31(35.23) | 23(26.14) | 34(38.64) | 6.55±5.46 | 14364.1±66979.4 | 69(78.41) | 60(68.18) | 1602.8±1310.3 | 4.53±4.90 | 12(13.64) |
| P值 | 0.693 | 0.150 | 0.449 | 0.882 | 1 | 0.066 | 0.025 | 0.001 | |||
注:HBV为乙型肝炎病毒,HCV为丙型肝炎病毒,MELD为终末期肝病模型,TACE为经肝动脉化疗栓塞术,RFA为射频消融术
为进一步分析ABOi-LT治疗HCC的效果,将受者按照是否符合杭州标准分别进行分组,包括符合杭州标准的ABOi受者(ABOi-A组,14例)和ABOc受者(ABOc-A组,28例),及不符合杭州标准的ABOi受者(ABOi-B组,30例)和ABOc受者(ABOc-B组,60例),比较各组受者/移植物存活率及急性排除反应、EAD、肾功能不全、急性肾损伤、代谢并发症、胆道并发症、血栓性微血管病等之间的差异。
所有受者均接受改良背驼式肝移植术,术中均未行脾切除术。术中静脉应用丙种球蛋白(IVIG)单次0.4 g/kg,利妥昔单抗单次375 mg/m2,甲泼尼龙单次1000 mg,术后第4天再次给予巴利昔单抗20 mg/d行免疫诱导。ABOi组受者术后采用四联免疫抑制方案:他克莫司+吗替麦考酚酯(MMF)+甲泼尼龙+IVIG;ABOc组受者术后采用三联免疫抑制方案:他克莫司+MMF+IVIG,若发生EAD或急性排斥反应,则加用甲泼尼龙。他克莫司起始剂量为0.1 mg/kg,每日分2次服用,并根据血药浓度调整剂量,术后1个月将血他克莫司浓度维持在8~12 μg/L,第2个月维持在5~8 μg/L;MMF初始和维持剂量均为1 g/d,每日分2次用;术后第1天甲泼尼龙使用剂量为240 mg/d,每日分2次用,逐日递减至20 mg/d口服,术后1个月停用;IVIG在术后继续使用10 d,剂量为0.4 g·kg-1·d-1[2]。
监测移植肝功能、肾功能及血型抗体效价变化,定期完善超声、CT、磁共振等影像学检查,临床考虑存在排斥反应时急诊行肝脏穿刺活检以明确诊断。
采用SPSS(24.0版)统计软件进行处理。计量资料均先使用Kolmogorov-Smirnov检验进行正态性检验,符合正态分布的数据用均数±标准差( ±s)表示,用独立样本t检验进行分析;不符合正态分布的数据用中位数(第25百分位数至第75百分位数)表示,用Mann-Whitney秩和检验分析。所有分类变量使用卡方检验分析;应用Kaplan-Meier检验绘制生存分析曲线,Log Rank检验进行存活率分析。以上双侧检验,P<0.05为差异有统计学意义。
±s)表示,用独立样本t检验进行分析;不符合正态分布的数据用中位数(第25百分位数至第75百分位数)表示,用Mann-Whitney秩和检验分析。所有分类变量使用卡方检验分析;应用Kaplan-Meier检验绘制生存分析曲线,Log Rank检验进行存活率分析。以上双侧检验,P<0.05为差异有统计学意义。
与ABOc组相比,ABOi组术后使用糖皮质激素的受者比例较高(72.7 %与13.6 %,P<0.001);两组供、受者其他基线数据的比较,差异均无统计学意义(P>0.05,表1、表2);两组受者术后3个月内血他克莫司浓度无显著性差异;术后第7天和14天的血清尿素氮分别为(14.3±2.9)与(8.5±1.1)mmol/L(P=0.026),(10.0±1.6)与(6.0±0.8)mmol/L(P=0.019),血肌酐分别为(89.1±36.9)与(74.8±26.2)μmol/L(P=0.001),(77.9±27.6)与(67.6±18.6)μmol/L(P=0.002)。
ABOc组受者术后1、3年累积存活率(OS)分别为70.5 %和57.4 %,无瘤存活率(DFS)分别为62.5 %和52.0 %,移植物存活率分别为69.3 %和56.4 %;ABOi组受者术后1、3年OS分别为35.2 %和24.2 %,DFS分别为24.4 %和19.5 %,移植物存活率分别为32.9 %和19.0 %。ABOc组OS、DFS及移植物存活率均显著高于ABOi组,两组比较,差异均有统计学意义(P<0.001)。
ABOi组术后发生EAD共23例(52.3 %),发生AKI共30例(68.2 %),发生胆道并发症11例(25.0 %),发生肝动脉血栓形成4例(9.1 %),而ABOc组分别为28例(31.8 %)、32例(36.4 %)、7例(8.0 %)和1例(1.14 %),两组上述并发症发生率的比较,差异均有统计学意义(P<0.05,表3)。两组间急性排斥反应、新发糖尿病、高血压、门静脉并发症、感染及精神等并发症发生率的比较,差异均无统计学意义(P>0.05,表3)。
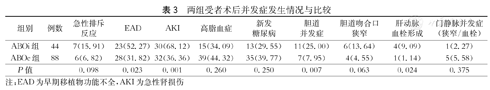
两组受者术后并发症发生情况与比较
两组受者术后并发症发生情况与比较
| 组别 | 例数 | 急性排斥反应 | EAD | AKI | 高脂血症 | 新发糖尿病 | 胆道并发症 | 胆道吻合口狭窄 | 肝动脉血栓形成 | 门静脉并发症(狭窄/血栓) |
|---|---|---|---|---|---|---|---|---|---|---|
| ABOi组 | 44 | 7(15.91) | 23(52.27) | 30(68.12) | 15(34.09) | 13(29.55) | 11(25.00) | 6(13.64) | 4(9.09) | 1(2.27) |
| ABOc组 | 88 | 6(6.82) | 28(31.82) | 32(36.36) | 39(44.32) | 35(39.77) | 7(7.95) | 4(4.55) | 1(1.14) | 5(5.58) |
| P值 | 0.098 | 0.023 | 0.001 | 0.260 | 0.250 | 0.007 | 0.063 | 0.024 | 0.375 |
注:EAD为早期移植物功能不全,AKI为急性肾损伤
ABOc-A组受者术后1、3年OS分别为75.0 %和66.3 %,DFS分别为71.4 %和61.9 %,移植物存活率分别为71.4 %和63.0 %;ABOi-A组术后1、3年OS分别为50.0 %和33.3 %,DFS分别为42.9 %和28.4 %,移植物存活率分别为50.0 %和33.3 %,ABOc-A组OS、DFS及移植物存活率均高于ABOi-A组,但差异均无统计学意义(P>0.05,图1)。在术后并发症方面,ABOi-A组受者虽略高于ABOc组,但差异均无统计学意义(P>0.05,表4)。
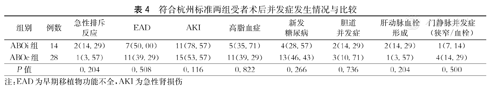
符合杭州标准两组受者术后并发症发生情况与比较
符合杭州标准两组受者术后并发症发生情况与比较
| 组别 | 例数 | 急性排斥反应 | EAD | AKI | 高脂血症 | 新发糖尿病 | 胆道并发症 | 肝动脉血栓形成 | 门静脉并发症(狭窄/血栓) |
|---|---|---|---|---|---|---|---|---|---|
| ABOi组 | 14 | 2(14.29) | 7(50.00) | 11(78.57) | 5(35.71) | 4(28.57) | 2(14.29) | 2(14.29) | 1(7.14) |
| ABOc组 | 28 | 1(3.57) | 11(39.29) | 15(53.57) | 11(39.29) | 13(46.43) | 3(10.71) | 1(3.57) | 4(14.29) |
| P值 | 0.204 | 0.508 | 0.116 | 0.822 | 0.266 | 0.736 | 0.204 | 0.500 |
注:EAD为早期移植物功能不全,AKI为急性肾损伤
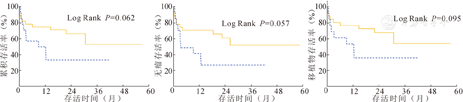

ABOc-B组术后1、3年OS分别为68.3 %和53.4 %,DFS分别为58.3 %和47.6 %,移植物存活率分别为68.3 %和53.4 %;ABOi-B组术后1、3年OS分别为28.7 %和20.9 %,DFS分别为15.2 %和15.2 %,移植物存活率分别为25.8 %和13.5 %。ABOc-B组OS、DFS及移植物存活率均显著高于ABOi组,差异均有统计学意义(P<0.001,图2)。此外,ABOi组EAD、AKI、胆道并发症、肝动脉血栓形成发生率均显著高于ABOc组,差异均有统计学意义(P<0.05,表5)。
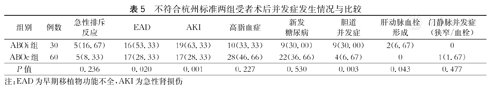
不符合杭州标准两组受者术后并发症发生情况与比较
不符合杭州标准两组受者术后并发症发生情况与比较
| 组别 | 例数 | 急性排斥反应 | EAD | AKI | 高脂血症 | 新发糖尿病 | 胆道并发症 | 肝动脉血栓形成 | 门静脉并发症(狭窄/血栓) |
|---|---|---|---|---|---|---|---|---|---|
| ABOi组 | 30 | 5(16.67) | 16(53.33) | 19(63.33) | 10(33.33) | 9(30.00) | 9(30.00) | 2(6.67) | 0 |
| ABOc组 | 60 | 5(8.33) | 17(28.33) | 17(28.33) | 28(46.66) | 22(36.66) | 4(6.67) | 0 | 1(1.67) |
| P值 | 0.236 | 0.020 | 0.001 | 0.227 | 0.530 | 0.003 | 0.043 | 0.477 |
注:EAD为早期移植物功能不全,AKI为急性肾损伤


ABOi-LT于2000年首次被提出,之后便在各移植中心开始临床运用,其安全性和有效性受到日益关注[3]。目前良性疾病ABOi-LT受者和移植物术后5年存活率均可达60 %以上[2,4]。
一项针对HCC受者的研究发现,ABOi-LT术后1、3年DFS分别为90.3 %和73.3 %,OS分别为90.6 %和81.9 %,ABOi与ABOc两组生存曲线无显著性差异,但其研究对象均为接受活体肝移植的受者,受者纳入指标相对较为严格[5]。另一项基于倾向性评分匹配法1∶1配对的报道也显示,ABOi-LT与ABOc-LT之间术后生存曲线无显著性差异[6]。我们的研究结果则显示,ABOc-LT受者术后OS、DFS、移植物存活率均显著高于ABOi-LT受者,且ABOi组受者术后1年OS、DFS、移植物存活率均未超过40 %。我们在研究中发现,有两个问题值得重视:(1)术后激素的使用。在ABOi组受者中,术后使用激素的受者比例显著高于ABOc组受者比例,而激素的使用则与术后肿瘤复发乃至预后不佳密切相关[7,8]。(2)ABOi所带来的血型抗原排斥不仅仅表现在血细胞上,并且在胆管内皮细胞及血管内皮细胞中同样存在,破坏移植物的小胆管及微血管,造成广泛微血管栓塞[9,10]。本研究中,ABOi组较低的移植物存活率或与其较高的肝动脉并发症及胆道并发症有关。
Kim等[5]将移植受者按照是否符合米兰标准进行分层分析后发现,无论是否符合米兰标准,ABOi组与ABOc组受者的术后1、3年无瘤存活率的差异均无统计学意义。而本研究显示,在长期预后方面ABOi-LT并不能使不符合杭州标准的肝癌受者受益,相比ABOc组受者,其术后OS、DFS及移植物存活率均显著降低,而术后并发症发生率显著增高;对于符合杭州标准的ABOi受者,其术后OS、DFS及移植物存活率虽略低于ABOc受者,术后并发症发生率略微增高,但差异均无统计学意义。由此说明,杭州标准同米兰标准相比,其作为肝癌肝移植选择标准更能准确地对受者预后进行分层与预测。
AKI是肝移植术后常见的并发症之一。一项大样本临床研究显示,与ABOc-LT相比,ABOi-LT增加了术后肾功能损伤风险;同时,在ABOi-LT受者中,因术中输血而发生肾功能损伤的风险更大[11]。Lee等[12]通过对肝移植术后发生AKI受者的血肌酐水平亚组分析发现,更高的血肌酐变化与更低的受者5年OS、移植物存活率相关。本研究先对两组受者术中输血量进行比较,发现ABOi-LT受者术中输红细胞量显著较高,而在术后2周内,ABOi组受者其尿素氮显著升高,此结果与之前研究相符;而在总研究群体中,ABOi组受者术后AKI发生率同样显著高于ABOc组受者;在不符合杭州标准受者中,ABOi-B组的AKI发生率也是显著提高的。
EAD常继发于移植肝的缺血再灌注损伤,而其与ABOi之间的关系极少被研究报道。在本研究中,ABOi组受者术后EAD发生率显著高于ABOc组,其原因可能在于ABOi-LT受者常并发抗体介导的排斥反应或急性排斥反应,而此类排斥反应又往往表现在术后血清转氨酶的升高以及弥漫性肝内胆管狭窄[13]。虽然本研究观察到ABOi组术后急性排斥反应发生率略高于ABOc组,但差异并无统计学意义,这或许与肝脏病理活检覆盖面不足相关,由此并未体现出急性排斥反应的真实发生率。由此,本研究中,ABOi组受者术后较高的EAD发生率或许与其相对较高的急性排斥反应发生率有一定联系,其相关性可进行进一步研究。
移植术后肝动脉血栓形成发生率最高可达24 %,是一种严重的并发症,好发于移植术后30 d内,可以引起胆道缺血并导致移植物功能丧失[14,15]。本研究中,ABOi组中4例肝动脉血栓形成均发生于术后7 d内,而血型相容组则仅有1例发生。肝移植术后胆道并发症大部分发生于术后3个月内,是影响受者远期存活和生活质量的重要因素。本研究中,ABOi组受者胆道并发症大部分发生在术后1个月后,这或许源于移植物中微血管循环障碍发生较为隐匿,肝动脉血栓形成与胆道并发症相对较高的发生率则可能与血型不相容所导致的广泛微血管栓塞有关。
本研究采用倾向性评分对ABOi受者进行匹配,尽可能消除混杂因素影响的偏倚,减少其对并发症发生及预后的干扰。目前,肝癌行ABOi-LT的安全性和疗效问题仍没有统一的观点,一方面ABOi-LT应用于肝癌领域较重型肝炎肝功能衰竭较少,本研究也仅纳入两个中心病例进行分析,今后有待拓展为多中心前瞻性研究以提供更为充分的证据。另一方面,行ABOi-LT的肝癌患者,部分不符合杭州标准或者米兰标准,甚至伴有大血管侵犯,同样影响了受者的预后。中国肝癌肝移植临床实践指南指出,对于肝移植预估等待期>6个月的HCC受者,无论其是否符合杭州标准,均应接受降期或桥接治疗以减缓肿瘤进展[16]。可以对不符合杭州标准的HCC患者进行降期治疗,并实施个体化分析其降期成功率与移植手术的及时性,从而使更多的受者获得移植机会以及更好的预后[17]。
综上所述,对于拟行肝移植治疗的HCC受者,应尽早进行降期治疗,以获得更好的预后;但在紧急情况下,若等待ABOc供肝的时间过长,为防止病情恶化,可考虑进行ABOi-LT。而对于符合杭州标准的受者,我们的目光应放在如何进一步降低术后并发症的发生上,从而达到与ABOc-LT类似的存活率。
所有作者均声明不存在利益冲突



























