
评估利用中、高分辨人类白细胞抗原(HLA)分型方法计算供受者功能性表位(Eplet)错配的一致性。
收集2015年1月至2019年12月西安交通大学第一附属医院实施肾移植1 487例供、受者HLA中、高分辨分型资料,利用HLA Matchmaker软件计算Eplet错配数,比较供、受者中、高分辨HLA配型Eplet错配数的一致性。测定HLA分型方法之间存在Eplet错配差异的供、受者比例。
供受者HLA中分辨Ⅰ类和Ⅱ类位点Eplet错配的中位数分别为14(0~38)和8(0~24);HLA高分辨Ⅰ类和Ⅱ类位点Eplet错配的中位数分别为14(0~38)和7(0~23)。使用中分辨和高分辨分型方法计算的HLA Ⅰ类[95%置信区间(CI):0.989(0.988~0.991)]和Ⅱ类[95% CI :0.990(0.989~0.992)]位点的Eplet错配数的相对一致性和绝对一致性都非常相似。两种方法计算的HLA Ⅰ和Ⅱ类分子Eplet错配数差别在0~2个之间的供、受者的比例分别为92.5%和97.5%,Eplet错配数差别≥3的供、受者比例分别为7.5%和2.5%。
利用供、受者HLA中分辨分型及高分辨分型计算Eplet错配数的一致性较好;HLA中分辨分型转换为HLA高分辨分型所计算的Eplet错配数与实际Eplet错配数基本一致。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人类白细胞抗原(HLA)系统决定实体器官移植中的组织相容性。目前,HLA分型已经从血清学发展到分子分型,分子分型更精确地定义了个体的免疫学特征,从而为器官移植组织相容性提供了更全面和准确的评估。供者HLA由多态氨基酸残基组成的多个抗原表位(Epitope)组成,可引起受者B淋巴细胞驱动的免疫应答。抗原表位中由2~5个氨基酸组成的集群决定抗原的免疫原性,称为功能性表位(Eplet) [1]。Duquesnoy和Marrari[1,2]最先将Eplet描述为与HLA抗体结合位点上的三个氨基酸残基的线性序列[1,2]。随后,Eplet被定义为半径为3埃(1埃=1×10-10 m)范围内的连续或间断的氨基酸残基[3]。这些区域被认为是抗HLA抗体识别的HLA表位的基本组成部分。
HLA高分辨分型方法耗时且费用昂贵,因此在死亡捐献供肾分配中的使用受到限制。目前,HLA中分辨分型方法仍然是死亡捐献供肾分配的标准分型技术。在我国,HLA中分辨分型与高分辨分型方法计算的Eplet错配数的可靠性和一致性仍未明确。因此,本研究通过HLA Matchmaker软件对1 487例肾移植供、受者的HLA中分辨分型及高分辨分型资料进行统计,分析这两种分型方法计算供、受者Eplet错配数的可靠性和一致性,以评估肾移植供、受者之间Eplet匹配可行性,为Eplet匹配在肾移植中的应用提供依据。
本研究纳入西安交通大学第一附属医院2015年1月至2019年12月实施的1 487例肾移植供、受者资料。研究符合临床研究相关伦理学标准,并经院人体器官移植临床伦理委员会批准(XJTU1AF-CRF-2018-026)。
供、受者HLA Ⅰ类(HLA-A、B、C)和Ⅱ类(HLA-DR、DQ)位点的HLA高分辨分型采用One Lambda公司LABType SSOHD试剂盒。HLA中低分辨分型采用One Lambda公司LABType SSO试剂盒。
供、受者Eplet错配数的计算采用HLA Matchmaker软件(版本2.1;www.hlamatchmaker.net)[4]。根据《中华骨髓库等位基因目录(CWD 2.3版,2019年)》,对HLA中分辨分型到HLA高分辨等位基因分型进行转换,将与CWD表HLA基因前两位相同的HLA中分辨基因型别,转换为表中与之对应的基因频率最高的高分辨基因型别。然后输入HLA Matchmaker程序,进行计算Eplet错配。HLA高分辨分型直接输入HLA Matchmaker程序,不需要转换。
应用SPSS 17.0统计软件及Medcalc 19.1医学统计软件对数据进行统计描述和分析。本研究基线特征资料描述为Mean±SD、数量(比例)或M(Q1,Q3)。以HLA高分辨分型为分型分析的参考标准。使用组内相关系数ICC( 95% CI)评估测量的可靠性,以建立HLA中分辨分型方法与HLA高分辨分型方法计算出的Eplet错配数的相对一致性(未考虑系统误差)和绝对一致性(考虑系统误差)。构建Bland-Altman图,显示HLA中分辨分型方法与HLA高分辨分型方法计算得到的Ⅰ类和Ⅱ类Eplet错配数的差异和一致性界限(0±1.96 SD)的平均值。
本研究共纳入1 487对供、受者,均为汉族,包括1 254例死亡器官捐献肾移植和233例活体肾移植。1 487位受者中,包括男性受者1 094例,受者年龄为(35.5±8.9)岁。男性供者615例,供者年龄(45.1±11.4)岁。HLA中分辨分型Ⅰ类和Ⅱ类位点Eplet错配的中位数分别为14(0~38)和8(0~24);HLA高分辨分型Ⅰ类和Ⅱ类位点Eplet错配的中位数分别为14(0~38)和7(0~23)。(表1)
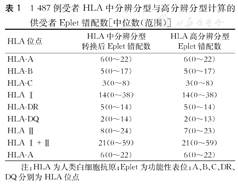
1 487例受者HLA中分辨分型与高分辨分型计算的供受者Eplet错配数[中位数(范围)]
1 487例受者HLA中分辨分型与高分辨分型计算的供受者Eplet错配数[中位数(范围)]
| HLA位点 | HLA中分辨分型转换后Eplet错配数 | HLA高分辨分型Eplet错配数 |
|---|---|---|
| HLA-A | 6(0~22) | 6(0~22) |
| HLA-B | 5(0~17) | 5(0~17) |
| HLA-C | 3(0~8) | 3(0~8) |
| HLA Ⅰ | 14(0~38) | 14(0~38) |
| HLA-DR | 5(0~14) | 5(0~14) |
| HLA-DQ | 2(0~14) | 2(0~13) |
| HLA Ⅱ | 8(0~24) | 7(0~23) |
| HLA Ⅰ+Ⅱ | 21(0~59) | 21(0~59) |
| HLA-A | 6(0~22) | 6(0~22) |
注:HLA为人类白细胞抗原;Eplet为功能性表位;A、B、C、DR、DQ分别为HLA位点
HLA中分辨分型方法和高分辨分型方法计算Eplet错配数的相对一致性和绝对一致性与95% CI的组内相关系数见表2。使用两种分型方法计算的HLA Ⅰ类和Ⅱ类位点的Eplet错配数的相对一致性和绝对一致性都非常相似(表2)。测量结果之间的相对一致性和绝对一致性的密切程度表明,此结果可复检,可重复。HLA中分辨分型与高分辨分型计算的Eplet错配数的平均差值和95%可信区间如图1所示。两种分型方法计算的HLA Ⅰ类(-2.6~2.8)、Ⅱ(-1.8~1.7)类及Ⅰ和Ⅱ总和(-3.2~3.4)的Eplet错配数差异的95%可信区间范围(组内相关系数在0.75以上为良好,本研究的组内相关系数都在0.9以上),表明两种HLA分型方法之间有很强的一致性。
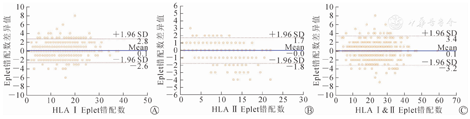

注:图中圆圈代表队列中供受者HLA中分辨分型与高分辨分型方法计算Eplet错配数的差异值。连续线表示两种HLA分型方法的Eplet错配数差异值为0,间断线表示高于和低于0差异值的Eplet错配差异值的一致性界限(0±1.96 SD)
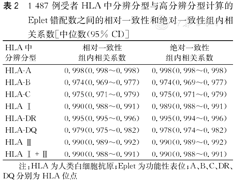
1 487例受者HLA中分辨分型与高分辨分型计算的Eplet错配数之间的相对一致性和绝对一致性组内相关系数[中位数(95% CI)]
1 487例受者HLA中分辨分型与高分辨分型计算的Eplet错配数之间的相对一致性和绝对一致性组内相关系数[中位数(95% CI)]
| HLA中分辨分型 | 相对一致性组内相关系数 | 绝对一致性组内相关系数 |
|---|---|---|
| HLA-A | 0.998(0.998~0.998) | 0.998(0.998~0.998) |
| HLA-B | 0.974(0.969~0.977) | 0.974(0.969~0.977) |
| HLA-C | 0.975(0.971~0.979) | 0.975(0.971~0.979) |
| HLA Ⅰ | 0.990(0.988~0.991) | 0.989(0.988~0.991) |
| HLA-DR | 0.995(0.995~0.996) | 0.995(0.994~0.996) |
| HLA-DQ | 0.979(0.975~0.982) | 0.978(0.974~0.982) |
| HLA Ⅱ | 0.990(0.989~0.992) | 0.990(0.989~0.992) |
| HLA Ⅰ+Ⅱ | 0.990(0.988~0.991) | 0.990(0.988~0.991) |
注:HLA为人类白细胞抗原;Eplet为功能性表位;A、B、C、DR、DQ分别为HLA位点
两种HLA分型方法在Ⅰ类和Ⅱ类位点上存在0、1~2、3~5、6~10和>10个Eplet错配数的供受者比例如下:针对中分辨HLA Ⅰ和Ⅱ类分子转换后计算所得Eplet错配数,与高分辨HLA计算方法所得Eplet错配数没有差别(0 Eplet)的供、受者的比例分别为52.9%和60.8%,差别在0~2个之间的供、受者的比例分别为92.5%和97.5%,差别≥3的供、受者的比例分别为7.5%和2.5%;差别≥6的供受者比例分别为0.2%和0%。表3显示在供、受者配对中使用HLA中分辨等位基因预测HLA高分辨等位基因错误分类的HLA位点。
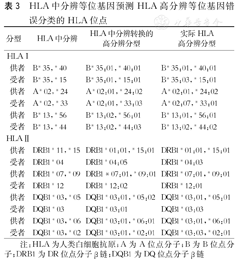
HLA中分辨等位基因预测HLA高分辨等位基因错误分类的HLA位点
HLA中分辨等位基因预测HLA高分辨等位基因错误分类的HLA位点
| 分型 | HLA中分辨 | HLA中分辨转换的高分辨分型 | 实际HLA高分辨分型 | |
|---|---|---|---|---|
| HLA I | ||||
| 供者 | B*35,*40 | B*35:01,*40:01 | B*35:01,*40:01 | |
| 受者 | B*35,*15 | B*35:01,*15:01 | B*35:03,*15:01 | |
| 供者 | A*02,*24 | A*02:01,*24:02 | A*02:01,*24:02 | |
| 受者 | A*02,*33 | A*02:01,*33:03 | A*02:07,*33:01 | |
| 供者 | B*13,*56 | B*13:02,*56:01 | B*13:01,*56:01 | |
| 受者 | B*13,*44 | B*13:02,*44:03 | B*13:02,*44:02 | |
| HLA Ⅱ | ||||
| 供者 | DRB1*11,*15 | DRB1*01:01,*15:01 | DRB1*01:01,*15:01 | |
| 受者 | DRB1*04 | DRB1*04:05 | DRB1*04:03 | |
| 供者 | DRB1*07,*09 | DRB1*07:01,*09:01 | DRB1*07:01,*09:01 | |
| 受者 | DRB1*12 | DRB1*12:02 | DRB1*12:01 | |
| 供者 | DQB1*03,*05 | DQB1*03:01,*05:02 | DQB1*03:01,*05:01 | |
| 受者 | DQB1*03 | DQB1*03:01 | DQB1*03:03 | |
| 供者 | DQB1*03,*06 | DQB1*03:01,*06:01 | DQB1*03:01,*06:01 | |
| 受者 | DQB1*03,*02 | DQB1*03:01,*02:01 | DQB1*03:03,*02:01 | |
注:HLA为人类白细胞抗原;A为A位点分子;B为B位点分子;DRB1为DR位点分子β链;DQB1为DQ位点分子β链
本研究发现HLA中分辨分型与高分辨分型计算的HLA Ⅰ类和Ⅱ类Eplet错配数基本一致,超过99%的转换后供、受者Eplet错配数与高分辨分型法计算出的HLA Ⅰ类和Ⅱ类Eplet错配数相差不超过5个。本研究结果表明,HLA等位基因的中分辨分型应该是计算Eplet错配的最低要求,这与国际上其他相关研究结果一致[5]。然而,临床医师需要意识到精确计算所有供受者Eplet错配数仍然需要HLA高分辨分型。
由于HLA-A、B和DR错配数的增加会导致急性排斥和(或)移植物功能丧失的风险增加,因此,目前HLA 6抗原错配仍然是死亡器官捐献供者肾脏分配的标准分类测试[6]。然而,越来越多的证据支持抗原表位或Eplet匹配在肾移植临床工作中的重要性[7,8]。HLA位点特异性表位或Eplet不匹配与供者特异性抗体(DSA)的产生、肾移植后急性排斥反应或移植物肾病等与移植肾过早功能丧失相关的并发症有关[9]。
目前,将基于Eplet的免疫评估系统应用于临床器官移植分配还存在很多困难。新一代测序方法的发展使全基因组分析发生了革命性的变化,完整的HLA等位基因序列的分辨率在2位到8位之间,实现了高精度、高准确度的HLA基因深度测序[10,11]。与HLA中分辨分型方法相比,高分辨HLA分型方法的费用昂贵而且耗时较长。由于死亡捐献器官分配的时间很短,因此高分辨HLA分型方法目前无法在死亡器官捐献供肾HLA分型中广泛采用。然而,将HLA高分辨分型应用于活体肾移植检查是完全可行的。为了评估将Eplet错配纳入死亡捐献供者肾脏分配的潜在益处,以预测其未来的广泛应用机会,评估中分辨和高分辨分子分型方法之间的一致性具有非常重要的临床意义。
研究发现高负载Eplet错配只会增加移植肾不良反应的概率,确定Eplet的免疫原性可能会提高预测肾移植术后移植肾预后的准确性[9]。HLA-DQ分子与抗体相互作用的模型显示,HLA抗体的产生可能受到一个具有免疫原性Eplet的影响,或者可能需要一个与Eplet有一定距离的额外接触位点。在表位注册表(http://www.epregistry.com.br)中已经鉴定并记录了许多被HLA Ⅰ类和Ⅱ类抗体验证的免疫源性表位/Eplets,目前仍然有大量的免疫源性表位验证工作正在进行中[12,13]。免疫原性Eplet不匹配的数量和类型(Ⅰ类和Ⅱ类)与同种异体移植结果之间的关系还不是十分清楚[14]。本研究与Duquesnoy等[15]建议在临床工作中使用高分辨HLA分型来确定表位错配的观点并不冲突。多年来,在欧洲移植可接受错配项目中,高分辨HLA分型一直被成功地用于为高致敏受者选择最合适的供肾。澳大利亚配对肾脏交换项目,提高了高致敏受者的移植潜力,为高度敏感的受者选择更好组织匹配的供者(即较低数量的Eplet错配),从而避免或尽量减少高致敏受者移植后产生DSA和发生抗体介导的排斥反应[16]。
本研究存在以下局限性。首先,本研究的供受者群体来自单中心,主要是中国中西部地区的汉族人群。此外,由于HLA-DP位点的中分辨HLA分型不能用于确定该位点的高分辨分型,因此本研究未纳入HLA-DP,因此缺失了由于DP位点分子α链(DPA1)和DP位点分子β链(DPB1)的差异而可能导致的错配水平。另外,DR位点分子β链(DRB) 3/4/5 HLA分型也没有包括在本研究之内,这些位点也有可能存在Eplet不匹配。HLA分型方法的迅速发展有望在不久的将来克服这些局限性,为基于Eplet的死亡器官捐献供者匹配提供可能。此外,本研究仅评估Eplet错配总数,并没有区分免疫原性的Eplet错配与非免疫原性的Eplet错配。
综上所述,本研究证明,HLA中分辨等位基因转换为HLA高分辨等位基因,可以准确地计算出HLA Ⅰ类和Ⅱ类位点的Eplet错配数。HLA中分辨分型转换为HLA高分辨分型所计算的Eplet错配数与实际Eplet错配数基本一致。虽然HLA高分辨分型的成本已大幅降低,甚至与HLA中分辨分型成本相当,但在死亡捐献器官分配中,HLA高分辨分型方法的主要障碍仍然是检测时间过长。因此,在此项工作中,利用中华骨髓库(CWD)2.3版,将HLA中分辨等位基因转换为HLA高分辨等位基因,是推进移植术前进行供受者Eplet匹配非常重要的一步。
所有作者均声明不存在利益冲突



























