本综述介绍了自体肺移植在肺部疾病中心研究进展,总结了近十年国内外对自体肺移植的发展及其手术损伤的改进,分别从自体肺移植术式、临床适应症、术中关键点、术后并发症及其辅助治疗、预后效果等方面做出详细的总结描述,并为研究者提供有意义的参考,亟待基础和临床研究者进一步探究和评价自体肺移植的作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
部分Ⅲ期中心型肺癌或局部非小细胞癌的肿瘤大范围侵犯肺主支气管、肺动脉和肺静脉,该类患者大多被迫选择全肺切除以彻底清除肿瘤,阻断其进一步转移[1]。但对于肿瘤局限于单个肺叶的患者,包括健康肺叶在内的全肺切除会极大地影响患者早期预后和生活质量。自体肺移植是一种切除一侧全肺,在短时间离体状态下切除病变肺叶,再将健康肺叶移植回胸腔的手术方式[2,3]。尽管自体肺移植术后长期生存率与全肺切除术相差不大[4,5],但该术式可最大限度地改善患者术后残肺功能和生活质量,因此逐渐成为该类患者首选的治疗手段。最近也有学者提出,自体肺移植可用于治疗肺切除术后样综合征(postpneumonectomy-like syndrome, PPLS)导致的肺不张等问题[6,7]。为了系统了解自体肺移植在临床上的应用情况,本文就自体肺移植在各肺部疾病的研究进展作一综述,为其推广和应用提供参考依据。
Juvenelle等[8]于1951年首次成功报道了犬肺切除术后进行的右肺自体移植,该实验犬于术后35个月被处死,支气管肺活量测定法结果显示移植肺中度丧失功能。几年后,Hardy等[9]开始将自体肺移植用于临床试验手术,并指出术后支气管吻合口的开裂一直是导致术后感染和死亡的主要原因。我国学者张国良等[10]于1998年首次报道了自体肺移植在III期中心型肺癌患者中的应用,术中将下肺静脉的残端和上肺静脉的残端相吻合,解决了术中肺叶修剪后所剩的血管残端过短,无法紧密吻合的问题。许林等[11]在随后几年内共完成了5例III期中心型肺癌患者的自体肺移植,为国内自体肺移植的开展积累了重要的临床经验。随着支气管血管双袖状肺叶切除技术的发展,病变肺叶的切除、支气管血管残端吻合等外科技术也日益成熟,自体肺移植已成为治疗肺癌伴广泛浸润临近组织的较好选择。根据日本胸外科协会最新的报道,自体肺移植术后的住院死亡率为0.8%,低于全肺切除术后4.8%~5.0%的死亡率[12,13]。尽管接受全肺切除的患者的围术期死亡率远高于接受袖状肺叶切除术的患者,但其长期存活率却相差不大。由于较低的围术期死亡率和良好的早期预后,自体肺移植被认为是此类患者避免全肺切除的替代术式。
体外台式手术最早由Oto等[1]提出,术中需先行单侧全肺切除,再于离体状态下广泛修剪病变肺叶,对保留下的健康肺叶再行原位植入。离体的全肺再由该医生在转身至背后的另一手术台面进行肺叶修剪。术前常规进行肺灌注,可有效保护残肺功能,并减少缺血再灌注损伤和血栓的形成。背台手术的同时,另一外科医生同时进行患者纵隔和肺门的淋巴结清扫,可最大限度缩短肺缺血时间和手术时间[1,4]。体外台式手术由于其术中视野良好、操作范围更大,使肿瘤的扩大切除变得更容易[5],逐渐成为自体肺移植的首选方案,近年来也被指出可用于PPLS导致的肺不张等问题[6,7]。
Emmanouilides等[14]回顾性分析了近20年自体肺移植患者的资料,发现离体肺移植术后支气管并发症发生率更高,且需在全肺切除后行背台手术,可能不适用于肺功能过差或极度虚弱的患者。原位再植技术则是在肺不离体的情况下,于健康的肺叶间建立肺静脉通道,再将肺叶间肺动脉、肺静脉、支气管分离,完成健康肺叶的再植。术中建立的肺静脉通道保证了肺静脉逆行灌注肺叶,防止肺缺血坏死。Karube等[15]对比了体外台式手术和原位再植术患者的各项数据,其中两种术式的手术时长、术中失血量和总体预后无明显差异,但由于原位再植术的视野不清晰、可操作范围较小,除肺功能较差、无法耐受背台手术的患者,一般不会作为自体肺移植的首选。
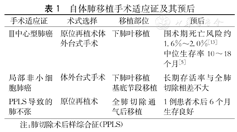
自体肺移植最早被应用于Ⅲ期中心型肺癌,当肿瘤侵袭肺中部的支气管、肺动脉和肺静脉,但侵袭范围仅限于单个肺叶时,为了最大程度保留患者肺功能,术者对病变肺叶进行修剪,将未受累的健康肺叶再植入回原位[16]。若此类患者的肿瘤侵犯多个肺叶时,则需进行延长袖肺叶切除术(extended sleeve lobectomy, ESL)切除多个肺叶,再对健康基底节段进行肺再植。Chida等[17]对23例Ⅲ期中心型肺癌患者进行基底节段的肺再植,结果显示自体肺移植术后患者长期生存率普遍高于同期行全肺切除术的患者,又能够增大手术的切除范围以彻底清除病变组织,尽可能地挽救肺功能(表1)。这些接受基底节段再植的患者预后显示,术后30 d内未出现死亡(0/23),且仅8.7%的患者术后出现并发症(2/23)。局部肺叶切除后保留基底节段的移植方案尽管技术要求更高,但显著减少了术中失血量,可成为肿瘤侵犯程度较大的III期中心型肺癌患者的首选方案[18]。
常规术式通常选择对局部非小细胞癌患者进行全肺切除以达彻底根治肿瘤的目的。Oto等[1]对5例此类患者行部分肺叶切除,根据肿瘤的侵袭范围选择性地保留下段或基底节段的健康肺叶后行肺叶再植。术后短期无复发,预后良好。由于缺少大样本的数据支持,该术式的选择也亟待进一步的临床研究。
PPLS会压迫支气管造成呼吸困难及喘鸣,Macar等[19]进行的一项研究显示,直接使用常规外科干预后的纵隔术后多发疝气、脱位、定位不当等问题,6/20纵隔过度偏移需再次手术。Shiono等[20]最近提出,对切除塌陷的肺叶进行通气、肺灌洗液的保存处理后可恢复肺功能,再行原位自体肺移植即可解决PPLS造成的肺部塌陷问题[6,7],而塌陷处的肺叶再通气即可矫正纵隔的过度偏移。
Yang等[21]报道过1例自体肺移植辅助一步切除侵犯肺的心脏肉瘤的个案。心脏肉瘤通常可以彻底清除,通过一步切除这种方法对于多学科的外科手术团队具有可行性且避免二次切除手术造成的重复创口。
随着肺移植的手术技术不断改进和移植肺保存技术的出现,术后支气管并发症的发生率从1983年以前的80%下降到不足3%[22]。肺叶再植术中,支气管残端通常大小不等,远处残端薄且易碎,比同种异体肺移植支气管可供吻合的残端长度更短,吻合张力的牵拉作用易造成术后支气管吻合端口的开裂,继而可能出现吻合口感染、并发症和局部肺癌复发。Shiono等[20]提出,可将支气管经下肺静脉转位后来与侧壁气管吻合的气管重建技术来缓解支气管吻合端口的压力,以完成移植环节中支气管的重建,或将气管侧壁打孔处理,将下叶肺支气管残端穿插在主气管打孔处以进行吻合以降低术后支气管并发症。除此之外,Inci等[22]也指出,重新建立气管、支气管处血管的微循环,减少吻合端支气管缺血也利于术后的恢复(表2)。
部分患者因病变肺叶切除过大而导致所需吻合的血管残端的吻合张力过大,技术难度高,术后还可能出现血管吻合口渗漏等问题。为解决该术中难点Oto等[1]提出使用静脉套囊技术,将下肺静脉移植入上肺静脉以解决吻合残端过短引起的栓系作用而不便吻合的手术难点。为了得到足够长的静脉套囊用于移植物残端的吻合,通常将上肺静脉的解剖位置尽可能选择远端,而下肺静脉的解剖位置尽可能选择近端。许林等[11]对4例自体肺移植患者的血管残端吻合使用该术式,除1例患者在术后发生静脉血栓,被迫摘除双肺外,其余3例患者在接下来2~3年的随访中均生存良好。
肺叶切除时对支气管离断平面的选择应尽量靠近上肺叶支气管平面,避免触及支气管缺血的危险区域。并且Shiono等[20]指出,支气管吻合过程中,将较低的支气管抬高到气管的水平则会造成气道并发症,Reardon等[23]表明降低支气管水平位置在理论上是可行的,因此术中支气管的离断平面选择和下肺叶再植时降低吻合口高度是需要注意的关键点。
体外台式手术中,肺组织离体缺血会引起缺氧,造成细胞的损伤和有毒物质的释放,再灌注则会加重上述的效应[24]。为减少离体的背台手术造成的缺血/再灌注的损伤,通常在背台手术前对切除的患侧肺使用肺部灌洗液进行先顺行、再逆行的肺部冲洗。当肺缺血时间过长或肺功能较差时,可将肺组织灌洗后置于低温下暂时保存,再重新插入主支气管,保持室内通气,以促进肺动脉冲洗。使用灌注液适当的保存肺组织也可为进行支气管和动脉外科手术切缘的病理检查提供充足的时间。使用肺保护技术可以最大程度地降低肺功能的损失[1]。
Spaggiari等[25]于早期的研究中指出使用19~23℃的低钾右旋糖苷溶液灌注肺可有效防止缺血再灌注损伤,减少肺部血栓。Oto等[1]选择低钾葡聚糖葡萄糖溶液,Watanabe等[26]则使用细胞外磷酸盐缓冲液对肺部进行灌洗,尽管种类不同,这些灌洗液均能够有效的减少缺血再灌注损伤。并且研究证实低温环境较常温的灌洗效果更佳。最近Hamaji等[27]选用了4℃的ET-Kyoto溶液进行移植物的灌注,较低的温度能更快地恢复缺血肺的组织活性,患者预后也未出现缺血再灌注损伤。蒋峰等[28]提出的肺移植报告显示,建议肺在未灌注,且缺血超过1 h的情况下短时间冷藏肺组织,再行灌注效果更佳。
自体肺移植的术式复杂,支气管、血管残端的吻合口较多,极易出现术后的各项并发症。常见的如支气管胸膜瘘,据报道早期的胸膜瘘可通过胸管引流来清除脓胸[16]。Hamaji等[27]的报道显示,胸膜瘘症状严重者可采用紧急开胸手术,患者二次术后可恢复正常生活且无复发。除此之外,术后的肋间肌瓣容易与气道粘连,吻合口处的支气管壁弥散性增厚则会造成支气管狭窄。Inci等[22]对391例支气管吻合后的患者进行统计,4.9%(10/206)出现管腔狭窄。早期的狭窄可采用支气管镜扩张,情况严重也需要考虑二次开胸手术。部分外科医生会选择在二次开胸手术期间于支气管吻合口狭窄处放置Dumon支架,以减少吻合口狭窄的发生率[27]。术后部分患者会因静脉套囊技术并发静脉扭转,造成内部血栓的累积,影响肺部的血供[30],严重的术后静脉血栓会引起患者呼吸衰竭造成死亡[1]。蒋峰等[28]提出,由于肺静脉血管壁较薄,使用5-0 Prolene全线外包缝合,术中避免肺静脉扭转,可有效减少静脉血栓的形成。此外还存在与其他的常规肺移植类似的并发症,如肺部的水肿、感染,术后并发的肺不张、肺动脉吻合口狭窄等。
Yamashita等[5]报道过1例辅助治疗后进行抢救手术个案。局部晚期非小细胞肺癌患者在确定性放化疗(CRT)后对其进行离体左下袖肺叶切除术和上叶自体移植术。而在此之前并无患者因N2疾病而接受手术前分期或接受过化疗。术后9个月仍无疾病复发。
尽管自体肺移植术式的难度更大,但其住院死亡率的风险在1.6%~2.0%之间,明显低于全肺切除术[12]。Chida等[17]对23例患者进行了延长袖肺叶切除术,30 d内没有手术死亡或医院死亡。随访期间(10/23)死于癌症复发,但围术期的死亡率仍低于全肺切除术。Yamashita等[5]对1例放化疗后的鳞状细胞肺癌患者进行手术,术后9个月患者仍存活。单个肺叶切除的中心型肺癌患者围术期死亡风险约1.6%~2.0%,中位生存期10~18个月,长期存活率与全肺切除相差不大。Divithotawela等[29]对5例患者的预后进行了追踪,术后5年的存活率高于同期全肺切除术后的存活率(80%比32%)。但自体肺移植术后的并发症或癌转移仍然在很大程度上影响患者的预后。如并发支气管胸膜瘘、肺静脉栓塞,严重者需二次开胸手术。Chida等[12]报道的病例中(2/23)出现吻合口并发症,Inci等[22]术后的统计显示,4.9%(10/206)出现支气管管腔狭窄。蒋峰等[28]报道的患者存在1例(1/7)术后癌细胞脑转移死亡,Nakajima等[4]也指出1例术后死于癌复发的患者。最近王中秋等[30]在实验猪模型上进行丙丁酚对自体肺移植损伤的保护研究,结果表明,术前预防性地使用丙丁酚能够诱导移植肺HO-1蛋白水平表达增高,减少术后肺组织损伤。总体而言,自体肺移植的难度更大,术后早期的预后较好,早期的术后转移也不多见,恢复正常生活的时间较快。对仍保留有部分健康肺组织,且肿瘤侵袭程度尚且允许行自体肺移植手术的患者,该术式是较好的选择。
综上所述,自体肺移植保留了部分健康肺组织,最大限度地挽救了患者的肺功能,采用合理的术式将提高患者的术后生活质量,降低围手术期的死亡风险。但由于其术式复杂,难度大。且仅适用于癌组织浸润少量肺叶,使得肺叶切除术后剩余肺叶仍能维持正常肺功能的患者。虽然住院死亡率远低于全肺切除术,但长期看来,术后的并发症较多:PPLS造成的食管、纵隔的移位;支气管吻合口瘘及管腔狭窄等严重的并发症[24,25]。且现目前仍无法很好的规避自体肺移植的术后风险。更重要的是,自体肺移植术后的长期存活率与全肺切除术相差不大,这也导致许多医师偏好全肺切除术。近年来,自体肺移植的相关报道也多为个案或小样本的数据,无法进一步研究分析。如何有效预防和处理术后各并发症也是提高患者的远期预后的关键,我们需要更多大中心、多样本和更长时间随访的数据,进一步探究和评价自体肺移植的应用。随着基础和临床研究的不断深入自体肺移植在肺部疾病中的应用会更加广泛。
所有作者均声明不存在利益冲突