
本文综述了国内外常用的大鼠子宫移植模型和建立方法,为子宫移植研究的模型选择和构建提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
绝对子宫因素性不孕(AUFI)是指因子宫缺如或子宫生理、解剖方面的异常,导致女性无法妊娠或维持妊娠的一种疾病。世界范围内大约有3%~5%的女性患有AUFI。子宫移植是此类患者拥有遗传学后代的重要途径[1,2]。Eraslan等[3]于1966年实施犬类子宫移植。2000年Fageeh等[4]首次实施人类子宫移植。截止目前,全球开展超过60例人类子宫移植,至少有18例顺利妊娠[5]。子宫移植虽在临床上获得进展,但手术技术、术后治疗和免疫排斥等方面的挑战,仍限制了其成为AUFI的常规临床治疗手段。因此,仍需更多实验性研究来解决子宫移植领域存在的问题,而大鼠子宫移植模型在其中发挥着重要作用。
本文回顾了国内外大鼠子宫移植模型的建立方法并进行比较,以便该领域研究者能够根据研究目的和要求,选择并形成适合自身的标准化技术,为临床开展子宫移植奠定实验基础。
大鼠体型较大、生理特征明确、孕期短且具有多种近亲交配种系,较宜用于子宫移植。回顾文献,研究团队选择实验鼠的标准多为:(1)供鼠为性成熟或未交配过的雌鼠;(2)供、受鼠常为8~10周龄、体重170~200 g的雌鼠[6,7,8]。
Lee等[9]使用近交系Lewis大鼠行同基因全子宫卵巢移植。Díaz-García等[10]使用Lewis大鼠作供鼠,Piebald-Virol-Glaxo大鼠作受体行同种异体子宫移植。各团队根据其研究目的,在处理受鼠原位子宫时可将其切除后进行移植物原位移植[6,8,9,10,11],也可把移植物移植至腹腔并将阴道于腹部造口[7,12,13]。
大鼠麻醉途径包括吸入、腹腔注射和肌肉注射。吸入药物包括乙醚、七氟醚和异氟烷(4%~5%诱导,1%维持)等。腹腔内注射药物包括1%戊巴比妥钠(5 mg/100 g)、1%异戊巴比妥钠(1 mg/100 g)、氯胺酮等。氯胺酮(75 mg/kg)和赛拉嗪(11 mg/kg)混合溶液可用于肌肉注射麻醉,但肌肉注射的诱导时间、持续时间和作用强度不易预测,故不做常规推荐[7,9,11,12,13,14,15,16,17,18,19,20]。
供鼠常于麻醉后皮下注射肝素(1 000 IU/kg)。打开腹腔后常先离断直肠,切除膀胱,去除子宫阴道周围多余脂肪,扩大视野。移植物切取范围包括单侧子宫角,子宫体、3 mm左右的阴道及同侧子宫动静脉、髂总动静脉组成的血管蒂[6,7,8]。严沁等[13]在上述范围基础上扩大了血管蒂切取范围,包含部分腹主动脉和下腔静脉。Wranning等[6]切取范围包括右侧子宫角、子宫体、子宫颈和2~3 mm的阴道,其中右侧子宫角在距子宫角尖端7~8 mm处截断,以便在相同位置与受体残留子宫角行端端吻合。Jiga等[12]于腹主动脉左肾动脉分支水平下方切取获得全子宫卵巢移植物。移植物灌洗主要在腹主动脉和髂总动脉水平进行,常用灌洗液为4 ℃ Perfadex溶液或醋酸林格溶液,可按需要在其中加入利多卡因(0.4 g/L)和肝素(50 IU/ml)[6,7,8,12,13,21,22]。移植物获取后于显微镜下去除多余组织并在4 ℃灌洗液中保存备用。
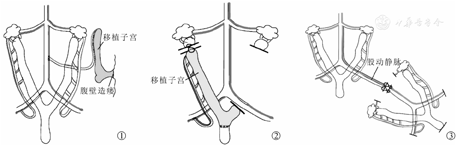
受鼠常于麻醉后皮下注射肝素(100 IU/kg)。打开腹腔后钝性分离预定血管吻合处周围组织。移植物置于预先设计位置,吻合静脉后吻合动脉。异位移植时,阴道残端于腹部造口(图1)。原位移植时,受鼠先行子宫切除,后行子宫移植。移植物的子宫角和阴道残端,分别与受鼠子宫角和阴道残端行端端吻合(图2)[6,7,8]。术中可将受鼠置于铺有温水袋(40 ℃)的隔热铝箔上保温[23,24]。缩短麻醉时间、保持水电解质平衡对避免实验动物早期死亡十分重要[25], Jiga等[12]允许大鼠自由进水,严沁等[13]要求受鼠术前禁食8~12 h,不禁水。受鼠手术前后可分别皮下注射2 ml林格氏葡萄糖并在关腹前腹内注射37℃4%艾考糊精溶液防止肠粘连。术中也可静脉注射6 ml乳酸林格氏液预防水电解质紊乱[7,23]。表1为受鼠移植子宫重建方法的总结。

血管重建是整个手术的关键。Eraslan[3]提出,大鼠子宫移植的血管重建方法主要由三个因素决定:(1)供鼠血管(2)受鼠血管(3)血管重建方式。表2为子宫移植时动脉选择的总结,静脉选择与动脉相同。

大鼠子宫移植动脉选择
(1)供鼠血管:髂总动静脉是最常使用的供鼠移植血管[6,7,8,10,21],也可选择部分腹主动脉和下腔静脉作为移植子宫的血管蒂[11,12,13]。
(2)受鼠血管:腹主动脉、下腔静脉[7,13]和髂总动静脉[6,8,10]是常见的受体血管。此外股动静脉也可作异位子宫移植端端吻合的受体血管[12](图3)。
(3)血管重建方式:为减少热缺血时间、降低手术风险,子宫移植模型的构建多采用单侧血管吻合,但其血供较正常少,可能不利于后期妊娠[26]。因此,为使受鼠顺利妊娠,进行双侧血管吻合更加合理。端侧吻合是子宫移植模型中最常见的血管吻合方式,常使用10-0尼龙线[6,7,8,12]。尽管各种微小血管的缝合技术被不断开发,但简单间断缝合仍是很多外科医师血管吻合的首选方式[27,28]。子宫移植时常使用简单连续缝合缩短手术时间[6,7,10],但该技术存在一些缺陷。首先,研究人员需经过一定训练才能熟练掌握显微外科技术;其次,简单连续缝合可能会缩小吻合口口径、限制吻合处血管的弹性扩张;最后,理论上连续缝合的缝线与血液接触面积较间断缝合更大,增加了血运不畅和血栓形成的潜在风险。与简单连续缝合相比,连续锁边缝合则同时具备简单间断缝合和简单连续缝合的技术优势,它的缝合时间与简单连续缝合相当,但缝线与血流直接接触的面积更小,成功率也更高[29]。
为使受鼠行子宫移植术后可以顺利妊娠,研究人员常使用他克莫司或环孢素来抑制免疫排斥反应。Díaz-García等[10]使用他克莫司单一治疗,给药途径是微量泵皮下给药。他克莫司起始剂量为0.4 mg·kg-1·d-1,4周后的维持期和妊娠期的剂量为0.2 mg·kg-1·d-1。对照组给予生理盐水。实验组孕中期的他克莫司血药浓度为(1.88±0.60)μg/L,后代发育良好。另一项研究中,实验组在子宫移植术中给予他克莫司0.5 mg·kg-1·d-1,术后使用微量泵持续给药至实验结束,剂量大约为0.02 mg·kg-1·h-1,起始剂量与维持剂量无明显差别,实验结束时实验组他克莫司血药浓度为11.4 μg/L[(4.6~18)μg/L] [8]。Akhi等[21]的实验组他克莫司给药剂量为0.5 mg·kg-1·d-1,持续给药14天后进行活检,他克莫司的中位血药浓度为3.6 μg/L[(1.2~6.3)μg/L]。何晓英等[30]术后给予环孢素A(10 mg/kg)每日肌肉注射,可有效抑制子宫移植急性排斥反应。环孢素A与其他免疫抑制剂联合应用可更充分抑制急性排斥反应[22]。
大鼠移植术后应每天观察、护理。术后评估和活组织病理学检查等均应遵守所在机构的动物福利原则。常规治疗方面,大鼠术后应使用加热灯进行保暖,直至苏醒。术后可给予大鼠布比卡因1 ml(5 mg/ml)切口周围注射局部镇痛,也可颈部皮下注射丁丙诺啡(0.005 mg/kg,2次/d)、卡洛芬(5.0 mg/kg,1次/d)、低分子肝素(100 IU/kg,1次/d)和磺胺类药物(100+20 mg/kg,1次/d)1~2 d,达到镇痛、抗凝和抗感染的目的[7,21,31]。
同基因大鼠子宫异位移植时,术者至少需30次以上的训练才能使动物存活率达到100%、移植物存活率达到70%~80%,移植物坏死的主要原因是血栓形成[7]。同基因原位移植术后动物存活率约为89%、移植子宫存活率约为81%[6]。异基因原位移植并用他克莫司抑制排斥反应,动物存活率约为86%、移植物存活率约为78%[10]。以上研究表明异位移植对动物的损伤可能相对较小,可提高动物存活率。术后排斥反应方面,用他克莫司作免疫抑制剂时,异基因与同基因移植术后的动物和移植物存活率差异无统计学意义,因此他克莫司是免疫抑制剂的良好选择。未使用免疫抑制剂的异基因模型在术后第5天出现明显排斥反应,术后14 d时移植子宫全部因排斥反应坏死[9,21,22]。
子宫移植的终极目标是获得健康后代。同基因大鼠子宫原位移植术后6~8周可引入雄鼠正常交配,首个发情周期的交配率和妊娠率与对照组差异无统计学意义,但实验组表现出较高的胚胎吸收率(19%)和分娩困难(57%)。高胚胎吸收率表明胚胎存活条件不理想,原因仍有待研究。分娩困难可能与移植物子宫缺乏相关神经调节和阴道吻合口狭窄有关,最终11只妊娠大鼠仅3只顺利分娩[6]。因此研究者在后续研究中采用剖宫产辅助分娩。研究发现假手术组和实验组单次妊娠的平均后代数量差异无统计学意义,但实验组雄性后代体重较对照组重,其他发育情况与对照组差异无统计学意义[10]。该研究提示子宫移植和他克莫司对妊娠过程存在一定负面影响,但就后代发育而言,使用他克莫司的子宫移植术是一种安全可行的方法。子宫异位移植模型阴道于腹壁造瘘,因此无法自然交配妊娠,胚胎移植是解决这个问题的良好选择[32]。
子宫移植在临床上展现出了巨大的应用前景,但其仍面临手术技术、术后治疗和免疫排斥等诸多问题,亟需动物模型研究解决。大鼠子宫移植模型以其多种优势,必将在解决上述问题方面发挥重要作用,推动临床子宫移植的发展进步。研究者应根据研究目的和术者经验选择合适的子宫移植模型构建方法。
所有作者均声明不存在利益冲突




























