
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
营养不良是多数肝移植受者术前存在的问题,主要表现为消瘦、肌肉减少、腹水、乏力、纳差等症状,其中约85%~95%肝硬化患者存在能量和蛋白质摄入不足[1]。围手术期的创伤应激、免疫抑制剂应用、麻醉等原因,导致机体营养摄入不足且分解代谢增加,进一步加重负氮平衡和营养不良[2]。这导致术后的并发症发生率及病死率明显增加,严重影响预后[3],而及时正确的营养支持可以改善受者的营养状态,促进其尽早康复[4]。目前,我国尚缺少指导肝移植围手术期营养支持的规范。因此,中华医学会器官移植学分会围手术期管理学组组织肝移植、营养学、麻醉学等方面的专家,按照循证医学原则,结合相关文献、专家经验和各临床中心的研究结果,深入论证,制订了《肝移植围手术期营养支持专家共识(2021版)》。
本共识证据质量和推荐强度依据推荐与评价分级系统(GRADE)工作组提出的循证医学证据分级标准,将证据质量分为"高级""中级""低级""极低级"4个等级(表1),推荐程度分为"强"和"弱"2个等级(表2)[5]。本共识提供的建议不仅基于证据质量,还取决于对临床工作的指导意义和价值,某些低质量的证据可能值得强烈推荐,反之亦然。

循证医学证据等级表
循证医学证据等级表
| 证据等级 | 定义 | 研究类型 |
|---|---|---|
| 高 | 我们非常确信真实的效应值接近效应估计 | 无限制、一致性好、精确、可直接应用、无发表偏倚的RCT;效应量很大的观察性研究 |
| 中 | 对效应估计值我们有中等程度信心:真实值有可能接近估计值,但仍存在二者大不相同的可能性 | 有严重限制、结果严重不一致、精确度严重不足、部分不能直接应用、可能存在发表偏倚的RCT;有剂量反应、效应最大的观察性研究 |
| 低 | 我们对效应估计值的确信程度有限:真实值可能与估计值大不相同 | 有极其严重限制、结果极其严重不一致、精确度极其严重不足、大部分不能直接应用、很可能存在发表偏倚的RCT;观察性研究 |
| 极低 | 我们对效应估计值几乎没有信心:真实值很可能与估计值大不相同 | 有非常严重限制、结果非常严重不一致的RCT;结果不一致的观察性研究;非系统的观察性研究(病例系列研究、病例报告) |
注:RCT(随机对照试验)

循证医学推荐强度表
循证医学推荐强度表
| 推荐强度 | 定义 |
|---|---|
| 强 | 明确显示干预措施利大于弊或者弊大于利 |
| 弱 | 利弊不确定或无论质量高低的证据均显示利弊相当 |
导致肝移植受者的营养不良多为能量、蛋白质或其他营养素缺乏,在整个围手术期都可能存在[2]。因此,对计划肝移植、列入肝移植等待者名单、术后的受者应及时动态地进行营养不良风险筛查和评估,以便及时调整营养支持方案和了解营养支持效果。
目前,临床上常用的营养不良风险筛查方法:(1)《营养风险筛查表2002》(Nutritional Risk Screening 2002,NRS 2002)是欧洲肠外肠内营养学会(European Society for Parenteral and Enteral Nutrition,ESPEN)在2002年对大量研究结果汇总分析后提出的,也是临床上广泛应用的成人住院患者营养风险筛查方法,在多种临床营养指南中受到推荐,被列入我国临床诊疗指南和行业标准[6,7,8,9]。患者的疾病类型越重评分越高,进食量少或体重明显下降的营养状态评分高,年龄超过70岁的加1分(表3)。当患者的三项评分汇总后超过3分时为存在营养风险,必须进一步评估营养不良程度和拟定营养支持计划。(2)《英国皇家自由医院营养优先工具》(Royal Free Hospital-Nutritional Prioritizing Tool,RFH-NPT)是在2012年英国一项多中心慢性肝病患者营养风险筛查的研究中首次提出的,为多种肝病临床营养指南中的营养筛查工具[10,11,12,13]。根据患者是否为急性酒精性肝炎或正在接受管饲营养、体液潴留情况、进食减少情况、体重下降情况进行流程评分(图1)。当总分超过2分时,患者存在高度营养不良风险,必须进一步评估营养不良程度和拟定营养支持计划。2020年发表的一项中国的前瞻性研究对155例肝硬化患者进行营养风险筛查结果显示:RFH-NPT和NRS 2002比营养不良通用筛查工具和肝病营养不良筛查工具拥有更好的灵敏性和特异性;而与NRS 2002比,RFH-NPT更容易预测存在的营养不良风险和病死率[14]。

营养风险筛查表2002(NRS 2002)
营养风险筛查表2002(NRS 2002)
| 项目 | 分值 | 标准 |
|---|---|---|
| A.营养状态受损评分(取最高分) | 0分 | 正常营养状态,BMI≥18.5 kg/m2,近1~3个月体重无变化,近1周食物摄入量无变化 |
| 1分 | 近3个月内体重丢失>5%,或近1周食物摄入量比正常需要量低25%~50% | |
| 2分 | 一般情况差,或近2个月内体重丢失>5%,或近1周食物摄入量比正常需要量低50%~75% | |
| 3分 | BMI<18.5 kg/m2且一般情况差,或近1个月内体重丢失>5%(或近3个月内体重丢失下降15%),或近1周食物摄入比正常需要量低75%~100% | |
| B.疾病严重程度评分(取最高分) | 0分 | 正常营养需要量 |
| 1分 | 需要量轻度增加:髋部骨折、慢性疾病伴急性并发症者(肝硬化、慢性阻塞性肺病)、长期血液透析、糖尿病、一般恶性肿瘤患者 | |
| 2分 | 需要量中度增加:腹部大手术、脑卒中、重度肺炎、血液恶性肿瘤 | |
| 3分 | 需要量明显增加:颅脑创伤、骨髓移植、APACHE评分>10分的重症监护病房患者 | |
| C.年龄评分 | 0分 | 年龄<70岁者 |
| 1分 | 年龄≥70岁者 |
注:总分为A+B+C,总分≥3分,患者处于营养风险,开始制定营养治疗计划;BMI(体重指数);APACHE(急性生理与慢性健康评估)
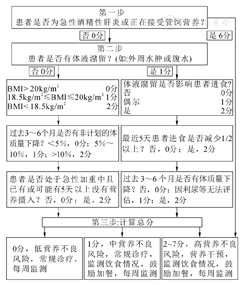

注:BMI(体重指数)
营养评估内容主要包括人体成分指标、综合评分工具等。(1)体重指数(body mass index,BMI):为人体成分的基本参数,可反映机体营养状态。低BMI是全球领导人发起的营养不良评定(诊断)标准中重要的表现型指标[8]。当BMI<18.5 kg/m2体重过低时,可直接判定为营养不良,此时肝硬化患者多存在肌少症或肝功能失代偿,同时需考虑体液潴留的影响[15,16]。(2)上臂围、三头肌皮褶厚度和上臂肌围:为推荐的评估营养状态的人体成分指标,当实测值/正常值<90%时,判定为营养不良,该方法不受体液潴留的影响[11,12,17]。(3)肌量和肌肉功能评定:肌肉量减少是诊断营养不良重要表现型指标[8]。约50%肝移植受者存在肌肉减少症,增加肝移植术后并发症发生率和病死率,是预测肝移植受者预后的重要指标,营养评估时需要重视肌肉量和功能指标测量[3,18,19]。利用CT和MRI进行肌肉量测定,选取第三腰椎水平截面图像,计算其中的骨骼肌横截面积之和,取其平均值除以身高的平方,即可得到腰3骨骼肌指数。当男性≤52.4 cm2/m2、女性≤38.5 cm2/m2时,认为存在肌肉减少症,需要进行必要的营养支持[20]。用握力评价肌肉功能,可预测肝硬化患者的预后且简单易行[21,22,23]。在静息状态下优势手握力:男性<25 kg,女性<18 kg考虑存在营养不良或肌少症,需要进一步测肌肉量来确定[24]。(4)实验室检测指标:血红蛋白、前白蛋白、血清白蛋白、淋巴细胞总数等也可以用于评估机体营养状态,动态观察对营养状态有较好的提示作用。(5)主观全面评定法(subjective global assessment,SGA):是广泛应用的临床营养综合评分工具,可以独立预测终末期肝病患者的预后,受到多种临床营养指南的推荐[25,26]。它主要通过病史采集和体格检查分别对患者的2周内体重变化、饮食情况、持续2周的消化道症状、运动能力、代谢应激情况、肌肉情况、三头肌皮褶厚度、体液潴留情况进行评价,每个项目分A、B、C三级。当至少5项超过A级者,可分别评定为营养不良,需拟定营养支持计划进行干预。不同的营养评估方法存在相应的局限性,联合不同方法可以更好地提高评估效能[27]。
推荐意见1:建议对所有肝移植围手术期的受者应用《营养风险筛查表2002》、《英国皇家自由医院营养优先工具》动态进行营养风险筛查。(证据级别:中;推荐强度:强)
推荐意见2:肌肉减少症是肝移植受者死亡率的一个强有力的预测因子,应通过握力和骨骼肌指数等方法来评估是否存在肌肉减少症。(证据级别:中;推荐强度:强)
推荐意见3:对肝移植受者进行营养评估,需联合使用至少两种方法来动态评估受者营养状态及营养不良程度,为及时调整营养支持方案提供依据。(证据级别:中;推荐强度:强)
肝移植受者术前普遍存在营养摄入量减少、蛋白质丢失、分解代谢亢进、消耗增加等问题,与肌肉减少症、腹水、肝性脑病、肝肾综合征等多种并发症的发生密切相关。营养支持的首要目标是达到能量和蛋白质的目标摄入量,以改善其营养状况,防止营养和肌肉进一步消耗,纠正维生素缺乏和电解质紊乱,以提高手术耐受力并改善临床预后[4]。
接受肝移植治疗的多为肝硬化、急性肝衰竭或肝癌患者。这些患者的24 h静息能量消耗(REE)升高约1.3~1.4倍,受测量方式影响数据间差异较大[28]。对肝移植术前存在营养不良或肌肉减少症的受者建议每日目标能量摄入30~35 kcal/kg或1.3倍静息能量消耗量[13]。充足的蛋白供给可以改善营养不良和肌肉减少症,改善移植效果[29],每日蛋白的供给量为1.2~1.5 g/kg[11,12]。每天供给110 g富含支链氨基酸和30纤维素可以改善肝性脑病,当每天供给1.2 g/kg蛋白可减少肌肉蛋白分解供能而并不增加肝性脑病发生率时,反而低蛋白供给增加发病率[30]。在增加蛋白供给改善营养不良时,增加支链氨基酸和植物蛋白供给可以改善肝性脑病症状[31,32]。提供脂肪乳供能时优先考虑结构脂肪乳,全面且对肝功能影响小[33]。肌肉减少症是肝移植受者面临的重要营养不良问题,严重影响受者生命,目前相关研究较少[34]。其治疗方法有营养支持、运动锻炼和药物治疗。前两者联合可有效地改善肌肉减少症。后者包括苯丙酸诺龙、普拉睾酮钠、生长激素等,虽能提高肌肉质量和功能,但在肝移植受者长期获益方面仍有待进一步研究[35]。近年来肝移植受者的肥胖发生率在升高,特别是少肌性肥胖,增加了肝移植手术难度和围手术期并发症的发生率,需要术前进行减重[36,37]。通过低热量饮食和锻炼减重5%~10%,明显改善肝功能,同时增加蛋白供给避免肌肉分解和蛋白丢失[13]。大量腹水时应控制钠和水的摄入[38]。术前准备禁食水时应遵循加速康复外科的原则,避免长期饥饿诱导肠道应激[39]。
推荐意见4:肝移植受者术前存在营养不良或肌肉减少症时,每日目标能量摄入为30~35 kcal/kg或1.3倍静息能量消耗量,每日目标蛋白质摄入1.2~1.5 g/kg;脂肪应占总能量的30%~50%;糖类占总能量的50%~70%,以低聚糖和多聚糖为主,并注意监测血糖,适当补充各种维生素及微量元素。(证据级别:中;推荐强度:强)
推荐意见5:BMI>30 kg/m2的肥胖受者,可通过生活干预方式减重5%~10%以上,每日目标能量摄入减为25 kcal/kg,为避免减重过程中肌肉减少,每日蛋白质摄入量增至2.0~2.5 g/kg。(证据级别:中;推荐强度:弱)
推荐意见6:当出现肝性脑病时,蛋白质摄入应以植物蛋白(每日1.0~1.5 g/kg)或支链氨基酸制剂(每日0.25 g/kg)为主,同时增加膳食纤维、补充肠道益生菌和白醋灌肠。(证据级别:中;推荐强度:弱)
推荐意见7:当合并大量腹水时,应严格控制每日钠的摄入量为80~120 mmol(相当于氯化钠4~6 g)。严重稀释性低钠血症者(血钠<125 mmol/L),需限制水的摄入量,每日应控制为1 000 ml。(证据级别:中;推荐强度:弱)
推荐意见8:静脉营养时可以中链脂肪为主,补充少量的长链脂肪,可应用结构脂肪乳,其含人体必需脂肪酸且对肝功能影响小。(证据级别:高;推荐强度:强)
推荐意见9:应根据加速康复外科方案管理患者,术前6 h禁食固态食物,术前2 h可饮用不超过400 ml的12.5%碳水化合物清亮饮料,以防止不必要的饥饿和胃肠道应激。(证据级别:高;推荐强度:强)
肝移植受者通常存在食欲不振、食管胃底静脉曲张、腹水、肝性脑病等,日常饮食难以达到目标量,需要口服营养补充剂、肠内或肠外营养进行营养支持[13]。围手术期营养支持的原则:在胃肠道功能、吞咽功能存在的情况下,优先经口饮食;为改善食欲增加经口进食量,在排除消化道出血等风险后,可使用促胃肠动力药物(莫沙必利、甲氧氯普胺、多潘立酮等);经口无法满足营养需求时,排除禁忌证后可留置胃空肠营养管,给予管饲肠内营养;当肠内营养不足时,应联合给予肠外营养[40]。肠外营养可通过外周静脉和中心静脉两种途径输注。周围静脉不能耐受高浓度及大剂量的液体输注,渗透浓度不大于600 mOsm/L,否则静脉炎的发生率明显增高。中心静脉途径有锁骨下静脉和颈内静脉,需注意导管相关感染的预防。
肠外营养时,胃肠道缺乏营养物质刺激,蠕动变差易使肠黏膜发生废用性萎缩,导致肠道通透性增加和细菌移位,增加肠源性感染率[41]。肠内营养可促进肠蠕动,改善肠道淤血及门静脉血流,调节胃肠道激素、胰液、胆汁和肠道免疫球蛋白的分泌,维持肠道黏膜的屏障功能[42]。肠内营养及肠外营养,各有其适应证和优缺点,应用时需相互配合、取长补短。
谷氨酰胺参与肠道黏膜细胞内物质合成和能量代谢,尤其在机体应激状态下可以保障肠道黏膜正常的结构及功能。肠道本身不能合成谷氨酰胺,且几乎无储备。肠外营养时需要及时补充谷氨酰胺,才能避免肠道黏膜萎缩,维持肠道内微生态平衡。谷氨酰胺还参与体内抗氧化物质的合成,在肝移植过程中能有效减轻缺血再灌注损伤[43]。
推荐意见10:只要咳嗽和吞咽反射存在、肠道功能完好,且无消化道出血等禁忌证,患者即应经口或管饲喂养进行肠内营养;当不能满足需求时,应联合给予肠外营养,以达到能量和蛋白质摄入目标。(证据级别:高;推荐强度:强)
推荐意见11:患者应避免长时间空腹,可将每日摄入营养目标量分4~6次餐来缩短饥饿期,并推荐夜间加餐以改善全身营养状况。(证据级别:高;推荐强度:强)
推荐意见12:肠外营养<7 d或用量较小时可用周围静脉输入,长期需要肠外营养支持的患者则使用中心静脉置管输入,同时需补充谷氨酰胺预防肠黏膜萎缩。(证据级别:高;推荐强度:强)
由于移植肝功能未恢复正常、手术创伤应激及免疫抑制剂的影响,机体调控三大营养物质能量代谢的能力变差,极易出现并导致内环境紊乱[4]。机体蛋白和脂肪大量分解,而肝脏对血氨及血脂的处理能力还未完全恢复,易诱发肝性脑病和酸中毒;移植肝的糖原合成、糖异生和激素灭活能力不足,易出现血糖剧烈波动,需要密切监测及时干预将血糖控制为6.1~8.3 mmol/L[39]。
肝移植受者的平均能量需求与大多数行腹部大手术患者的能量需求相似,在非蛋白供能时提供1.3倍REE就足够满足每日能量需求[40]。在一项纵向研究中,肝移植受者高代谢在术后第10天达到高峰,为预测基础代谢率的1.42倍,肝移植术后12个月测量基础代谢率和预测基础代谢率间差异才一致;肝移植受者术前全身测量蛋白量为无病预测全身蛋白量的82%,在术后10 d内丢失1 kg以上的蛋白质约占全身蛋白量的10%,且主要是骨骼肌蛋白[44]。肝移植术后6 d内的测量REE为(24.5±6.1)kcal/kg,与年龄、性别、手术时间等相关,是确保营养支持精准而安全的重要依据[45]。建议肝移植术后早期每日目标能量摄入量30~35 kcal/kg,每日补充1.2~1.5 g/kg的蛋白质[13,39]。
肝移植术后6 h内,移植肝的功能从冷保存期的休眠状态逐渐唤醒,对葡萄糖能量代谢要求不高以脂肪氧化供能为主,此时以补充脂肪乳、白蛋白为主,避免给予过高的热量加重移植肝负担[4]。随着移植肝功能逐渐全面恢复,需1~3 d增加能量和蛋白质至目标量。肠外营养时。胃肠道无损伤的肝移植受者,肠内营养可以在术后12 h即少量给予,根据受者耐受情况逐渐调整营养剂量,还可降低肝移植术后感染和胆道并发症的发生率[46]。一些术后早期需要给予管饲肠内营养的特殊受者,可择时放置鼻空肠营养管给予幽门后喂养,不建议经鼻胃管给肠内营养。对神志恢复慢和胃肠蠕动功能差的受者,建议每4 h监测胃残余量,防止胃潴留呕吐引起误吸。随着胃肠功能恢复和活动量增加,受者的食欲和营养需求会增加,在保证能量和蛋白质足量供给的情况下,可逐渐转换到正常饮食。
由于术中门静脉血流阻断肠道淤血、手术创伤应激等不利因素的影响,肝移植受者的肠道微生态容易发生改变,出现肠道菌群失调,引起肠道细菌移位,增加肠源性感染率,影响受者的预后。使用肠道菌群调节制剂,可以维持肠内微生态平衡,明显减少肝移植术后受者的肠源性感染发生率和抗生素使用量[47,48]。
推荐意见13:肝移植术后6 h内,以维持机体内环境平衡和稳定生命体征,保护移植肝和重要器官功能为目标;随着移植肝功能恢复正常,应逐渐增加能量和蛋白质供给,以达到每日目标能量摄入量30~35 kcal/kg,每日补充1.2~1.5 g/kg的蛋白质,脂肪应占总能量的30%~50%,糖类占总能量的50%~70%。(证据级别:中;推荐强度:强)
推荐意见14:在肝移植术后12 h即可经空肠营养管给予少量肠内营养,及时评估耐受情况,逐渐增加营养给予量。(证据级别:高;推荐强度:强)
推荐意见15:肠内营养时,建议经空肠营养管给予幽门后喂养,及时监测胃肠道功能。(证据级别:高;推荐强度:强)
推荐意见16:肝移植受者围手术期应给予富含活性益生菌制剂,以维持肠道微生态平衡。(证据级别:高;推荐强度:强)
由于术前病情重、手术创伤大、免疫制剂使用等因素,肝移植受者术后的营养状态完全恢复需要较长时间[4]。肝移植受者术后肥胖、高血糖、高血压、脂代谢紊乱和脂肪肝等代谢综合征发生率为40%~60%,会导致心血管疾病增加4倍,需要作针对性的预防[49]。绝大数肝移植受者在术后1年为正常代谢,测量的能量消耗较术前明显降低,术后过度能量和蛋白质摄入是发生代谢综合征的诱因,需根据测量能量消耗进行饮食调整[50,51]。长期应用免疫抑制剂影响肝移植受者术后营养代谢,他克莫司易导致血糖升高,糖皮质激素可引起肥胖和肌肉减少。一些食物影响机体内免疫抑制剂的代谢,导致免疫抑制剂血药浓度出现波动。碎片化的随访会明显增加肝移植受者术后病死率[52]。这就需要专业的肝移植随访医师和营养师,对肝移植手术受者定期进行筛查营养风险,评估营养状态,指导饮食方式,及时预防与营养代谢相关的远期合并症。
推荐意见17:肝移植受者出院后应在移植医院进行长期随访和定期评估营养状态,及时对饮食和生活方式调整。(证据级别:中;推荐强度:强)
目前我国肝移植技术已经成熟,移植数量处于快速发展阶段,肝移植围手术期营养相关的问题日趋凸显。肝移植围手术期营养支持的实施贯穿于术前、术中及术后多个阶段,需要肝移植医师、麻醉医师、重症医师、营养师、护士共同参与。临床医师在参考本共识诊治肝移植受者营养问题时,应充分考虑受者的差异性,科学合理地拟定并实施营养支持计划,以保障肝移植受者长期存活。
主审专家:石炳毅(中国人民解放军总医院第八医学中心);薛武军(西安交通大学第一附属医院);张水军(郑州大学第一附属医院);陈刚(华中科技大学同济医学院附属同济医院器官移植研究所)
专家组成员:(按姓氏汉语拼音字母排序)
蔡杰(华中科技大学同济医学院附属协和医院);陈栋(华中科技大学同济医学院附属同济医院);郭文治(郑州大学第一附属医院);黄磊(北京大学人民医院);巨春蓉(广州医科大学附属第一医院);李宁(山西省第二人民医院);刘秀珍(中国人民解放军总医院第八医学中心);刘盛(中国医学科学院阜外医院);林俊(首都医科大学附属北京友谊医院);吕国悦(吉林大学白求恩第一医院);彭龙开(中南大学湘雅二医院);潘晓明(西安交通大学第一附属医院);邱涛(武汉大学人民医院);司中洲(中南大学湘雅二医院);宋少华(上海交通大学附属瑞金医院);尚文俊(郑州大学第一附属医院);沈恬(浙江大学医学院附属第一医院);石炳毅(中国人民解放军总医院第八医学中心);王智勇(河北医科大学第三医院);王勇(郑州大学第一附属医院);王强(首都医学大学附属北京友谊医院);王毅(新疆医科大学第一附属医院);吴波(南京医科大学附属无锡人民医院);夏强(上海交通大学附属仁济医院);邢同海(上海交通大学附属第一人民医院);薛武军(西安交通大学第一附属医院);杨家印(四川大学华西医院);杨蕾(中国医科大学附属第一医院);喻文立(天津市第一中心医院);臧运金(青岛大学附属医院);张峰江(苏省人民医院);张雅敏(天津市第一中心医院);张微(浙江大学医学院附属第一医院);张晓明(山东省千佛山医院);张洪涛(空军军医大学西京医院);张水军(郑州大学第一附属医院);赵洪雯(陆军军医大学第一附属医院);赵强(中山大学附属第一医院);郑虹(天津市第一中心医院);钟河江(陆军军医大学新桥医院)
执笔人:方红波(郑州大学第一附属医院);李捷(郑州大学第一附属医院);庞春(郑州大学第一附属医院)
所有作者均声明不存在利益冲突


























