
探讨低氧诱导因子—脯氨酰羟化酶抑制剂(hypoxia-inducible factor prolyl hydroxylase inhibitor,HIF-PHI)预处理小鼠能否减轻炎症反应,减少细胞凋亡,缓解肾脏缺血再灌注损伤。
将雄性C57BL/6小鼠采用随机数字表法分为假手术(Sham)组、缺血再灌注损伤(IRI)组、IRI+HIF-PHI组,每组6只,其中IRI+HIF-PHI组提前1周隔天灌胃罗沙司他20 mg/kg。建立肾脏缺血再灌注模型后,检测各组小鼠血清肌酐(sCr)水平;HE染色观察小鼠肾组织病理变化并进行损伤评分;原位末端标记法(TUNEL)评估肾组织细胞凋亡;实时定量逆转录聚合酶链(RT-PCR)反应检测肾脏组织内低氧诱导因子1α(HIF-1α)、肿瘤坏死因子α(TNF-α)以及白介素1β(IL-1β)的mRNA表达水平;免疫荧光及免疫组化分别检测HIF-1α,炎症因子TNF-α和IL-1β表达情况。
与IRI组相比,IRI+HIF-PHI组小鼠sCr水平明显降低(P<0.01),肾组织损伤情况明显改善,肾小管损伤半定量评分更低(P<0.01),凋亡细胞减少(P<0.01),TNF-α和IL-1β的表达水平降低(P<0.05);相较于Sham组,IRI组HIF-1α的mRNA表达增加不明显(P>0.05),免疫荧光显示IRI组肾脏组织HIF-1α在髓质区表达增加,皮质增加不明显,而HIF-PHI预处理后,HIF-1α的mRNA表达明显增加(P<0.05),肾皮质HIF-1α的表达明显增加,但其髓质区HIF-1α表达弱于IRI组。
HIF-PHI能够提高HIF-1α表达水平,并减弱炎症因子表达,减轻炎症反应,达到抑制细胞凋亡、改善肾功能、缓解肾缺血再灌注损伤的作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
缺血再灌注损伤(ischemia reperfusion injury,IRI)是肾移植不可避免的环节,也是肾移植术后发生急性肾损伤(acute kidney injury,AKI)的重要原因之一,引起移植物功能延迟(delayed graft function,DGF),明显增加急性排斥反应发生率,影响移植肾和受者的长期存活。如何预防或减轻移植过程中缺血再灌注带来的损伤是临床上一大难题。
"氧感知通路"及抑制调控蛋白泛素化降解途径的发现,促进了对低氧诱导因子(hypoxia-inducible factor,HIF)参与肾脏病理机制的认识[1]。作为核心的调节因子之一,HIF表达的上调能有效地减轻多种缺血性损伤,其降解由脯氨酰羟化酶调控,因此低氧诱导因子—脯氨酰羟化酶抑制剂(hypoxia-inducible factor prolyl hydroxylase inhibitor,HIF-PHI),可以稳定HIF的表达,增强下游靶基因表达,缓解细胞缺氧损伤。罗沙司他目前主要用于治疗慢性肾性贫血,效果优于外源性促红细胞生成素[2],但它本质是一种HIF-PHI。已有报道此类药剂在一些AKI模型中确能起到保护作用,本实验则选用肾移植中不可避免的缺血再灌注损伤模型验证其能否也起到保护作用,并且关注其对损伤过程中炎症反应的作用。
同龄的雄性C57BL/6小鼠,8~10周龄,体重20~25 g,购买于浙江维通利华实验动物技术有限公司,饲养于河南省实验动物中心,饲养温度20℃~26℃;相对湿度50%~80%,自由接触水和饲料。采用随机数字表法将C57BL/6小鼠分为假手术(Sham)组,缺血再灌注损伤(IRI)组,IRI+HIF-PHI组,每组6只。
HIF-PHI罗沙司他(美国FibroGen公司);苏木素伊红(HE)染色试剂盒(武汉谷歌生物科技有限公司);脱氧核糖核苷酸末端转移酶介导的缺口末端标记(Tunel)细胞凋亡检测试剂盒(瑞士Roche公司);DAPI染液(武汉谷歌生物科技有限公司);低氧诱导因子1α(HIF-1α)多克隆抗体(美国Bioworld公司);肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)多克隆抗体(中国Beyotime公司);HIF-1α、TNF-α及IL-1β引物由武汉赛维尔生物科技有限公司合成。
IRI+HIF-PHI组小鼠提前1周隔天灌胃罗沙司他20 mg/kg,后进行缺血再灌注造模手术。本实验的预实验给药方式为提前2 h、1 d以及1周隔天灌胃给药。
小鼠经1%戊巴比妥钠80 mg/kg腹腔注射麻醉后,腹部去毛,行腹部正中切口,谨慎轻柔分离肾周组织,暴露右侧肾脏,分离右肾肾蒂及输尿管,用丝线结扎并切除右侧肾脏。随后暴露左侧肾脏,分离左肾肾蒂,用无伤血管夹阻断左肾血流,观察到肾脏颜色变深,计时25 min,后松开左肾血管夹,肾脏逐渐由紫黑色恢复粉红色,即为灌注成功。最后逐层缝合腹部切口。待小鼠苏醒后放回笼中。手术过程中小鼠肛温维持在(36.0±0.5)℃(ThermoStar体温维持仪)。假手术组小鼠采取同样的手术操作步骤,但不夹闭左肾肾蒂。
所有手术小鼠均于24 h采取样本。眼球采血,全血静置0.5~1.0 h,3 000 g离心15 min,取上清液,样本冻存于-80℃。采血后立即离断颈椎处死,即刻取下肾脏,撕下肾脏包膜,部分肾脏组织置于4%多聚甲醛固定,剩下部分肾脏用液氮速冻后冻存于-80 ℃深低温冰箱。
采用本院全自动生化分析仪测定血清肌酐(sCr),判断肾功能情况。
肾脏多聚甲醛固定后石蜡包埋,切成4 μm薄片HE染色,观察组织形态变化,并评估肾小管上皮细胞损伤程度(根据皮髓交界以及外髓质部位的损伤肾小管细胞坏死、小管腔膨胀、微绒毛脱落及管型形成等病理改变的比例进行小管损伤程度评分)。0分,未见;1分,<10%;2分,11%~25%;3分,26%~50%;4分,51%~75%;5分,76%~100%。
取甲醛固定肾组织切片行免疫荧光染色。细胞核显蓝光,HIF-1α显红光。观察HIF-1α在肾脏组织中的表达情况。
采用TUNEL法评估肾脏组织细胞凋亡情况,按细胞凋亡试剂盒说明书操作。计400倍镜下7个视野凋亡细胞数,进行统计学分析。
取肾脏切片行免疫组化染色,检测TNF-α、IL-1β在肾脏中的表达。苏木素染细胞核为蓝色,阳性表达为棕黄色。
取冻存肾组织样本,研磨器研磨后,应用Trizol试剂提取总RNA,采用实时定量逆转录酶聚合酶链反应(RT-PCR)法检测HIF-1α、TNF-α和IL-1β的mRNA水平。所用引物序列如下:HIF-1α上游引物为5'-GTCCCAGCTACGAAGTTACAGC-3',下游引物为5'-CAGTGCAGGATACACAAGGTTT-3';TNF-α上游引物为5'-CCACGCTCTTCTGTCTACTGAACT-3',下游引物为5'-GGGTCTGGGCCATAGAACTG-3';IL-1β上游引物为5'-GAAATGCCACCTTTTGACAGTG-3',下游引物为5'-TGGATGCTCTCATCAGGACAG-3'。
所用ABI StepOneTM实时RT-PCR仪为美国Applied Biosystems公司产品。以2,3-二羟基丙醛-3-磷酸脱氢酶(GAPDH)作为内参,按公式ΔCt= CtGene-CtGAPDH进行数据分析,ΔCt小表示目的基因起始拷贝数多,说明目的基因表达高;Folds=2-ΔΔCt公式计算目的基因HIF-1α、TNF-α、IL-1β表达的相对倍比关系。
采用GraphPad Prism 8.0.2进行统计学处理,计量资料以Mean±SD表示,结果均采用ANOVA分析。P<0.05为差异有统计学意义。
Sham组、IRI组和IRI+HIF提前2 h、1 d以及1周隔天灌胃后进行IRI手术(n=3)小鼠sCr分别为(21.87±2.6)μmol/L、(140.10±12.86)μmol/L、(132.00±8.81)μmol/L、(128.67±7.99)μmol/L、(83.70±6.41)μmol/L。术前2 h、1 d组小鼠sCr水平组间比较差异不明显(P>0.05);术前1周隔天灌胃后进行IRI手术,小鼠sCr水平较IRI组显著降低(P<0.01)。
Sham组、IRI组和IRI+HIF-PHI组再灌注24 h后sCr为(24.32±3.25)μmol/L、(134.62±25.45)μmol/L和(71.38±13.46)μmol/L,IRI组小鼠sCr水平明显高于Sham组(P<0.01),IRI+HIF-PHI组小鼠sCr水平明显低于IRI组(P<0.01)。
Sham组未见明显细胞坏死,IRI组可明显见皮髓交界以及外髓质部位的肾小管细胞坏死、小管腔膨胀、刷状缘消失及管型形成,HIF-PHI组小鼠肾脏可明显发现其肾小管损伤比IRI组小鼠肾脏轻,仅部分少量肾小管肿胀坏死(图1)。肾小管损伤半定量评分:Sham组为0分,IRI+HIF-PHI组为(1.57±0.72)分,显著低于IRI组的(3.57±1.05)分,差异有统计学意义(P<0.01)。
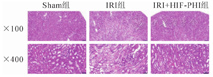

注:Sham(假手术);HIF-PHI(低氧诱导因子-脯氨酸羟化酶抑制剂)
Sham组凋亡检测未见明显凋亡(1.71±0.69)个/HP,IRI+HIF-PHI组凋亡细胞数(6.28±2.37)个/HP要明显低于IRI组(18.57±3.54)个/HP,差异有统计学意义(P<0.01,图2)。
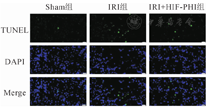

注:Sham(假手术);HIF-PHI(低氧诱导因子-脯氨酸羟化酶抑制剂)
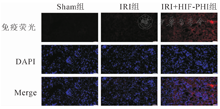
检测HIF-1α的mRNA的相对表达量,以Sham组(1.00±0.79)为标准,IRI+HIF-PHI组(4.85±2.17)的表达水平显著增加(P<0.05);而IRI组(1.64±0.74)的表达虽有增加但没有显著性差异(P>0.05)。免疫荧光可观察到小鼠肾脏组织中HIF-1α的表达情况。与Sham组对比,IRI组在皮质区HIF-1α的表达未见明显增加,而在IRI+ HIF-PHI组可观察到其表达明显增加(图3);然而在髓质区,IRI组HIF-1α的表达增加,而IRI+HIF-PHI组其表达相较于IRI组减少(图4)。

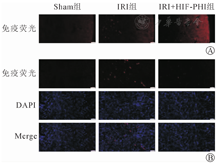

免疫组化染色:IRI+HIF-PHI组TNF-α和IL-1β表达均弱于IRI组(图5)。TNF-α、IL-1β的mRNA表达水平比较:以Sham组TNF-α(1.00±0.49)和IL-1β(1.00±0.36)的表达为标准,IRI组TNF-α(13.04±7.70)和IL-1β(18.48±7.61)的表达水平明显增强(P<0.05),而IRI+HIF-PHI组TNF-α(3.08±0.69)和IL-1β(7.88±2.20)的表达水平较IRI组弱(P<0.05)。
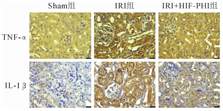

本次实验,我们首先发现HIF-PHI预处理能降低IRI术后小鼠肌酐值,减轻肾组织损伤,减少细胞凋亡,保护肾功能。然后检测HIF-1α在肾脏中的表达情况,未经HIF-PHI处理的小鼠行肾缺血再灌注后,HIF-1α表达是增加的但不明显,免疫荧光结果提示这个效应主要集中在髓质;而在灌胃HIF-PHI制剂后进行IRI手术的小鼠,HIF-1α的表达明显增加,免疫组化结果显示这个效应主要在皮质区,在其髓质HIF-1α的表达要弱于IRI组小鼠,这可能是由于HIF-PHI处理后小鼠在HIF-1α因子的作用下肾脏损伤较轻,诱导的HIF-1α较IRI组少。另外,TNF-α和IL-1β与细胞死亡和炎症密切相关[3],本实验也观察到HIF-PHI预处理小鼠进行IRI术后,炎症反应较IRI组明显减轻,证明了此类药物的肾功能保护作用。
HIF是一种转录因子,能够应答细胞内氧气浓度的降低并对多种基因进行调控,是一种内源性抗氧化应激调节剂。在常氧条件下,HIF通过蛋白酶体途径迅速降解,因此HIF在氧含量正常细胞中含量很少。在细胞缺氧时,HIF降解所需的脯氨酸羟化酶被抑制,同时组织损伤过程中产生的炎症因子TNF-α和IL-1β也会诱导了HIF因子的表达[4],使得HIF在细胞内累积,激活下游一系列靶基因,改善细胞缺氧,减轻损伤,增强细胞抗氧化应激能力。有研究指出,HIF-1α可以激活Nrf2-ARE通路,以减轻心肌缺血再灌注损伤和骨骼肌损伤[5,6]。最近研究热门的铁死亡亦可能与HIF有着密切联系,其下游基因HO-1的表达具有催化前氧化血红素分解为胆绿素的能力,具有改善铁死亡的作用[7,8]。可见,HIF在体内充当着十分重要的角色,在应对缺氧应激反应起到保护作用。
HIF的降解有赖于脯氨酰羟化酶,HIF-PHI可以抑制其降解。本实验是应用HIF-PHI减少HIF的降解,稳定其在细胞内的表达,以对即将到来的肾损伤进行预防。有研究报道,Roxadustat(FG-4592)可以减轻顺铂诱导AKI模型小鼠肾功能损害[9]。也有研究指出,抑制脯氨酰羟化酶可通过加强糖原合成来保护肾脏免受缺血损伤[10]。我们则是要从炎症反应入手去初步观察应用HIF-PHI稳定HIF表达给肾移植过程不可避免的IRI带来保护效应。炎症本身是一种保护性反应,恢复机体平衡,但是过度的炎症反应不但没有保护和恢复生理功能,甚至会加剧组织损伤。反映在本实验中,在缺血和再灌注过程发生氧化应激,这个过程会导致炎症介质的高表达,TNF是细胞损伤的主要驱动因素,而后又引起组织损伤造成更严重的IRI,形成恶性循环[11]。本实验中,检测了损伤经典炎症因子TNF-α和IL-1β的表达情况,发现HIF-PHI预处理后进行IRI手术的小鼠,这两种炎症因子的表达较IRI组均受到明显抑制。且综合HIF-1α在肾脏中的表达情况(HIF-PHI预处理后在髓质HIF-1α表达较IRI组弱,组织损伤较轻)说明了TNF-α和IL-1β的表达受到抑制。综上结果,我们可以得出HIF-PHI能够稳定肾脏细胞内HIF含量,减少炎症因子过度表达,减轻炎症反应,具有抑制细胞凋亡、改善肾功能、缓解肾脏缺血再灌注损伤的作用。在肾移植领域,AKI供肾[12]和老龄供肾[13]等边缘供肾更易受到缺血再灌注损伤的影响,有望使用此类药物提高供肾质量。
最后需要讨论的是,本实验直接选择使用的是上市临床口服药物罗沙司他,因此选择灌胃的方式给药,符合临床口服药物在人体中的生理环境。值得注意,在预实验中,术前2 h以及术前1 d给药保护效果并不明显,考虑到消化、吸收、排泄、转化以及HIF因子在肾脏中积累过程,为观察到可视的效果,我们提前1周隔天灌胃,药物带来的效应也较明显。因此可以得出一些思考,以口服的给药方式给实验动物进行干预,虽然可以模拟实际人体生理,但是想看到要研究的药理作用,应当在给药时间上适当延长。
感谢河南实验动物中心对病理实验和动物饲养的支持!
所有作者均声明不存在利益冲突



























