
探讨儿童减体积左外叶活体肝移植的疗效。
选择2014年1月至2019年12月天津市第一中心医院儿童器官移植科67例1岁以内的儿童受者接受减体积左外叶活体肝移植(RLLS组),回顾性分析这些受者的临床资料,比较其与左外叶活体肝移植受者(LLS组)基本资料、术后主要并发症以及术后受者、移植物存活率的差异;按移植物受者体重比率(GRWR)是否超过4%进行分组,比较两组术后主要并发症及受者、移植物存活率的差异。
减体积左外叶组受者年龄、身高、体重显著低于对照组(P<0.05),供者体重、供者体重指数(BMI)、拟供肝体积、供肝脂肪肝比例显著高于对照组(P<0.05),受者手术时长、术中失血量、输红细胞量显著高于对照组(P<0.05);术后中位住院时间、ICU停留时间、术后呼吸机支持时间两组差异无统计学意义,术后肝动脉血栓、门静脉狭窄、胆管并发症等主要外科并发症发生率两组间差异无统计学意义(P>0.05);减体积左外叶组受者和移植物术后1年、3年累积存活率分别为92.5%、91.2%和92.5%、91.2%,对照组受者和移植物术后1年、3年累积存活率分别为96.3%、95.3%和95.9%、95.1%,两组间比较差异没有统计学意义(P>0.05);GRWR>4%组术后肝静脉狭窄率显著高于对照组(P<0.05)。
由于技术的进步,减体积左外叶儿童活体肝移植取得了满意的疗效,是否实施减体积手术需根据术中供、受者匹配情况以及肝脏血流情况综合判断,GRWR>4%并不是绝对的实施标准。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
由于儿童肝移植中与受者大小匹配供肝的缺乏,劈离式、减体积和活体肝移植(living donor liver transplantation,LDLT)技术在过去几十年中得到快速发展[1,2,3]。这些技术创新扩大了供肝来源,降低了移植前等待期间死亡率。在我国,儿童肝移植受者通常在3岁以下,1岁以内的最为常见,在接受成人左外叶供肝时,移植物受者体重比率(graft recipient weight ratio,GRWR)易偏大从而导致大肝综合征,以致手术失败风险增加,而减体积技术是解决这一问题的有效手段[4,5]。本文回顾性分析了天津市第一中心医院近年来该类型手术相关临床资料,探讨了儿童活体肝移植中使用减体积左外叶(reduced left lateral segment,RLLS)供肝的临床特点和疗效,为进一步的工作及相关研究提供参考。
天津市第一中心医院儿童器官移植科2014年1月至2019年12月期间共收治的528例≤1岁的儿童受者接受活体肝移植手术,所有手术均经天津市第一中心医院及天津市卫生健康委员会人体器官移植技术临床应用与伦理委员会审查批准(编号2021NG154),符合法律及医学伦理学规定,随访截止日期为2021年1月31日。
按移植物类型分为2组,分别为左外叶供肝(LLS)组和减体积左外叶供肝(RLLS)组。LLS组共461例,男性207例,女性254例,中位月龄6.9月;RLLS组共67例,男性30例,女性37人,中位月龄6.5个月,其中,非解剖性减体积供肝63例(包括超减体积3例),S2段供肝4例。
术前经CT三维重建进行供肝左外叶评估,并估算移植物受者体重比率(GRWR);同时测量移植物厚度及受者腹腔前后径,计算二者比值即厚度比。满足GRWR>4%或厚度比≥1,术前预备减体积肝移植手术方案,具体操作视术中移植物-受者腹腔匹配情况及门静脉血流情况而定[5,6]。有如下情况之一时术中实施肝脏减体积:(1)腹腔容积较小而移植物体积相对较大致难以关闭腹腔;(2)由于移植物体积较大致门静脉流速低于20 cm/s或肝静脉血流呈单相波;(3)计算门静脉流量<50 ml/(min·100 g)。若移植物体积不大,但门静脉血流量<50 ml/(min·100 g),多为侧支分流所致,找到并结扎分流血管,门静脉血流可恢复。
基于肝脏段、叶解剖特点,可将减体积方式分为解剖性和非解剖性[7]。非解剖性减体积包括减体积左外叶以及超减体积左外叶,主要是通过切除左外叶边缘部分(下侧或外侧),实现减体积目标。解剖性减体积包括S2段、亚S2段以及改良S2段等,其优点是可有效减少移植物体积和厚度[7]。
非解剖性减体积左外叶:在保留左肝静脉内侧支的同时,切除左外叶的尾侧或外侧边缘部分。(图1)
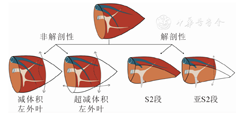

S2段:分离左外叶移植物后,在肝圆韧带入肝处暴露Gllison鞘S3段支,在根部阻断供应S3段的相应门静脉和肝动脉分支,在S2和S3表面划出缺血分界线,超声检查肝脏S2段血流,确认无异常后,根据分界线进一步进行肝切除术,得到S2段移植物,可在其外侧边缘继续减体积得到亚S2段移植物。(图1)
改良S2段:分离左外叶移植物后,结扎切除Gllison鞘S3段支的腹侧分支,同时保留Gllison鞘S3段支主干。即切面位于Gllison鞘S3段支主干所在平面,脐裂根部不作广泛解剖。移植物厚度充分减薄,可保留S3段背侧的门静脉支和引流肝静脉。[7]
所有受者手术均由经验丰富的外科医师实施,在手术放大镜或显微镜下进行,所有胆道重建均采用胆管空肠Roux-en-Y吻合,遵循标准化的外科手术流程。
收集供、受者术前一般资料包括性别、年龄、身高、体重、BMI、原发病、供受者关系、血型匹配情况、供肝脂肪肝等,术中记录手术时间、冷热缺血时间、无肝期、失血量、输血量、关腹前门静脉血流特征、GRWR等,术后情况包括手术次住院时间、ICU停留时间、术后呼吸机支持时间、随访期间内移植后并发症以及受者、移植物生存情况。比较两组间供、受者基本资料、术后主要并发症以及术后受者、移植物存活率的差异。按GRWR是否超过4%进行分组,比较两组术后主要并发症及受者、移植物存活率的差异。
根据病理检查结果,将脂肪变超过5%定义为脂肪肝(包括轻中重度)。自2018年4月起,本中心对关腹前门静脉压力及流量等指标做常规监测。门静脉压力采用直接测量法,将探针置入门静脉主干内,读取测压表压力值;门静脉流速及波形可通过术中超声实时测量,门静脉血流量计算公式:PVF=π·r2·0.57 Vmax·60[r为门静脉半径(cm);Vmax为门静脉流速(cm/s)],进一步计算PVF/100 g。
采用SPSS 25.0统计学软件对数据进行统计学处理。计数资料以例数和百分比表示,组间差异比较使用卡方检验或Fisher确切概率法;计量资料以Mean±SD或M(Q1,Q3)表示,并运用t检验或非参数秩和检验统计差异显著性;运用Kaplan-Meier法绘制生存曲线,并采用Log-rank检验比较两组受者及移植物术后存活率的差异。如果双侧P<0.05则认为差异有统计学意义。
RLLS组受者年龄、身高、体重低于LLS组,供者体重、供者体重指数、拟供肝体积(左外叶体积)、供肝脂肪肝比例高于LLS组,受者手术时长、术中失血量、输红细胞量高于LLS组,以上差异均有统计学意义(P<0.05);其他方面差异无统计学意义(P>0.05)。其中,RLLS组术中减体积重量中位数为60 g(38.5~100.0 g),减体积后中位GRWR为3.4%,与LLS组(3.4%)比较差异无统计学意义(P>0.05)。(表1)
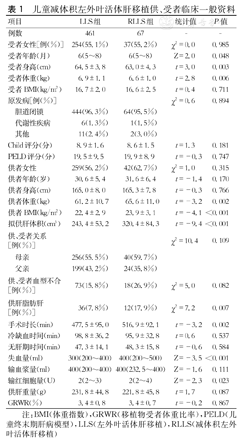
儿童减体积左外叶活体肝移植供、受者临床一般资料
儿童减体积左外叶活体肝移植供、受者临床一般资料
| 项目 | LLS组 | RLLS组 | 统计值 | P值 | |
|---|---|---|---|---|---|
| 例数 | 461 | 67 | - | - | |
| 受者女性[例(%)] | 254(55.1%) | 37(55.2%) | χ2=0.0 | 0.985 | |
| 受者年龄(月) | 6(5~8) | 6(5~8) | Z=2.0 | 0.048 | |
| 受者身高(cm) | 64.5±3.8 | 63.0±4.3 | t=3.0 | 0.003 | |
| 受者体重(kg) | 6.9±1.1 | 6.6±1.0 | t=2.8 | 0.006 | |
| 受者BMI(kg/m2) | 16.7±2.0 | 16.6±2.5 | t=0.4 | 0.711 | |
| 原发病[例(%)] | χ2=0.6 | 0.894 | |||
| 胆道闭锁 | 444(96.3%) | 64(95.5%) | |||
| 代谢性疾病 | 6(1.3%) | 1(1.5%) | |||
| 其他 | 11(2.4%) | 2(3.0%) | |||
| Child评分(分) | 8.9±1.6 | 8.6±1.5 | t=1.3 | 0.181 | |
| PELD评分(分) | 19.5±9.5 | 19.9±8.9 | t=-0.3 | 0.747 | |
| 供者女性 | 259(56.2%) | 42(62.7%) | χ2=1.0 | 0.315 | |
| 供者年龄(岁) | 30.6±5.4 | 31.6±6.4 | t=-1.4 | 0.170 | |
| 供者身高(cm) | 165.0±8.0 | 165.3±7.8 | t=-0.3 | 0.766 | |
| 供者体重(kg) | 61.2±10.7 | 65.6±11.0 | t=-3.2 | 0.002 | |
| 供者BMI(kg/m2) | 22.4±2.9 | 23.9±3.1 | t=-4.1 | <0.001 | |
| 拟供肝体积(cm3) | 243.4±53.2 | 320.4±84.3 | t=-9.4 | <0.001 | |
| 供、受者关系[例(%)] | χ2=10.4 | 0.109 | |||
| 母亲 | 256(55.5%) | 40(59.7%) | |||
| 父亲 | 199(43.2%) | 24(35.8%) | |||
| 供、受者血型不合[例(%)] | 73(15.8%) | 18(26.9%) | χ2=5.0 | 0.082 | |
| 供肝脂肪肝[例(%)] | 36(7.8%) | 12(17.9%) | χ2=7.2 | 0.007 | |
| 手术时长(min) | 477.5±95.0 | 516.9±92.1 | t=-3.2 | 0.002 | |
| 冷缺血时间(min) | 98.8±36.2 | 95.9±32.8 | t=0.6 | 0.537 | |
| 无肝期时间(min) | 47.3±14.1 | 48.3±15.8 | t=-0.6 | 0.584 | |
| 失血量(ml) | 300(200~400) | 400(200~500) | Z=-3.5 | <0.001 | |
| 输血浆量(ml) | 400(200~400) | 400(232.5~400) | Z=-1.6 | 0.111 | |
| 输红细胞量(U) | 2(2~3) | 2(2~4) | Z=-2.3 | 0.023 | |
| 供肝重量(g) | 231.8±44.8 | 221.8±45.8 | t=1.7 | 0.087 | |
| GRWR(%) | 3.4±0.8 | 3.4±0.7 | t=-0.2 | 0.867 | |
注:BMI(体重指数),GRWR(移植物受者体重比率),PELD(儿童终末期肝病模型),LLS(左外叶活体肝移植),RLLS(减体积左外叶活体肝移植)
两组在关腹前门静脉压力、流速、血流量等方面差异无统计学意义(P>0.05)。(表2)
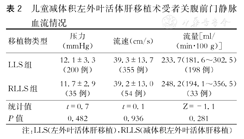
儿童减体积左外叶活体肝移植术受者关腹前门静脉血流情况
儿童减体积左外叶活体肝移植术受者关腹前门静脉血流情况
| 移植物类型 | 压力(mmHg) | 流速(cm/s) | 流量[ml/(min·100 g)] |
|---|---|---|---|
| LLS组 | 12.1±3.3(200例) | 39.3±13.7(355例) | 233.7(181.6~302.5) (198例) |
| RLLS组 | 11.7±2.9(35例) | 39.2±13.0(54例) | 248.2(194.1~356.5) (33例) |
| 统计值 | t=0.7 | t=0.1 | Z=-1.1 |
| P值 | 0.482 | 0.936 | 0.281 |
注:LLS(左外叶活体肝移植),RLLS(减体积左外叶活体肝移植)
两组术后主要外科并发症如肝动脉血栓、门静脉血栓或狭窄、肝静脉狭窄、腹腔出血、胆道狭窄、胆瘘等主要外科并发症发生率无显著差异(P>0.05),术后住院时间、ICU停留时间、术后呼吸机支持时间等无显著差异(P>0.05)。(表3)
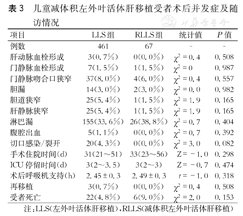
儿童减体积左外叶活体肝移植受者术后并发症及随访情况
儿童减体积左外叶活体肝移植受者术后并发症及随访情况
| 项目 | LLS组 | RLLS组 | 统计值 | P值 |
|---|---|---|---|---|
| 例数 | 461 | 67 | - | - |
| 肝动脉血栓形成 | 3(0.7%) | 0(0.0%) | χ2=0.4 | 0.508 |
| 门静脉血栓形成 | 7(1.5%) | 1(1.5%) | χ2=0 | 0.987 |
| 门静脉吻合口狭窄 | 37(8.0%) | 4(6.0%) | χ2=0.4 | 0.557 |
| 胆漏 | 14(3.0%) | 2(3.0%) | χ2=0.0 | 0.982 |
| 胆道狭窄 | 25(5.4%) | 1(1.5%) | χ2=1.9 | 0.165 |
| 肝静脉狭窄 | 25(5.4%) | 1(1.5%) | χ2=1.9 | 0.165 |
| 淋巴漏 | 155(33.6%) | 26(38.8%) | χ2=0.7 | 0.404 |
| 腹腔出血 | 5(1.1%) | 0(0.0%) | χ2=0.7 | 0.392 |
| 切口感染/裂开 | 20(4.3%) | 0(0.0%) | χ2=3.0 | 0.082 |
| 手术住院时间(d) | 31(21~51) | 33(23~56) | Z=-1.0 | 0.298 |
| ICU停留时间(d) | 3(2~3.5) | 3(2~3) | Z=-0.7 | 0.474 |
| 术后呼吸机支持(h) | 2.45±0.3 | 2.49±0.3 | t=-1.0 | 0.318 |
| 再移植 | 3(0.7%) | 0(0.0%) | χ2=0.4 | 0.508 |
| 受者死亡 | 22(4.8%) | 6(9.0%) | χ2=2.0 | 0.153 |
注:LLS(左外叶活体肝移植),RLLS(减体积左外叶活体肝移植)
LLS组和RLLS组术后中位随访时间分别为35个月和29个月。其中,LLS组受者1年、3年累积存活率分别为96.3%、95.3%,RLLS组受者1年、3年累积存活率分别为92.5%、91.2%,两组间比较,差异无统计学意义(χ2=2.13,P=0.14);LLS组移植物1年、3年累积存活率分别为95.9%、95.1%,RLLS组移植物1年、3年累积存活率分别为92.5%、91.2%,两组间比较,差异无统计学意义(χ2=1.63,P=0.2)。(图2)
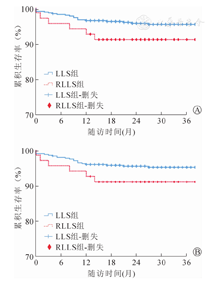

注:LLS(左外叶活体肝移植);RLLS(减体积左外叶活体肝移植)
两组术后死亡受者共计28例(5.30%)。其中,LLS组22例(4.32%),7例死于肺感染所致呼吸衰竭,4例死于PTLD及相关并发症,2例死于肝衰竭,2例死于气道异物所致窒息,2例死于感染性休克,1例死于多脏器衰竭,1例死于脑出血,1例死于呼吸心搏骤停,1例死于院外严重腹泻,1例院外死亡情况不明;RLLS组死亡6例(8.96%),死因分别为重症肺炎、心衰、PTLD、窒息(2例)、严重腹泻等。
供肝左外叶减体积前共有137例GRWR>4%,其中43例实施了左外叶减体积,24例GRWR≤4%的受者因腹腔容积不够或血流问题实施了左外叶减体积手术。按照最终真实GRWR是否超过4%将研究人群分为两组,在术后主要并发症、受者及移植物生存情况等方面进行比较。
GRWR>4%组术后肝静脉狭窄率(9.7%)高于GRWR≤4%组(3.7%),差异有统计学意义(P<0.05);其他主要外科并发症比较,差异无统计学意义(P>0.05)。(表4)
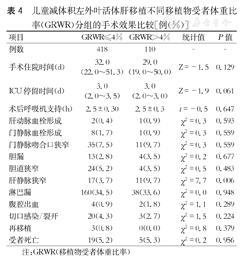
儿童减体积左外叶活体肝移植不同移植物受者体重比率(GRWR)分组的手术效果比较[例(%)]
儿童减体积左外叶活体肝移植不同移植物受者体重比率(GRWR)分组的手术效果比较[例(%)]
| 项目 | GRWR≤4% | GRWR>4% | 统计值 | P值 |
|---|---|---|---|---|
| 例数 | 418 | 110 | - | - |
| 手术住院时间(d) | 32.0(22.0~51.3) | 29.0(19.0~50.0) | Z=-1.5 | 0.129 |
| ICU停留时间(d) | 3.0(2.0~3.5) | 3.0(2.0~3.0) | Z=-1.9 | 0.061 |
| 术后呼吸机支持(h) | 2.5±0.30 | 2.5±0.3 | t=-0.5 | 0.647 |
| 肝动脉血栓形成 | 2(0.4) | 1(0.9) | χ2=0.3 | 0.593 |
| 门静脉血栓形成 | 8(1.7) | 1(0.9) | χ2=0.3 | 0.559 |
| 门静脉吻合口狭窄 | 35(7.5) | 11(9.7) | χ2=0.3 | 0.559 |
| 胆漏 | 13(2.8) | 4(3.5) | χ2=0.2 | 0.677 |
| 胆道狭窄 | 24(5.2) | 4(3.5) | χ2=0.5 | 0.483 |
| 肝静脉狭窄 | 17(3.7) | 11(9.7) | χ2=7.7 | 0.006 |
| 淋巴漏 | 160(34.5) | 38(33.6) | χ2=0.0 | 0.948 |
| 腹腔出血 | 4(0.9) | 2(1.8) | χ2=1.1 | 0.289 |
| 切口感染/裂开 | 20(4.3) | 3(2.7) | χ2=1.5 | 0.224 |
| 再移植 | 3(0.8) | 0(0.0) | χ2=0.8 | 0.379 |
| 受者死亡 | 19(5.2) | 5(5.3) | χ2=0.2 | 0.956 |
注:GRWR(移植物受者体重比率)
GRWR≤4%组和GRWR>4%组术后中位随访时间分别为36.5个月和29.5个月。其中,GRWR≤4%组受者1年、3年累积存活率分别为95.9%、94.9%,GRWR>4%组受者1年、3年累积存活率分别为95.5%、94.1%,两组间比较,差异无统计学意义(χ2=0.016,P=0.9);GRWR≤4%组移植物1年、3年累积存活率分别为95.5%、94.7%,GRWR>4%组移植物1年、3年累积存活率分别为95.5%、94.1%,两组间比较,差异无统计学意义(χ2=0.0013,P=0.97)。(图3)
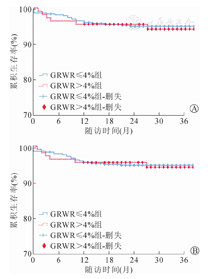

儿童活体肝移植中,左外叶供肝是最常见的移植物类型,但对于低体重儿童受者,左外叶移植物仍可能偏大,从而引起"大肝综合征"(large-for-sizesyndrome,LFSS),甚至导致手术失败。不良影响包括:(1)移植物-受者腹腔容积错配,导致关腹困难、供肝受压和腹内高压等,甚至引发腹间隔室综合征或呼吸循环障碍;(2)血流动力学障碍,大肝导致门静脉灌注相对不足,供、受者血管匹配差,或合并关腹后移植肝血管扭转、打折、狭窄闭塞或胆道并发症等,导致移植肝缺血或淤血性损伤甚至原发性无功能,最终需再次手术调整或再移植[8]。研究证实早期血管并发症是导致移植物丢失主要原因[9],门静脉血流障碍是导致手术失败的高危因素,同时保证门静脉血流灌注对避免全身性感染至关重要[10,11,12]。
移植物大小不匹配是儿童肝移植中的一项重要问题,1999年Kiuchi等[13]提出将GRWR>4%作为"大肝"的标准并成为减体积肝移植的适应证,其后随儿童肝移植成功经验的积累,移植物形状尤其是移植物厚度-受者腹腔前后径比≥1成为另一项重要指征[6,14]。然而,基于对"大肝综合征"发生机制的认识,其所致的容积错配和移植物血流障碍应是不良预后的主要原因。因此,术中对上述两方面的监测评估,可作为判断"大肝"的直接证据。本研究中GRWR>4%组同GRWR≤4%组相比,肝静脉狭窄率升高,原因可能是关腹后供肝受压、位置不佳,导致流出道扭转、打折等;术后其他主要外科并发症发生率及受者移植物存活率等总体预后情况两组比较无明显差异,与文献中报道基本一致[15,16]。GRWR>4%应不是减体积肝移植的绝对适应证,需更多研究来进一步探讨儿童肝移植中减体积的具体手术指征。术前规划有助做出手术预案,但是否减体积同时也要视术中实际情况,除移植物-受者腹腔容积错配外,关腹前后门静脉和肝静脉的血流情况可能是较为关键的指标。
目前主要的减体积方式可分为非解剖性和解剖性两类[17,18,19]。前者包括减体积和超减体积技术,主要通过切除左外叶边缘部分获得更小的体积,其技术相对简单,可根据需要保留相应肝脏实质和血管,Hirata等[4]报道了一种新式的左外叶内侧减体积方法,可达到减少厚度的目的。后者主要包括S2段、亚S2段、改良S2段和S3段等,相较非解剖性方式,可有效减少移植物的厚度和体积,Kitajima等[7]报道其术后血管、胆道并发症发生率更低,移植物体积可在早期快速增加,且具有更好的短期和长期预后。与S3段移植物相比,肝脏S2段具有更小的体积和厚度,且易于摆放固定,更适合小体重儿童受者。然而,解剖性减体积增加了肝段重要管道损伤的风险,同时单段移植物保留的Glisson鞘数量少且纤细,这可能会影响未来的胆汁排泄,且增加了放射介入治疗术后胆道血管并发症的难度[5]。减体积具体方式的选择应考虑左外叶供肝的形状大小及解剖特点,如"比目鱼"型可采用非解剖性方式,"河豚"型可采用解剖性方式以减少厚度[12]。本研究中共纳入减体积左外叶肝移植67例(12.69%),其中S2段供肝4例,除1例术后出现门静脉吻合口狭窄外,未发生其他主要外科并发症,随访期内受者及移植物均存活。后续可在规范化手术流程的基础上继续增加样本量,进一步探讨不同减体积术式的临床特征。
减体积操作可在体内或体外完成,而后者可使冷缺血时间延长从而影响移植物功能恢复,故较少采用。除肝脏大小外,门静脉血流还受到供、受者血管解剖特点及术前门静脉高压等因素的影响。为进一步保证移植肝血流,术中可选择性结扎门静脉分流血管,关腹前合理摆放供肝位置并悬吊固定,避免供血管受压扭转等。若供肝过厚导致关腹困难,可应用人工补片或皮肤临时关腹,但可增加伤口及腹腔感染风险[19]。
本研究中,RLLS组术后主要外科并发症(如门静脉狭窄、肝动脉血栓等)与LLS组比较差异无统计学意义,按常规治疗原则,如门静脉血栓,早期一般是手术治疗,晚期一般是抗凝、介入治疗,门静脉狭窄一般是球囊扩张治疗。
减体积技术相对简单,可获得大小形状合适的供肝,提高手术成功率,但其延长总体手术时间、增加对移植物的损伤、增加胆瘘及出血等风险,所以需要充分的术前评估与预案、精细的手术技巧以及合理的围术期管理,通过加强多学科协作,来提高减体积肝移植临床疗效。本研究中,RLLS组所有受者均一期关腹,关腹前门静脉血流情况良好,术后主要外科并发症发生率等与LLS组相比差异无统计学意义,两组总体预后差异无统计学意义,提示减体积左外叶肝移植能够取得良好的临床效果。
综上,减体积左外叶肝移植能有效避免大肝综合征的发生,在充分术前评估和精细手术操作的基础上,可取得良好的临床疗效。在儿童活体肝移植中,减体积左外叶供肝是一种安全可行的选择。对于是否实施减体积手术不应单纯以GRWR为标准,要综合考虑移植肝与儿童受者腹腔的匹配程度以及肝脏血流的情况。
所有作者均声明不存在利益冲突



























