
探讨Mindin基因巨噬细胞特异性敲除小鼠的构建,及其在肺缺血再灌注损伤(ischemia-reperfusion injury,IRI)中的作用机制。
通过Cre-Lop系统构建Mindin基因巨噬细胞内特异性敲除小鼠,将小鼠分为C57/B6野生型小鼠假手术组(Sham组,10只)、C57/B6小鼠手术组(Surgery组,10只)、C57/B6小鼠手术组+Mindin重组蛋白干预组[Surgery(WT)+Mindin组,10只]和Mindin-/-巨噬细胞特异性敲除小鼠手术组[Surgery(Mindin-/-)组,10只]。通过夹闭肺门法构建肺IRI模型,观察该基因敲除及重组蛋白干预后,对肺IRI诱导的急性肺损伤(acute lung injury,ALI)、相关炎症因子IL1β、IL-18、TNF-α、高迁移速率蛋白B1(HMGB1)及核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、Gasdermin-D蛋白(GSDMD)、整合素β4(Integrin β4)的影响。同时,对小鼠巨噬细胞J774A细胞系进行干预,检测不同缺氧复氧分组(缺氧复氧组、缺氧复氧+Mindin重组蛋白组和缺氧复氧+Mindin siRNA组)中NLRP3、GSDMD及Integrin β4蛋白的表达,及不同Mindin重组蛋白分组(重组蛋白组、Mindin重组蛋白+Vehicle组和Mindin重组蛋白+Integrin β4敲除组)中NLRP3、GSDMD蛋白的表达。使用独立样本t检验以及单因素方差对研究结果进行统计学分析。
本研究成功构建Mindin基因在巨噬细胞内特异性敲除小鼠。Surgery(Mindin-/-)组与Surgery组相比,小鼠肺水肿减轻;炎症因子IL1β、IL-18、TNF-α、HMGB1的释放均减少(2.73±0.19比5.81±0.61,6.52±0.63比11.03±0.34,2.18±0.14比4.76±0.20,14.57±0.33比8.76±0.87),组间比较,差异均有统计学意义(P均<0.05);NLRP3、GSDMD、Integrin β4分泌均下调(2.07±0.27比4.91±0.22,2.78±0.37比5.78±0.29,3.04±0.75比7.71±0.34),组间比较,差异亦有统计学意义(P均<0.05)。Surgery(WT)+Mindin重组蛋白组与Surgery组比较,上述相关指标结果均出现上调,组间比较,差异亦有统计学意义(P均<0.05)。小鼠巨噬细胞J774A细胞系缺氧复氧组、缺氧复氧+Mindin siRNA组和缺氧复氧+Mindin重组蛋白组NLRP3、GSDMD及Integrin β4蛋白分别为1.00±0.36比0.41±0.06比4.13±0.23、1.00±0.17比0.34±0.16比6.32±0.46和1.00±0.11比0.28±0.07比3.53±0.17。与缺氧复氧组比较,缺氧复氧+Mindin重组蛋白组上述参数均上调,而缺氧复氧+Mindin siRNA组均下调,且组间差异均有统计学意义(P均<0.05)。Mindin重组蛋白组、Mindin重组蛋白+Vehicle组、Mindin重组蛋白+Integrin β4敲除组中NLRP3和GSDMD蛋白分别为1.00±0.07比1.13±0.11比0.51±0.14和1.00±0.09比0.87±0.16比0.37±0.12。Mindin重组蛋白+Integrin β4敲除组上述参数较Mindin重组蛋白组及Mindin重组蛋白+Vehicle组均下调,且组间差异均有统计学意义(P均<0.05)。
在肺IRI过程中Mindin敲除能够减轻IRI,Mindin基因可能通过激活整合素Integrin β4,进而促进相关炎症因子、NLRP3、GSDMD焦亡蛋白的表达,加重细胞焦亡从而促进肺IRI的发生发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺缺血再灌注损伤(ischemia-reperfusion injury,IRI)是肺移植术后常见并发症,约50%的移植物功能障碍与肺IRI有关,且肺IRI是围手术期死亡以及慢性排斥反应的高风险因素[1]。目前除了对症支持治疗,没有明显有效的药物治疗方案去减轻肺IRI。因此,探索肺移植IRI相关的靶基因及其发生机制很有必要。
Mindin(Spondin2)蛋白是模式识别分子,作为细胞外基质(extracellular matrix,ECM)在机体的固有免疫过程中发挥重要作用,由于其N终端与FS组件可以通过与整合素(Integrin)细胞接触进行细胞内信号的传导,对炎性细胞进行招募对T细胞发挥启动效应[2]。另外,其C末端凝血栓蛋白-1Ⅰ型重复序列(thrombospondin-type 1 repeat,TSR)结构域可以识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs)并启动固有免疫。目前认为Mindin可与整合素β4(Integrin β4)结合在肿瘤的进展中发挥相关作用,但其在肺IRI中的作用尚不明确。本研究通过构建Mindin基因巨噬细胞内特异性敲除小鼠,观察其在肺移植IRI中的作用机制。
6周龄Lyz2-Cre(+/+)小鼠(雌雄各3只,体质量20~30 g)和96周龄雄性Mindin flox/-小鼠(3只,体质量20~30 g)均购自江苏集萃药康生物科技有限公司(GJS072021032140)。8周龄C57/B6野生型小鼠(雌雄各10只,体质量20~30 g)来源于湖北省实验动物中心(42000600038779)。
本研究遵守赫尔辛基宣言相关内容,保护人类健康和权力,保护环境并尊重研究中所使用动物的福利。本研究中动物实验已通过武汉大学人民医院动物医学伦理委员会批准(2021K-K180)。
动物基因组DNA快速抽提试剂盒及Taq Master Mix购自生工生物工程(上海)股份有限公司;基因鼠所用鉴定引物由江苏集萃药康生物科技有限公司设计,北京擎科生物科技有限公司负责合成。
(1)将Lyz2-Cre(+/+)小鼠与野生型小鼠杂交获得杂合Lyz2-Cre(+/-小鼠;(2)将Mindin flox/-小鼠自交获得Mindin flox/flox小鼠和Spon2 flox/-小鼠;(3)将Lyz2-Cre(+/-)小鼠与Mindin flox/flox小鼠或Mindin flox/-小鼠杂交,得到杂合小鼠Lyz2-Cre(+/-)Mindin flox7/-;(4)将获得的杂合小鼠Lyz2-Cre(+/-)Mindin flox/-与Mindin flox /flox小鼠或Mindin flox/-小鼠杂交,获得目的小鼠Lyz2-Cre(+/-)Mindin flox/flox;(5)使用Lyz2-Cre Mindin flox/flox小鼠和Mindin flox /flox小鼠分别作为巨噬细胞特异性敲除Mindin小鼠和对照小鼠。
取3周龄左右小鼠,剪取鼠尾约5 mm,使用动物基因组DNA快速抽提试剂盒提取小鼠基因组DNA。首先加入400 μl消化缓冲液和40 μl蛋白酶K溶液,置于65℃水浴裂解1 h;裂解完成后,加200 μl PA缓冲液,充分颠倒混匀后置于-20℃放置5 min,室温下以10 000转/分离心5 min(离心半径为10 cm),并转移上清。再加入等体积异丙醇,充分混匀后室温放置2~3 min,室温下以10 000转/分离心5 min(离心半径为10 cm),弃上清后用75%乙醇清洗2遍,开盖室温倒置5~10 min至乙醇完全挥发。最后将得到的基因组DNA用50 μl TE缓冲液溶解,溶解液即为基因组DNA。将提取的基因组DNA测定浓度后用PCR扩增目的基因,引物序列见表1。待PCR反应完成后,取8 μl PCR产物进行琼脂糖凝胶电泳实验,鉴定小鼠基因型。鉴定基因型所需引物序列见表1。我们通过分离巨噬细胞,用蛋白质印迹法检测Mindin蛋白,以检测动物模型构建的有效性。

基因型鉴定引物序列
基因型鉴定引物序列
| 基因名称 | 引物序列(5'-3') | |
|---|---|---|
| Lyz2 | 5'端 | F:AGTGCTGAAGTCCATAGATCGG |
| R:CTGATTCTCCTCATCACCAGG | ||
| 3'端 | F:AGTGCTGAAGTCCATAGATCGG | |
| R:GTCACTCACTGCTCCCCTGT | ||
| Mindin | 5'端 | F:CTCCACCCTCTGTAATCCACAGACAC |
| R:GTATGATGCAAGCTACTCGGCTGGT | ||
| 3'端 | F:GATATGACTACGTGGAAGCACTACTGG | |
| R:TCACAATCGTCACCATCTGGCTG | ||
采用随机数字表法,将C57/B6野生型小鼠平均分为3组,每组10只。其中,C57/B6野生型小鼠假手术组(Sham组,10只)、C57/B6野生型小鼠手术组(Surgery组,10只)和C57/B6野生型小鼠手术组+Mindin重组蛋白干预组[Surgery(WT)+Mindin组,10只];另外,Mindin-/-巨噬细胞特异性敲除小鼠手术组[Surgery(Mindin-/-)组,10只]。假手术组均采用开胸关胸干预(延小鼠左侧第3肋间侧开胸3 h后收集标本)。手术组均通过夹闭小鼠肺门的方法进行手术干预,构建肺IRI模型。术中夹闭左侧肺门1 h,开放2 h后收集小鼠血清、肺组织以及其他脏器。
小鼠巨噬细胞J774A细胞系来自中国细胞系库(北京,中国),通过含10%胚胎牛血清的DMEM培养基,在37°C、5%CO2温箱中培养。用Mindin/Integrin β4 siRNA敲除J774A中Mindin/Integrin β4的表达。J774A转染使用Lipofectamine 3000(赛默非,美国),根据说明书步骤进行操作。
用预热的无糖D-Hank's液替换原培养基,反复冲洗多次,使葡萄糖浓度低于1 mmol/L。以一医用塑料容器袋营造密闭环境,将实验细胞置入其中,接一个肝素帽,通入体积分数为95%N2/5%CO2混合气体,反复多次稀释原空间内氧气,关闭肝素帽,置入37℃恒温细胞培养箱中,饱和湿度条件下培养。此时开始计缺氧处理时间。复氧则将细胞更换至正常糖浓度DMEM培养基,将细胞置于37℃,5%CO2的细胞培养箱内培养,记为复氧时间。
部分巨噬细胞单纯给予缺氧复氧干预(缺氧复氧组),部分在缺氧复氧基础上给予Mindin重组蛋白干预(缺氧复氧+Mindin重组蛋白组),还有部分Mindin siRNA转染后再给予缺氧复氧干预(缺氧复氧+Mindin siRNA组)。另有部分巨噬细胞给予Mindin重组蛋白干预(重组蛋白组),部分空白质粒Vehicle转染后再行Mindin重组蛋白(Mindin重组蛋白+Vehicle组),还有部分Integrin β4 siRNA转染后再行Mindin重组蛋白干预(Mindin重组蛋白+Integrin β4敲除组)。
所有细胞均在干预6 h后,通过细胞水平的干预在体外水平观察Mindin/Integrin β4蛋白对巨噬细胞的影响。所有实验均独立重复至少3次。
取小鼠肺部组织切片,行苏木素染核,0.5%伊红染料染3~5 min;中性树胶封片。观察小鼠肺组织的形态学变化。肺湿干比:取出左肺上叶后用滤纸吸干组织表面水分,置于锡箔纸上称重,记为湿重;包裹好左肺上叶,放入80°C烤箱内烘烤72 h后,称取每个左肺上叶组织重量,记为干重。湿干比=(湿重-干重)/干重×100%。
取小鼠肺部组织切片,按试剂盒操作步骤说明,按比例加入一抗工作液,封闭内源性过氧化物酶;辣根过氧化物酶标记二抗室温孵育;DAB显色(用之前30 min内按试剂说明书配制);显微镜下观察有浅棕色出现后立即终止反应。自来水轻柔冲洗3 min;染核(苏木素);TBS冲洗3次,每次2 min;1%盐酸酒精分化2 s,氨水返蓝;脱水、透明、封片。检测肺IRI介导的核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)、Gasdermin-D蛋白(GSDMD)及Integrin β4等因子在不同干预组的小鼠肺组织中的表达,并用Image-Pro Plus软件进行定量分析。
采用两步法RT-PCR,首先进行第一链cDNA合成(RT),然后在单个反应管中通过PCR扩增第一步骤中所得cDNA。检测肺IRI介导的IL-1β、IL-18、TNF-α、高迁移速率蛋白B1(HMGB1)等炎症因子在不同干预组小鼠肺组织中的表达。
取不同干预分组细胞用细胞裂解液充分裂解,定量蛋白浓度后,上样等质量蛋白,进行聚丙烯酰胺凝胶电泳。结束后将蛋白质转移至硝酸纤维膜上,5%牛血清白蛋白室温封闭1 h。用小鼠单克隆抗体室温孵育2 h,磷酸盐缓冲液洗涤3次,每次5 min;再用辣根过氧化物酶标记荧光二抗室温孵育1 h,发光液显影。以GAPDH作为内标,用Image J软件分析条带灰度值。检测不同缺氧复氧分组中NLRP3、GSDMD及Integrin β4蛋白的表达,以及不同Mindin重组蛋白分组中NLRP3、GSDMD蛋白的表达。
所有数据以均数±标准差( ±s)表示,并用SPSS 21.0进行统计学分析。两组间比较使用非配对的Student-t检验;而3组或3组以上的不同组间比较采用单因素方差分析,两两比较检验后,进行Post Hoc Tukey检验。P<0.05为差异有统计学意义。
±s)表示,并用SPSS 21.0进行统计学分析。两组间比较使用非配对的Student-t检验;而3组或3组以上的不同组间比较采用单因素方差分析,两两比较检验后,进行Post Hoc Tukey检验。P<0.05为差异有统计学意义。
本研究成功的构建了Mindin基因巨噬细胞特异性敲除小鼠。HE染色结果显示,Surgery(Mindin-/-)组与Surgery组相比,肺泡腔内充血水肿明显减轻,肺泡间隔变薄,肺泡腔缩小(图1)。以Sham组数据为基准,Surgery(Mindin-/-)组肺湿干比、过氧化物酶活性的相对表达量均较Surgery组明显下降,组间比较,差异有统计学意义(P<0.05,表2)。



四组小鼠肺干湿比、过氧化物酶活性及炎症因子水平比较( ±s,n=10)
±s,n=10)
四组小鼠肺干湿比、过氧化物酶活性及炎症因子水平比较( ±s,n=10)
±s,n=10)
| 组别 | 肺湿干比 | 过氧化物酶活性 | IL-1β | IL-18 | TNF-α | HMGB1 |
|---|---|---|---|---|---|---|
| Sham组 | 1.00±0.21 | 1.00±0.09 | 1.00±0.27 | 1.00±0.16 | 1.00±0.38 | 1.00±0.21 |
| Surgery组 | 2.06±0.31a | 5.06±0.11a | 5.81±0.61a | 11.03±0.34a | 4.76±0.20a | 8.76±0.87a |
| Surgery(Mindin-/-)组 | 1.34±0.16b | 2.34±0.27b | 2.73±0.19b | 6.52±0.63b | 2.18±0.14b | 4.57±0.33b |
| Surgery(WT)+Mindin组 | 3.83±0.10b | 7.02±0.19b | 9.32±0.76b | 15.05±0.58b | 7.91±0.96b | 12.31±0.27b |
注:与Sham组比较,aP<0.05;与Surgery组比较,bP<0.05;TNF-α(肿瘤坏死因子α);HMGB1(高迁移速率蛋白B1)
RT-PCR检测结果显示,以Sham组数据为基准,Surgery(Mindin-/-)组与Surgery组比较,前者IL-1β、IL-18、TNF-α、HMGB1因子的相对表达量均较后者下调,组间比较,差异均有统计学意义(P<0.05,表2);而Surgery(WT)+Mindin组中上述炎症因子的相对表达量均较Surgery组上调,组间比较,差异均有统计学意义(P<0.05,表2)。
免疫组织化学染色结果显示,Surgery组与Sham组相比,NLRP3、Integrin β4及GSDMD蛋白的表达均明显上调,组间比较,差异均有统计学意义(P均<0.05,图2,表3)。Surgery(Mindin-/-)组NLRP3、Integrin β4及GSDMD蛋白的相对表达量均较Surgery组明显下调,组间比较,差异均有统计学意义(P均<0.05,图2,表3)。Surgery(WT)+Mindin组中炎症小体NLRP3、Integrin β4及焦亡蛋白GSDMD的相对表达量则均较Surgery组明显上调,组间比较,差异亦均有统计学意义(P均<0.05,图2,表3)。


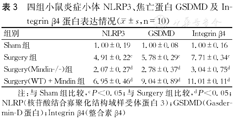
四组小鼠炎症小体NLRP3、焦亡蛋白GSDMD及Integrin β4蛋白表达情况( ±s,n=10)
±s,n=10)
四组小鼠炎症小体NLRP3、焦亡蛋白GSDMD及Integrin β4蛋白表达情况( ±s,n=10)
±s,n=10)
| 组别 | NLRP3 | GSDMD | Integrin β4 |
|---|---|---|---|
| Sham组 | 1.00±0.19 | 1.00±0.08 | 1.00±0.16 |
| Surgery组 | 4.91±0.22c | 5.78±0.29c | 7.71±0.34c |
| Surgery(Mindin-/-)组 | 2.07±0.27d | 2.78±0.37d | 3.04±0.75d |
| Surgery(WT)+Mindin组 | 6.95±0.46d | 9.04±0.89d | 11.01±0.11d |
注:与Sham组比较,cP<0.05;与Surgery组比较,dP<0.05;NLRP(核苷酸结合寡聚化结构域样受体蛋白3);GSDMD(Gasdermin-D蛋白);Integrin β4(整合素β4)
蛋白质印迹法检测结果显示,以缺氧复氧干预组数据为基准,缺氧复氧+Mindin重组蛋白组GSDMD、Integrin β4及NLRP3的相对表达量均较缺氧复氧组上调,组间比较,差异均有统计学意义(P均<0.05,图3,表4)。缺氧复氧+Mindin siRNA组GSDMD、Integrin β4及NLRP3的相对表达量则均较缺氧复氧组下调,组间比较,差异亦均有统计学意义(P均<0.05,图3,表4)。
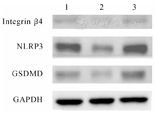

注:1,缺氧复氧干预组;2,缺氧复氧干预+Mindin siRNA组;3,缺氧复氧干预+Mindin重组蛋白组

小鼠巨噬细胞系不同缺氧复氧分组中NLRP3、GSDMD及Integrin β4蛋白的表达情况( ±s)
±s)
小鼠巨噬细胞系不同缺氧复氧分组中NLRP3、GSDMD及Integrin β4蛋白的表达情况( ±s)
±s)
| 组别 | NLRP3 | GSDMD | Integrin β4 |
|---|---|---|---|
| 缺氧复氧干预组 | 1.00±0.36 | 1.00±0.17 | 1.00±0.11 |
| 缺氧复氧干预+Mindin siRNA组 | 0.41±0.06e | 0.34±0.16e | 0.28±0.07e |
| 缺氧复氧干预+Mindin重组蛋白组 | 4.13±0.23e | 6.32±0.46e | 3.53±0.17e |
注:与缺氧复氧干预组比较,eP<0.05;NLRP3(核苷酸结合寡聚化结构域样受体蛋白3);GSDMD(Gasdermin-D蛋白);Integrin β4(整合素β4)
以Mindin重组蛋白组数据为基准,Mindin重组蛋白+Integrin β4敲除组NLRP3、GSDMD蛋白的相对表达量较Mindin重组蛋白组及Mindin重组蛋白+Vehicle组均下调,组间比较,差异均有统计学意义(P均<0.05,图4,表5)。


注:1,Mindin重组蛋白组,2,Mindin重组蛋白+Vehicle组,3,Mindin重组蛋白+Integrin β4敲除组

小鼠巨噬细胞系不同Mindin重组蛋白分组中NLRP3、GSDMD蛋白的表达情况( ±s)
±s)
小鼠巨噬细胞系不同Mindin重组蛋白分组中NLRP3、GSDMD蛋白的表达情况( ±s)
±s)
| 组别 | NLRP3 | GSDMD |
|---|---|---|
| Mindin重组蛋白组 | 1.00±0.07 | 1.00±0.09 |
| Mindin重组蛋白+Vehicle组 | 1.13±0.11 | 0.87±0.16 |
| Mindin重组蛋白+Integrin β4敲除组 | 0.51±0.14f | 0.37±0.12f |
注:与Mindin重组蛋白+Vehicle组比较,fP<0.05;NLRP3(核苷酸结合寡聚化结构域样受体蛋白3);GSDMD(Gasdermin-D蛋白)
Mindin又称Spondin2是一种细胞外基质(extracellular matrix,ECM)最早由Higashijima等于1997年在斑马鱼中发现[3]。Mindin结构含有FS1、FS2和一个含有WSXW模序的TSR结构域,作为一种分泌蛋白可结合到细胞外基质上。属于Mindin-F-spondin家族的分子。在氨基酸水平,小鼠Mindin与大鼠、人类和斑马鱼的Mindin分别有97%、85%和60%的同源性。小鼠Mindin在多个器官都有表达,其中在小鼠肠道、Peyer's淋巴小结、脾脏、肠系膜淋巴结、肺脏以及心肌组织等有丰富表达[4]。Mindin在胚胎神经系统发育、肿瘤的发生发展以及其他器官的急性损伤中也起到了重要作用。在Mindin基因全敲小鼠与肝细胞特异性敲除Mindin基因小鼠中均可以观察到,Mindin基因敲除后小鼠的肝缺血再灌注损伤减轻,并且有可能是通过作用于AKT信号通路发挥作用。研究显示,Mindin能够阻断AKT/GSK3β和TGF-β1-Smad信号通路在心肌重构的过程发挥作用[5]。但Mindin在肺移植缺血再灌注损伤的过程中的作用机制尚不清楚。
整合素Integrin是由2个亚单位α(120~185 kD)和β(90~110 kD)组成的异二聚体跨膜糖蛋白。迄今已发现约18种α亚单位和8种β亚单位,它们按组合不同,构成20余种功能不同的Integrin分子。Integrin在正常组织或细胞中可以介导细胞与ECM以及细胞与细胞之间的黏附。Integrin在肿瘤细胞中表现为异常的高表达或出现新的Integrin表达。这些异常表达的Integrin通过内外信号转导通路,一方面影响肿瘤细胞与基质的黏附从而使得细胞更具有侵袭性,另一方面Integrin与其配体结合后向细胞内传递信号介导FAK/Ras/MAPK、FAK/PI3K、FAK/STAT等通路,最后影响肿瘤细胞ERK、AKT等基因的表达,进而影响肿瘤细胞的增殖、基因转导、凋亡等生物学行为[6]。研究显示,Integrin αvβ5过调控肺血管通透性以及肺血管内皮细胞屏障作用,通过特异性中和抗体减轻肺IRI损伤及呼吸机带来的急性肺损伤(acute lung injury,ALI)中均能够减轻肺损伤[7]。在呼吸机介导的ALI中,Integrin-β4能够介导血管免疫炎症反应,应用他汀类药物可能通过作用于Integrin β4减轻机械性ALI[8]。
本研究首先在小鼠体内通过构建Mindin巨噬细胞内特异性敲除,结果发现基因敲除后肺损伤减轻,重组蛋白干预后肺损伤加重,且敲除Mindin基因后,肺组织中细胞焦亡蛋白及炎症小体NLRP3、Integrin β4的表达减少。本课题组前期研究证实,NLRP3炎症小体激活能够诱导巨噬细胞焦亡[9,10]。本实验中Integrin β4基因敲除后,巨噬细胞缺氧复氧模型中Mindin诱导的焦亡蛋白GSDMD及炎症小体NLRP3表达减少,说明Integrin β4在Mindin诱导的下游通路激活中起到了关键的开关作用。Mindin可能通过与Integrin β4的结合促进炎症小体NLRP3及焦亡蛋白GSDMD蛋白的表达。因此,我们分析Mindin可能通过与Integrin β4结合诱导巨噬细胞焦亡进而加重肺IRI。
Mindin在巨噬细胞中的其他相关作用也有报道。有研究发现,Mindin与整合素Mac-1结合能够激活Syk与NFKB p65入核增强巨噬细胞的吞噬作用[11]。在动脉粥样硬化模型中,在巨噬细胞内特异性敲除Mindin基因能够通过靶向调控LXR-β减少泡沫细胞的形成以及动脉粥样硬化的形成[12]。本课题组前期研究也证实,在LPS介导的ALI模型中,NLRP3激活后可以通过NFκB P65核转录因子的核转位方式诱导细胞焦亡[10]。本次研究中,我们在体外缺氧复氧干预的基础上,观察Mindin重组蛋白干预及巨噬细胞中Mindin基因敲除后,对炎症小体NLRP3、焦亡蛋白GSDMD蛋白以及炎症因子表达的影响。结果显示,过表达Mindin对上述指标有促进作用,基因敲除对上述指标呈抑制作用。同时,Mindin可通过激活非受体酪氨酸激酶Syk驱动Caspase-8/NLRP3炎症小体的活化[13,14]。结合前期研究,我们认为,Mindin-Integrin β4激活后可能通过促进NLRP3介导的巨噬细胞焦亡以及免疫炎症反应,加重肺缺血再灌注损伤。但本研究也存在一定局限性,我们对于Mindin蛋白的来源未给予充足的讨论分析,同时Mindin-Integrin β4激活后如何诱导细胞焦亡的详细机制还有待进一步研究。
综上所述,本研究通过构建巨噬细胞内Mindin基因特异性敲除小鼠,在肺IRI模型中观察到Mindin基因敲除能够抑制炎症小体NLRP3、焦亡蛋白GSDMD及Integrin β4的表达,并最终减轻肺IRI;并且Mindin基因的这种作用可能是通过与整合素Integrin β4结合来实现的。
所有作者声明无利益冲突



























