
探究肝移植术中计划性应用体外膜氧合(ECMO)的可行性及优势。
回顾性分析2017年11月至2021年7月吉林大学第一医院收治的3例ECMO辅助下肝移植受者的临床资料。3例受者术前均出现不同程度乏力、胸闷、心悸等右心功能不全表现。1例因受者拒绝,术前未行右心导管检查,另2例受者经胸多普勒超声心动图(TDE)筛查,右心导管检查分别确诊为门脉性肺动脉高压和毛细血管后性肺动脉高压。
3例合并肺动脉高压受者均在患肝游离后即下腔静脉阻断前,于右侧股动脉及股静脉置管,行动脉-静脉ECMO支持,根据全血凝血时间调整肝素用量,围手术期生命体征平稳。3例受者呼吸机支持时间分别为54、12、62 h,ECMO支持时间分别为27、61、14 h,均顺利出院,随访时间为26(9~52)个月,肝功能正常。
合并肺动脉高压的终末期肝病患者肝移植术前等待期间应常规行TDE检查,提示肺动脉压高压患者,应进一步行右心导管检查明确诊断及疾病严重程度分级。经多学科会诊有计划的应用ECMO,可扩大肝移植的手术适应证,维持术中血流动力学稳定,对肝移植手术的顺利进行和受者术后康复均起到重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
体外膜氧合(extracorporeal membrane oxygenation,ECMO)是常规心肺复苏及常规支持技术失败时的一种新型心肺支持技术,以挽救患者生命。在器官移植领域,ECMO多用于术前供者器官维护和作为术后受者出现呼吸循环衰竭时的急救措施[1,2,3]。近年来,也有少量在器官移植手术过程中,通过ECMO治疗受者突发的心肺功能衰竭的报道[4,5]。肝移植受者普遍存在不同程度的凝血功能障碍,而维持ECMO运行需要抗凝治疗,可能增加围手术期出血风险,限制了ECMO在肝移植术中的应用。吉林大学第一医院经多学科会诊完成了3例ECMO辅助下肝移植手术,保证了受者围手术期的氧合和血流动力学稳定,现将临床资料进行回顾性分析,总结如下。
例1 女性,44岁。2010年诊断为乙型肝炎后肝硬化。2017年10月入院完善肝移植术前评估,主诉为乏力伴腹胀6个月。既往无心血管病史,2010年行脾切断流术。天冬氨酸转氨酶(AST)45.2 U/L,白蛋白28.4 g/L,总胆红素(TBil)181.0 μmol/L,凝血酶原时间(PT)27.0 s,氧分压(PO2)65 mmHg,氧饱和度(SaO2)93%。计算终末期肝病模型(MELD)评分为24分,Child-Pugh C级。经胸多普勒超声心动图(TDE)提示二尖瓣反流面积10.2 cm2,三尖瓣反流面积5.8 cm2,肺动脉收缩压(sPAP)53 mmHg,诊断为重度二尖瓣、三尖瓣反流和肺动脉高压。受者拒绝行右心导管检查。多学科会诊考虑导致受者肺动脉高压原因为心功能不全和(或)门脉性肺动脉高压。麻醉及外科手术有诱发心力衰竭的风险,建议肝移植手术过程中可先行ECMO,术后可带ECMO返回重症监护病房,若心肺功能稳定,可早期撤离ECMO。
例2 女性,56岁。2019年9月诊断为原发性胆汁性肝硬化。2020年1月入院完善肝移植术前评估时体力活动后呼吸困难。既往无心血管病史,有上消化道出血史。白蛋白34.9 g/L,TBil 24.1 μmol/L,PT 12.6 s,PO2 80 mmHg,SaO2 96%。计算MELD评分为5分,Child-Pugh B级。TDE测量sPAP 96 mmHg,遂进一步行右心导管检查提示:肺动脉压(PAP)81/25 mmHg,平均肺动脉压(mPAP)44 mmHg,肺血管阻力(PVR)16.8 Wood,诊断为中度门脉性肺动脉高压。为降低其肺动脉压力,予以安立生坦(5 mg/d)及他达拉非(40 mg/d)联合治疗。2020年6月再次入院复查右心导管检查提示:PAP 54/20 mmHg,mPAP 30 mmHg,PVR 7.4 Wood。多学科会诊后拟定肝移植手术方案为:麻醉后行Swan-Ganz漂浮导管植入,动态监测肺动脉压力;持续静脉泵入曲前列尼尔控制肺动脉压,并在肝脏离体行ECMO支持。
例3 男性,58岁。2019年9月诊断为乙型肝炎后肝硬化。2020年10月入院行内科治疗并完善肝移植术前评估,入院时喘息明显,日常活动后呼吸困难。既往无风湿热史,1994年发现主动脉瓣发育畸形。白蛋白26.5 g/L,TBIL 72.0 μmol/L,PT 16.7 s,PO2 86 mmHg,SaO297%。计算MELD评分为16分,Child-Pugh C级。TDE测量sPAP 75 mmHg,并提示主动脉瓣重度关闭不全考虑主动脉瓣发育异常,进一步行右心导管检查提示:PAP 74/34 mmHg,mPAP 43 mmHg,PVR 0.9 Wood,诊断为主动脉瓣重度关闭不全、毛细血管后性肺动脉高压。心脏外科医师考虑受者肝硬化失代偿期,为开胸心脏瓣膜手术禁忌证,而经导管主动脉瓣置入术费用高昂,与家属沟通后决定先行肝移植术。
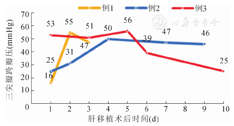
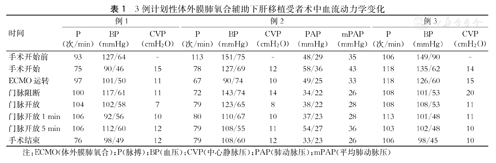
3例受者均在病肝游离后即下腔静脉阻断前留置股动、静脉导管,留置导管后随即开始采用静脉-动脉(V-A)模式开始运转ECMO,抗凝并监测全血凝血时间(ACT),ECMO运行期间ACT维持在180~200 s。3例受者术中血流动力学变化见表1,术后TDE监测三尖瓣跨瓣压(PG)变化见图1。

3例计划性体外膜肺氧合辅助下肝移植受者术中血流动力学变化
3例计划性体外膜肺氧合辅助下肝移植受者术中血流动力学变化
| 时间 | 例1 | 例2 | 例3 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| P(次/min) | BP(mmHg) | CVP(cmH2O) | P(次/min) | BP(mmHg) | CVP(cmH2O) | PAP(mmHg) | mPAP(mmHg) | P(次/min) | BP(mmHg) | CVP(cmH2O) | |
| 手术开始前 | 93 | 127/64 | - | 113 | 151/75 | - | 48/29 | 35 | 106 | 149/90 | - |
| 手术开始 | 75 | 90/46 | 15 | 78 | 127/69 | 12 | 58/36 | 43 | 118 | 135/62 | 14 |
| ECMO运转 | 97 | 101/50 | 11 | 67 | 90/74 | 10 | 49/25 | 33 | 118 | 126/60 | 15 |
| 门脉阻断 | 100 | 117/61 | 11 | 72 | 143/74 | 14 | 34/22 | 26 | 108 | 101/53 | 20 |
| 门脉开放 | 104 | 102/58 | 7 | 79 | 123/65 | 8 | 38/22 | 28 | 108 | 108/53 | 11 |
| 门脉开放1 min | 106 | 92/56 | 10 | 80 | 110/67 | 10 | 37/23 | 28 | 113 | 101/48 | 11 |
| 门脉开放5 min | 106 | 112/60 | 12 | 79 | 108/55 | 11 | 54/27 | 36 | 103 | 102/48 | 10 |
| 手术结束 | 76 | 98/49 | 12 | 79 | 108/60 | 12 | 33/23 | 26 | 106 | 98/45 | 10 |
注:ECMO(体外膜肺氧合);P(脉搏);BP(血压);CVP(中心静脉压);PAP(肺动脉压);mPAP(平均肺动脉压)
例1于2017年11月15日行原位肝移植术,ECMO转速2 000转/min,流量1.6 L/min。术中出血约1 250 ml,尿量1 600 ml,手术时间617 min。受者于术后54 h脱离呼吸机,并于术后27 h撤除ECMO。出院后未行肺动脉高压靶向治疗,随访中sPAP呈下降趋势,肝功能正常。2020年8月25日复查TDE时PG 24 mmHg。
例2于2020年8月25日行原位肝移植术,ECMO转速2 000转/min,流量1.6升/min。持续静脉泵入曲前列尼尔0.05~0.45 μg·kg-1·min-1控制肺动脉压。术中出血约1 500 ml,尿量900 ml,手术时间490 min。受者于术后12 h脱离呼吸机,术后61 h撤除ECMO,并于术后16 d停用曲前列尼尔。目前受者随访中,口服安立生坦5 mg/d,随访期间PG维持在20~35 mmHg,肝功能正常。
例3于2021年6月4日行原位肝移植术,ECMO转速2200转/min,流量1.6 L/min。术中出血约2 500 ml,尿量900 ml,手术时间505 min。受者术后62 h脱离呼吸机,术后14 h撤除ECMO。出院后未行肺动脉高压靶向治疗。目前受者随访期间PG维持在25~56 mmHg,尚未行主动瓣膜置换术,肝功能正常。
目前肝移植受者普遍高龄化,疾病的严重程度日益增高,心血管并发症也呈逐步增多趋势,这进一步推动了肝移植禁忌证的不断缩小[6,7]。本研究通过总结3例肺动脉高压受者的诊疗过程,为治疗合并严重心血管疾病的终末期肝病受者,拓展肝移植的手术适应证提供了新的方法与思路。
心血管并发症是肝移植围手术期非移植物相关死亡率的主原因[7]。据报道[6],有5%~10%的肝移植受者合并肺动脉高压。导致终末期肝病受者合并肺动脉高压的因素较为复杂,主要为以下两点:门脉性肺动脉高压引起的肺血管阻力增加、肺血管容量增加以及高动力循环状态均可直接导致肺动脉压力升高;左心疾病如肝硬化性心肌病、心脏瓣膜病可导致肺静脉压力升高,从而间接升高肺动脉压力。这些因素既可独立发生,也可共同存在[8]。右心导管检查提供的血流动力学参数有助于不同类型间肺动脉高压的鉴别诊断。但由于其有创性未能在肝移植受者中广泛开展[9,10]。TDE是评估心脏功能和血流动力学可靠且可重复的方法,通过测定三尖瓣反流峰值从而估测sPAP,并可结合右心室扩大、肺动脉增宽、肺血流异常或反流等征象综合评估筛查肺动脉高压[10]。
目前对于门脉性肺动脉高压患者行肝移植的禁忌证普遍达成以下共识:(1)mPAP≥45 mmHg为进行肝移植的绝对禁忌证;(2)35 mmHg<mPAP≤45 mmHg且受者对药物治疗反应欠佳为进行肝移植的相对禁忌证;(3)mPAP<35 mmHg时,肝移植围手术期死亡率未见增加[11]。而毛细血管后性肺动脉高压患者行肝移植,目前尚无治疗指南或专家共识[12]。
ECMO是维持受者围手术期血流动力学的有效措施,但目前对ECMO的应用多集中在术前对供者器官的保护[1,2],以及术后受者出现急性呼吸循环衰竭时作为急救或桥接措施[3],对于肝移植术中联合ECMO治疗的经验仍较少。
尽管国内外已有大量报道[8,10,13,14],门脉性肺动脉高压患者可通过术前肺动脉靶向治疗,术中吸入NO和静脉应用米力农,前列腺素类药物等,优化肺血流动力学完成肝移植,但内科治疗不能使全部受者受益[6]。部分受者如例2,经内科治疗后仍存在肺动脉高压、肺循环高阻力及右心功能不全等复杂情况;例3由于受者肝硬化失代偿期,无法耐受心脏瓣膜手术,且由于重度主动脉瓣关闭不全,无法耐受肝移植手术,形成恶性循环。肺动脉高压患者在移植物血流开放瞬间心脏负荷骤增,以及再灌注综合征的发生等原因均易诱发急性心力衰竭,危及生命[9,15]。因而针对此类情况,本中心通过术前行多学科会诊决定在受者患肝游离后即下腔静脉阻断前预置并运转ECMO机器,从而避免患肝切除过程中凝血崩溃的风险。3例受者均顺利完成手术,术后12~62 h成功脱离呼吸机,14~61 h顺利撤除ECMO,目前于本中心规律随访。故本研究表明,术中有计划地联合ECMO治疗可为更多的肺动脉高压患者提供肝移植的机会,并有助于保证围手术期血流动力学稳定。
本中心计划性体外膜肺氧合辅助下肝移植的经验总结如下:(1)对拟行肝移植术的受者,应在术前准备期间常规进行TDE检查。如TDE提示肺动脉高压的受者,应进一步行右心导管检查明确诊断及疾病严重程度分级。(2)肺动脉高压患者行肝移植风险较高,术前应进行多学科会诊,充分讨论,拟定完善的围手术期管理方案。(3)计划性应用ECMO可适用于未经肺动脉靶向治疗或治疗后高PVR的门脉性肺动脉高压患者,以及合并严重瓣膜病受者。其优势是能在血管阻断及开放时保证受者的氧合,改善脏器血液灌注,维持血流动力学稳定,防止术中出现严重的心肺并发症。对于合并严重瓣膜病受者,ECMO增加左心后负荷,术前与受者及家属积极沟通,若无严重心肺并发症发生,可尽早撤除。(4)ECMO运转期间,维持ACT水平180~200 s时,凝血功能水平不会增加出血量。(5)术后12 h,可尝试下调ECMO参数,若下调后生命体征平稳、尿量尚可以及氧合指数大于250 mmHg,可尝试撤除ECMO。门脉性肺动脉高压受者,若左心功能未见明显异常,由于其高PVR,氧合较差,可适当延长ECMO辅助时间。
ECMO在肝移植领域的应用,且更进一步在合并肺动脉高压的重症受者肝移植术中的应用,必将越加深入和广泛。
所有作者声明不存在利益冲突



























