
探讨术后非人类白细胞抗原(HLA)抗体与肾移植体液性排斥反应(HR)的相关性。
回顾性分析上海交通大学医学院附属仁济医院2019年9月至2021年1月检测了非HLA抗体水平的40例肾移植受者资料,选取活检证实发生HR,并且发生HR时供者特异性HLA抗体阴性或者弱阳的受者入组HR组(11例),选取术后2周至检测非HLA抗体时移植肾功能稳定的受者入组稳定组(29例)。采用Luminex单抗原微珠法检测HLA抗体、MHCⅠ类链相关基因A(MICA)抗体、32种非HLA抗体的水平,采用酶联免疫吸附试验(ELISA)检测血管紧张素Ⅱ1型受体(AT1R)抗体水平。分析两组受者非HLA抗体阳性率和阳性非HLA抗体数量的差异。
24例受者具有阳性非HLA抗体,剩余16例受者的非HLA抗体全为阴性。HR组分别有3例受者的肌动蛋白(ACTIN)抗体、Ⅲ型胶原蛋白(Collagen Ⅲ)抗体、谷胱甘肽硫转移酶θ1(GSTT1)抗体和γ干扰素(IFN-γ)抗体阳性,而稳定受者的这4种非HLA抗体都是阴性,两组比较,差异有统计学意义(P=0.017)。4例HR受者的Collagen Ⅱ抗体阳性,而仅1例稳定受者的Collagen Ⅱ抗体阳性,HR受者的Collagen Ⅱ抗体阳性率高于稳定受者(P=0.023)。HR受者的平均阳性非HLA抗体数为2.36个,而稳定受者为0.90个,两组之间的差异有统计学意义(P=0.008)。
高水平非HLA抗体增加肾移植HR的发生风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
体液性排斥反应(HR)是肾移植后移植物长期存活的主要障碍。尽管肾移植前供、受者交叉配型的应用降低了HR的发生率,但是肾移植后1年内HR的发生率仍然高达16.2%[1]。在临床移植工作中,与HR相关的主要靶点,迄今为止的重点一直是多态性的HLA抗原[2]。然而,在HLA全相合的兄弟姐妹间肾移植后,HR的发生表明非HLA抗体在同种免疫中的重要性[3]。
非HLA抗体包括次要组织相容性抗原抗体(如MHCⅠ类链相关基因A(MICA)抗体、GSTT1抗体等)和自身组织抗原抗体(如AT1R抗体、蛋白激酶C ζ抗体、波形蛋白抗体等)[4]。越来越多的研究表明,非HLA抗体可以在实体器官移植中引发HR,并影响移植物的长期存活率[1,5,6,7]。本研究通过检测肾移植后肾功能稳定受者和HR受者的非HLA抗体水平,探究与肾移植HR相关的非HLA抗体。
回顾性研究上海交通大学医学院附属仁济医院2019年9月至2021年1月检测了非HLA抗体水平的肾移植受者资料。选取11例活检证实发生HR,并且供者特异性HLA抗体阴性或者弱阳(中位荧光强度<4 000)的受者入组HR组。选取29例术后2周至检测非HLA抗体时肌酐水平稳定(男性不超过150 μmol/L,女性不超过130 μmol/L)且尿蛋白阴性的受者入组稳定组。排除术前具有心、肺、肝脏等严重伴发疾病、术前补体依赖性淋巴细胞毒试验>5%、ABO血型不相容肾移植、围手术期出现移植肾血管并发症、供肾异常(畸形、结石、原发性肾病、灌注不良)的受者。
术中均使用甲泼尼龙联合抗胸腺细胞免疫球蛋白(ATG)或者巴利昔单抗进行免疫诱导治疗。甲泼尼龙静脉输注,术中使用10 mg/kg,术后6 d内的用量依次为10 mg·kg-1·d-1、10 mg·kg-1·d-1、1.5 mg·kg-1·d-1、1.5 mg·kg-1·d-1、1 mg·kg-1·d-1、1 mg·kg-1·d-1。ATG术后1~3 d静脉输注1 mg·kg-1·d-1。巴利昔单抗在移植术中和术后第4天各静脉输注20 mg。术后免疫抑制方案为他克莫司或者环孢素A+霉酚酸酯+泼尼松。他克莫司每天口服两次,起始用量为0.1 mg·kg-1·d-1,其后根据血他克莫司浓度调整用量,术后0~3个月维持在6~8 μg/L,术后4个月后为4~6 μg/L。环孢素A口服,初始剂量为6~8 mg·kg-1·d-1,其后根据血环孢素A浓度调整用量,术后0~3个月维持在150~300 μg/L,术后3~12个月维持在100~250 μg/L,术后1年以上大于50 μg/L。霉酚酸酯每天口服两次,剂量为2 g/d。停止静脉输注甲泼尼龙后开始口服泼尼松,起始用量为20 mg/d,术后2个月后逐渐递减至5 mg/d。
利用Immucor公司的LIFECODES Life Screen Deluxe Kit检测群体反应性抗体(PRA)水平。采用Luminex单抗原微珠法检测HLA抗体、MICA抗体水平。采用Celltrend公司ELISA检测试剂盒检测AT1R水平,超过17 U·mL-1判断为阳性。利用Immucor公司的基于Luminex单抗原微珠法的LIFECODES Non-HLA Antibody Kit检测32种非HLA抗体水平,每种抗体以稳定受者的平均中位荧光强度加上中位荧光强度标准偏差的3倍的作为阈值。
经过移植肾穿刺活检,按照Banff 2019标准诊断HR。
采用IBM SPSS Statistics 22统计软件进行数据处理,计量资料用(Mean±SD)表示。计量资料比较采用t检验或者Mann-Whitney U检验,无序计数资料比较采用χ2检验或者Fisher确切概率检验,有序计数资料比较采用Mann-Whitney U检验,以P<0.05为差异有统计学意义。
纳入11例活检证实的HR受者和29例移植肾功能稳定的受者。稳定组和HR组年龄分别为(42.5±13.9)岁和(42.3±12.6)岁(P=0.945),体重指数分别为(21.4±4.0)kg/m2和(42.3±12.6)kg/m2(P=0.097),HLA-A、B、C、DR、DQ不匹配数量分别为(7.8±2.5)个和(6.4±2.8)个(P=0.199),差异无统计学意义,另HR组与稳定组受者在性别、原发病、透析类型、透析持续时间、免疫诱导方案、免疫抑制维持方案等方面的差异均无统计学意义(表1),相应的供者类型、性别、年龄,以及供肾冷缺血时间等方面的差异也无统计学意义(表1)。
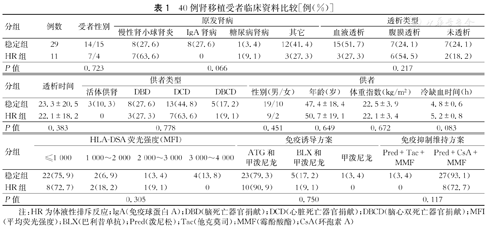
40例肾移植受者临床资料比较[例(%)]
40例肾移植受者临床资料比较[例(%)]
| 分组 | 例数 | 受者性别 | 原发肾病 | 透析类型 | |||||
|---|---|---|---|---|---|---|---|---|---|
| 慢性肾小球肾炎 | IgA肾病 | 糖尿病肾病 | 其它 | 血液透析 | 腹膜透析 | 未透析 | |||
| 稳定组 | 29 | 14/15 | 8(27.6) | 8(27.6) | 1(3.4) | 12(41.4) | 15(51.7) | 7(24.1) | 7(24.1) |
| HR组 | 11 | 7/4 | 7(63.6) | 0 | 1(9.1) | 3(27.3) | 3(27.3) | 6(54.5) | 2(18.2) |
| P值 | 0.723 | 0.066 | 0.217 | ||||||
| 分组 | 透析时间 | 供者类型 | 供者 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 活体供肾 | DBD | DCD | DBCD | 性别(男/女) | 年龄(岁) | 体重指数(kg/m2) | 冷缺血时间(h) | ||
| 稳定组 | 23.3±20.5 | 3(10.3) | 8(27.6) | 13(44.8) | 5(17.2) | 19/10 | 47.4±18.4 | 22.5±3.9 | 4.8±0.6 |
| HR组 | 22.1±18.2 | 0 | 3(27.3) | 7(63.6) | 1(9.1) | 9/2 | 50.7±19.1 | 22.1±3.4 | 5.2±0.8 |
| P值 | 0.383 | 0.778 | 0.451 | 0.649 | 0.672 | 0.083 | |||
| 分组 | HLA-DSA荧光强度(MFI) | 免疫诱导方案 | 免疫抑制维持方案 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| ≤1 000 | 1 000~2 000 | 2 000~3 000 | 3 000~4 000 | ATG和甲泼尼龙 | BLX和甲泼尼龙 | 甲泼尼龙 | Pred+Tac+MMF | Pred+CsA+MMF | |
| 稳定组 | 22(75.9) | 2(6.9) | 1(3.4) | 4(13.8) | 23(79.3) | 5(17.2) | 1(3.4) | 1(3.4) | 27(93.1) |
| HR组 | 8(72.7) | 2(18.2) | 1(9.1) | 0 | 10(90.9) | 1(9.1) | 0 | 0 | 8(72.7) |
| P值 | 0.305 | 0.750 | 0.117 | ||||||
注:HR为体液性排斥反应;IgA(免疫球蛋白A);DBD(脑死亡器官捐献);DCD(心脏死亡器官捐献);DBCD(脑心双死亡器官捐献);MFI(平均荧光强度);BLX(巴利昔单抗);Pred(泼尼松);Tac(他克莫司);MMF(霉酚酸酯);CsA(环孢素A)
HR组3例受者在肾移植后20 d内确诊HR,另外8例受者在移植5个月后至3年内经穿刺活检证实发生慢性HR,在活检证实HR前后检测HLA抗体和非HLA抗体水平,检测非HLA抗体的中位时间为肾移植后201 d。稳定组受者在肾移植4个月后至5年内检测非HLA抗体水平,中位时间为术后231 d。
稳定组29例受者中有3例(27.3%)的MICA抗体阳性,而HR组受者的MICA抗体都是阴性。40例受者中除HR组1例受者的ATIR抗体为阳性外,其余39例受者的ATIR抗体均为阴性。其余32种非HLA抗体的检测结果见图1。
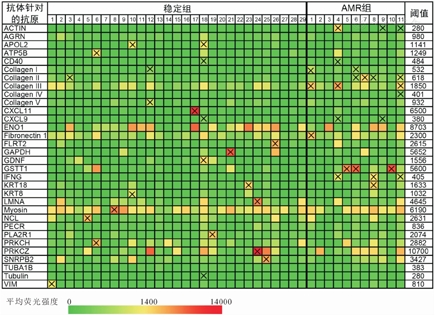

24例受者至少具有1种阳性非HLA抗体,而16例受者的非HLA抗体全为阴性(图1),分析表1中的影响因素对非HLA抗体产生的影响,未发现差异有统计学意义的影响因素。
χ2检验或者Fisher确切概率检验发现ACTIN抗体、Collagen Ⅱ抗体、Collagen Ⅲ抗体、GSTT1抗体和IFN-γ抗体都与HR相关(表2)。HR组分别有3例受者ACTIN抗体、Collagen Ⅲ抗体和IFN-γ抗体阳性并且供者特异性HLA抗体阴性,而稳定组受者的这3种非HLA抗体都是阴性。在3例GSTT1抗体阳性的HR受者中,1例受者具有供者特异性HLA抗体(HLA-DR16抗体的中位荧光值为1 006,HLA-DR103抗体的中位荧光值为1 165),另外2例GSTT1抗体阳性受者的供者特异性HLA抗体为阴性。1例Collagen Ⅱ抗体阳性的HR受者AT1R抗体阳性,在移植后第17天确诊HR,3例Collagen Ⅱ抗体阳性的受者在移植后250 d才出现移植肾功能障碍。Collagen Ⅱ抗体阳性的稳定受者只随访到移植后第164天,可能Collagen Ⅱ抗体需要更长的时间才能影响的移植肾功能。
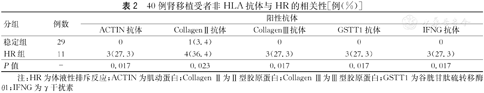
40例肾移植受者非HLA抗体与HR的相关性[例(%)]
40例肾移植受者非HLA抗体与HR的相关性[例(%)]
| 分组 | 例数 | 阳性抗体 | ||||
|---|---|---|---|---|---|---|
| ACTIN抗体 | CollagenⅡ抗体 | CollagenⅢ抗体 | GSTT1抗体 | IFNG抗体 | ||
| 稳定组 | 29 | 0 | 1(3.4) | 0 | 0 | 0 |
| HR组 | 11 | 3(27.3) | 4(36.4) | 3(27.3) | 3(27.3) | 3(27.3) |
| P值 | - | 0.017 | 0.023 | 0.017 | 0.017 | 0.017 |
注:HR为体液性排斥反应;ACTIN为肌动蛋白;Collagen Ⅱ为Ⅱ型胶原蛋白;Collagen Ⅲ为Ⅲ型胶原蛋白;GSTT1为谷胱甘肽硫转移酶θ1;IFNG为γ干扰素
1例HR受者ACTIN抗体阳性且供者特异性HLA抗体弱阳,在术后20 d内发生急性HR,而另外2例ACTIN抗体阳性但是供者特异性HLA抗体阴性的HR受者在肾移植5个月后发生慢性HR。GSTT1抗体阳性受者具有相同的情况。1例GSTT1抗体阳性且供者特异性HLA抗体弱阳的受者发生急性HR,而另外2例GSTT1抗体水平更高但是供者特异性HLA抗体阴性的受者发生慢性HR。此外,1例供者特异性HLA抗体弱阳而非HLA抗体阴性的HR受者发生慢性HR。这表明非HLA抗体很可能与供者特异性HLA抗体具有协同作用。
为了确定HR受者血清中阳性非HLA抗体的数量是否增加,对每例受者术后的阳性非HLA抗体数量进行统计分析。稳定组受者平均具有0.90个阳性非HLA抗体,而HR受者平均具有2.36个阳性非HLA抗体(表3)。与稳定组受者相比,HR受者血清中的阳性非HLA抗体数量增加,差异有统计学意义(P=0.008,表3)。
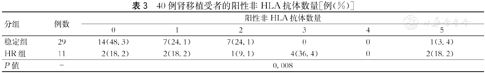
40例肾移植受者的阳性非HLA抗体数量[例(%)]
40例肾移植受者的阳性非HLA抗体数量[例(%)]
| 分组 | 例数 | 阳性非HLA抗体数量 | |||||
|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | ||
| 稳定组 | 29 | 14(48.3) | 7(24.1) | 7(24.1) | 0 | 0 | 1(3.4) |
| HR组 | 11 | 2(18.2) | 2(18.2) | 1(9.1) | 4(36.4) | 0 | 2(18.2) |
| P值 | - | 0.008 | |||||
越来越多的证据支持非HLA抗体在肾移植HR的重要性,并且非HLA抗体阻碍移植肾的长期存活。Senev等[8]发现在59.1%(123/208)的活检证实的HR受者体内,供者特异性HLA抗体并不存在。AT1R阳性肾移植受者的HR发生率和移植肾功能丧失发生率均高于该抗体阴性肾移植受者[1]。Rampersad等[9]报道了1例与波形蛋白抗体相关的早期HR肾移植受者。大样本队列研究发现移植前预存高浓度Rho鸟苷二磷酸解离抑制蛋白β抗体显著降低移植肾的存活率[10,11]。Catar等[12]提供了非HLA抗体在同种免疫反应中的重要性的进一步证据,他们用体外实验证明肾移植受者的AT1R和内皮素-1 A型受体抗体通过激活磷脂酰肌醇3-激酶(PI3K)-Akt激酶信号通路阻碍内皮细胞损伤修复。因此,非HLA抗体在肾移植中的作用应该得到更进一步的重视。本研究发现HR受者的ACTIN抗体、Collagen Ⅱ抗体、Collagen Ⅲ抗体、GSTT1抗体或者IFN-γ抗体的阳性率增加(表2),并且HR受者的阳性非HLA抗体数量多于稳定受者。
GSTT1主要在肝、肾中表达。有些人缺失GSTT1基因,缺失GSTT1基因的受者移植了具有该基因的供者的肾脏或者肝脏,则会产生GSTT1抗体[13]。Alvarez-Márquez等[13]发现3例肾移植后供者特异性HLA抗体、MICA抗体阴性,GSTT1抗体阳性的受者发生慢性HR,并且肾移植后C4d阳性受者GSTT1抗体阳性率(6/19,31.6%)高于C4d阴性受(3/39,7.7%)。Akgul等[14]报道肾移植后发生排斥事件受者的GSTT1抗体阳性率(8/19,42.1%)高于移植物功能稳定的受者(4/27,14.8%),41.7%(5/12)GSTT1抗体阳性的肾移植受者发生了急性排斥事件。本研究也证明高浓度GSTT1抗体与肾移植HR的相关(表2)。
Alvarez-Márquez等[15]发现心脏移植后内皮细胞细胞骨架抗体的阳性率逐渐增加,这些抗体(包括波形蛋白、ACTIN、微管蛋白、角蛋白18和角蛋白8抗体)的存在与排斥反应密切相关,并先于排斥反应发生。Butler等[16]也发现ACTIN抗体是心脏移植排斥反应的危险因素。本研究则发现ACTIN抗体在肾移植中与HR相关(表2)。
本研究表明Collagen Ⅱ抗体和Collagen Ⅲ抗体都与移植HR的发生显著相关(表2),此前也有研究发现Collagen Ⅱ抗体抗体和Collagen Ⅲ抗体与肾移植后3个月内的急性微血管排斥反应相关[17]。此外,Senev[18]等发现术前预存Collagen Ⅲ抗体是肾移植病理型HR的独立危险因素。
Sigdel等[19]发现肾移植后第1 d的IFN-γ抗体水平可以预测肾移植受者术后第6个月和24个月时的慢性移植物损伤,也有研究发现IFN-γ抗体与肾移植后3个月内的急性微血管排斥反应相关[17]。本研究发现IFN-γ抗体阳性与肾移植HR的发生相关(表2),然而3例IFN-γ抗体阳性的HR受者同时具有其它与HR相关的非HLA抗体(图1),IFN-γ抗体单独对肾移植HR的影响需要进一步研究。
本研究发现与稳定肾移植受者相比,HR肾移植受者的阳性非HLA抗体数量增加,心脏移植受者具有相同的现象[16]。这表明不同非HLA抗体对移植器官的影响具有协同作用。
GSTT1抗体是由基因多态性造成的[13],因而属于次要组织相融性抗原抗体。ACTIN抗体、Collagen Ⅱ抗体、Collagen Ⅲ抗体和IFN-γ抗体被认为是自身抗原抗体[15,17,19]。器官移植中自身抗原抗体的产生依赖于多种因素。缺血再灌注损伤、同种异体免疫反应、长期血液透析以及慢性炎症均可能导致新的或隐藏的抗原决定簇暴露出来,为自体免疫反应的发生创造条件[20,21]。
本研究发现在HLA抗体阴性或者弱阳时,ACTIN抗体、Collagen Ⅱ抗体、Collagen Ⅲ抗体、GSTT1抗体或者IFN-γ抗体阳性会增加移植肾发生HR的风险,并且HR受者血清中的阳性非HLA抗体数量高于稳定受者。高水平非HLA抗体很可能增加肾移植HR的发生风险,应引起临床上的密切关注。本研究的病例数量较少,尚需要大样本研究证实这些抗体是否是肾移植HR的危险因素。
所有作者均声明不存在利益冲突,其中作者贺俊波属于北京博富瑞基因诊断技术有限公司,该公司专门从事移植医学相关的临床检测、诊断,贺俊波主要从事数据整理



























