
探讨核因子E2相关因子2(Nrf2)/转化生长因子-β(TGF-β)通路在失神经支配肾脏缺血再灌注损伤(IRI)导致的肾小管间质纤维化(TIF)中的作用及机制。
成年雄性C57BL/6小鼠随机分为4组(均n=12):假手术组(Sham组)、肾脏缺血再灌注组(IR组)、失神经假手术组(RDN组)和失神经肾脏缺血再灌注组(DIR组)。分别于造模后1 d或7 d取材,利用苏木精伊红(HE)染色法观察肾脏病理学改变、马松染色法观察TIF程度及免疫组化观察α-平滑肌肌动蛋白(α-SMA)表达,检测血尿素氮、肌酐和中性粒细胞明胶酶相关载脂蛋白(NGAL)、肾组织超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、白细胞介素-4、10、13(IL-4、IL-10、IL-13)水平,蛋白印迹法检测Nrf2、TGF-β和磷酸化母亲DPP同源物3(果蝇)(Smad3)蛋白表达。
与Sham组比较,再灌注1 d组(IR-1)和DIR-1组肾脏病理损伤、血清尿素氮、肌酐和NGAL水平、肾组织MDA、IL-4、IL-10和IL-13水平升高而SOD活性降低,Nrf2、转化生长因子(TGF)-β和磷酸化Smad3蛋白表达增加(P<0.05);与IR-7组比较,DIR-7组中纤维化程度及α-SMA、IL-4、IL-10和IL-13水平降低,Nrf2蛋白表达增高,TGF-β和磷酸化Smad3蛋白表达减少(P<0.05)。
IRI造成失神经支配肾脏急性氧化应激损伤剧烈,启动TIF发生;而远期由于氧化应激损伤缓解、Nrf2通路的持续激活,抑制TGF-β表达及其下游Smad3蛋白磷酸化,从而减轻肾脏远期纤维化程度。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾移植是临床治疗终末期肾功能衰竭的唯一有效手段,目前公认肾小管间质纤维化(kidney tubulointerstitial fibrosis,TIF)是肾移植后各种急、慢性免疫损伤发展为肾功能不全,最终导致移植肾功能衰竭的最主要因素[1]。研究表明,缺血再灌注损伤(IRI)可导致多个重要脏器纤维化形成,其中核因子E2相关因子(2NF-E2-related factor-2,Nrf2)和转化生长因子-β(transforming growth factor-β,TGF-β)通路发挥了重要作用[2,3]。然而,肾脏失神经支配作为肾移植中不可避免的病理过程,其对肾功能的影响及其调控机制均缺乏研究。因此,本研究旨在探讨Nrf2调节TGF-β通路在失神经支配肾脏IRI导致的TIF形成中的作用及机制。
成年雄性C57BL/6小鼠,SPF级,8~12周(湖南斯莱克景达实验动物有限公司,合格证号:430727211100861533),兔来源Nrf2 、TGF-β和磷酸化母亲DPP同源物3(果蝇)(Phospho-Smad3)蛋白(Ser423/425和C25A9)多克隆抗体(货号:12721S、3711S和9520,Cell Signal公司),甘油醛-3-磷酸脱氢酶(GADPH)和核纤层蛋白B1(Lamin B1)内参蛋白抗体(货号:60004-1-IG和66095-1-Ig,Proteintech公司),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(货号:BM0002,武汉博士德生物技术公司),去甲肾上腺素(NE)和中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin,NGAL)酶联免疫试剂盒(武汉博士德生物技术公司),丙二醛(MDA)及超氧化物歧化酶(SOD)试剂盒(南京建成生物技术公司),白细胞介素(IL)4、IL-10和IL-13试剂盒(Thermo Fisher Scientific公司)。
本研究实验动物均遵循国家和单位有关实验动物管理和使用的规定。
将C57BL/6小鼠置于昼夜(12 h/12 h,亮/暗)周期的环境中,实验前禁食12 h,自由饮水。随机分为4组:假手术组(Sham组)、肾脏缺血再灌注组(IR组)、失神经假手术组(RDN组)和失神经肾脏缺血再灌注组(DIR组),每组12只小鼠。
腹腔注射5%(质量分数)水合氯醛10 ml/kg麻醉小鼠后,正中开腹,切除右肾,充分暴露左肾动脉主干部位,用无水乙醇配置的10%(体积分数)苯酚烧灼15 min,待肾动脉变白终止,以生理盐水冲洗烧灼部位,关腹。假手术组则开腹后切除右肾,暴露出左肾动脉,不烧灼肾动脉,其余手术操作步骤与前相同。7 d后检测肾组织中去甲肾上腺素含量下降超过85%可以作为该模型制备成功的判断标准。
腹腔注射5%水合氯醛10 ml/kg麻醉小鼠后,正中开腹,找到左侧肾蒂后用无损伤微型动脉夹迅速阻断肾蒂,45 min后去除动脉夹,关腹。采用恒温加热垫控制小鼠肛温在37~38℃,并间断向腹腔内补充温热生理盐水。术后小鼠于24~29℃的环境保暖,补充水与饲料。对照组同法打开腹腔并找到肾蒂,但不夹闭肾蒂。分别于再灌注后1 d和7 d,颈椎脱臼法处死小鼠,收集血液及肾脏标本。
左肾固定包埋后,用苏木精伊红(HE)染色。在BX50光学显微镜下观察各组肾脏组织,进行半定量病理学评分,每个肾脏标本观察10个交叉处的超过100个剖面肾小管损伤,取平均分。0分表示无损伤;1分表示最小损伤(皮层或髓质受累<5%);2分表示轻度损伤(皮层或髓质受累5%~25%);3分表示中度损伤(皮层或髓质受累25%~75%);4分表示严重损伤(皮层或髓质受累>75%)。
运用马松(Masson)三色染色法检测肾脏组织胶原纤维。在BX50光学显微镜下观察各组肾组织。以蓝绿色阳性面积与总面积的百分比作为肾小管间质纤维化半定量评分标准。每个肾脏标本观察10个交叉处的超过100个剖面,取平均分。0分表示无病变;1分表示<10%;2分表示10%~30%;3分表示30%~50%;4分表示>50%。
运用免疫组化SP法(抗体稀释1∶400)检测α-SMA蛋白含量。细胞中棕黄色部分视为阳性。运用Image-Pro© Plus version 6.0进行半定量分析。
左心采血1 ml,4℃ 1 000 g离心15 min,取上清,运用AU5400自动分析仪检测BUN和肌酐水平。采用酶联免疫吸附法(ELISA)测定血清NGAL浓度,具体操作步骤参照试剂盒说明书。
取50 mg肾组织,加入0.9 ml生理盐水制成10%的组织匀浆。采用硫代巴比妥酸法测定MDA含量,邻苯三酚法测定SOD活性。
取肾组织匀浆,采用ELISA法检测,具体操作步骤参照试剂盒说明书。
肾组织匀浆用蛋白提取试剂盒分离胞浆胞核蛋白,二喹啉甲酸(BCA)法测蛋白浓度。每组上样30 μg蛋白样品,经过电泳分离、蛋白电转和抗体孵育(目的蛋白抗体稀释1∶1 000,内参抗体稀释1∶5 000)后,用增强发光液显影,Image J分析软件对条带灰度值进行半定量分析。胞核Nrf2蛋白条带灰度值与Lamin B1内参蛋白条带灰度值比较,胞浆TGF-β和磷酸化Smad3蛋白条带灰度值与GADPH内参蛋白条带灰度值比较。
采用统计软件Graphpad Prism 10对数据进行处理,正态分布计量资料以( ±s)表示。组间比较采用单因素方差(ANOVA)分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
±s)表示。组间比较采用单因素方差(ANOVA)分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
在图1中,RDN-1和RDN-7组中肾组织未出现明显的病理损伤;IR-1组的肾小管出现明显的病理损伤,包括肾小管细胞水肿、坏死、空泡化,肾小管间质增宽,炎症细胞浸润以及细胞核变性和碎裂;而IR-7和DIR-1组中明显加重了肾小管病理学损伤;DIR-7组肾脏病理学损伤较DIR-1和IR-7组均明显减轻。同样地,RDN-1和RDN-7组的肾病理学损伤评分与对照组差异无统计学意义(P>0.05,表1);IR-1组较对照组病理损伤评分增高(P<0.05,表1);而IR-7和DIR-1组病理学损伤评分较IR-1组进一步增高;DIR-7组肾病理学损伤评分较DIR-1和IR-7组均降低,差异有统计学意义(P<0.05,表1)。


注:S为假手术组;IR为肾脏缺血再灌注组;RDN为失神经假手术组;DIR为失神经肾脏缺血再灌注组;-1和-7分别代表造模后1 d或7 d取材
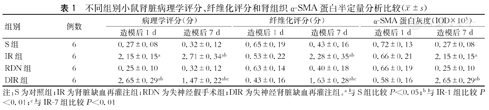
不同组别小鼠肾脏病理学评分、纤维化评分和肾组织α-SMA蛋白半定量分析比较( ±s)
±s)
不同组别小鼠肾脏病理学评分、纤维化评分和肾组织α-SMA蛋白半定量分析比较( ±s)
±s)
| 组别 | 例数 | 病理学评分(分) | 纤维化评分(分) | α-SMA蛋白灰度(IOD×103) | |||
|---|---|---|---|---|---|---|---|
| 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | ||
| S组 | 6 | 0.27±0.08 | 0.32±0.12 | 0.65±0.19 | 0.43±0.16 | 0.72±0.13 | 0.27±0.08 |
| IR组 | 6 | 2.15±0.15a | 2.71±0.34ab | 0.53±0.22 | 2.28±0.35ab | 0.66±0.21 | 2.15±0.15a |
| RDN组 | 6 | 0.25±0.10 | 0.32±0.12 | 0.63±0.14 | 0.40±0.18 | 0.66±0.19 | 0.25±0.10 |
| DIR组 | 6 | 2.65±0.29ab | 1.47±0.22abc | 0.43±0.16 | 1.63±0.28abc | 0.58±0.16 | 2.65±0.29ab |
注:S为对照组;IR为肾脏缺血再灌注组;RDN为失神经假手术组;DIR为失神经肾脏缺血再灌注组。a与S组比较P<0.05;b与IR-1组比较P<0.01;c与IR-7组比较P<0.01
在图2、图3中,与对照组相比,RDN-1、RDN-7、IR-1和DIR-1组中肾组织均未出现明显的间质纤维化改变及α-SMA蛋白阳性表达;IR-7组中出现明显的肾小管间质增宽、炎症细胞浸润、胶原纤维蓝绿色阳性染色增加,且间质纤维化评分及α-SMA蛋白阳性表达均增加(P<0.05,表1);而DIR-7组较IR-7组肾小管间质纤维化改变和评分,α-SMA蛋白阳性表达减少(P<0.05,表1)。
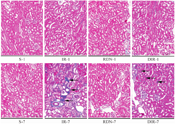

注:S为假手术组;IR为肾脏缺血再灌注组;RDN为失神经假手术组;DIR为失神经肾脏缺血再灌注组;-1和-7分别代表造模后1 d或7 d取材
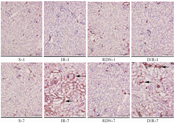

注:S为假手术组;IR为肾脏缺血再灌注组;RDN为失神经假手术组;DIR为失神经肾脏缺血再灌注组;-1和-7分别代表造模后1 d或7 d取材
与对照组相比,RDN-1和RDN-7组中血清中BUN、肌酐和NAGL水平无明显变化;IR-1可升高血清中BUN、肌酐和NAGL水平(P<0.05);与IR-1组相比,IR-7和DIR-1组中血清BUN、肌酐和NAGL水平进一步升高;DIR-7组较DIR-1和IR-7组血清BUN、肌酐和NAGL水平降低(P<0.05)。(表2)
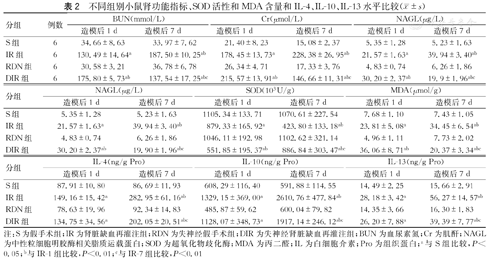
不同组别小鼠肾功能指标、SOD活性和MDA含量和IL-4、IL-10、IL-13水平比较( ±s)
±s)
不同组别小鼠肾功能指标、SOD活性和MDA含量和IL-4、IL-10、IL-13水平比较( ±s)
±s)
| 分组 | 例数 | BUN(mmol/L) | Cr(μmol/L) | NAGL(μg/L) | |||
|---|---|---|---|---|---|---|---|
| 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | ||
| S组 | 6 | 34.66±8.63 | 33.97±7.62 | 21.40±8.23 | 15.08±2.37 | 5.35±1.28 | 5.23±1.63 |
| IR组 | 6 | 130.49±14.64a | 187.50±10.25ab | 178.45±13.73a | 228.38±26.95ab | 21.57±1.63a | 39.94±3.40ab |
| RDN组 | 6 | 30.58±3.21 | 36.78±6.78 | 26.34±4.71 | 17.33±3.76 | 4.83±0.74 | 6.26±1.86 |
| DIR组 | 6 | 175.80±5.73ab | 137.54±17.25abc | 215.57±13.91ab | 146.66±11.31abc | 30.20±2.37ab | 19.9±1.96abc |
| 分组 | NAGL(μg/L) | SOD(103U/g) | MDA(μmol/g) | |||
|---|---|---|---|---|---|---|
| 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | |
| S组 | 5.35±1.28 | 5.23±1.63 | 1105.34±133.71 | 1070.61±227.54 | 7.68±1.10 | 7.43±1.05 |
| IR组 | 21.57±1.63a | 39.94±3.40ab | 879.33±165.92a | 423.80±133.18ab | 23.81±5.08a | 34.45±6.54ab |
| RDN组 | 4.83±0.74 | 6.26±1.86 | 1046.11±192.98 | 1102.62±321.14 | 4.96±1.11 | 7.73±2.02 |
| DIR组 | 30.20±2.37ab | 19.90±1.96abc | 551.85±195.37ab | 886.84±303.47abc | 36.06±8.71ab | 20.37±3.34abc |
| 分组 | IL-4(ng/g Pro) | IL-10(ng/g Pro) | IL-13(ng/g Pro) | |||
|---|---|---|---|---|---|---|
| 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | |
| S组 | 87.91±10.80 | 86.69±11.93 | 608.29±116.40 | 591.88±114.55 | 14.49±2.25 | 15.66±2.91 |
| IR组 | 149.16±15.42a | 282.95±61.16ab | 1329.15±369.00a | 2610.76±477.84ab | 28.18±3.42a | 56.27±14.57ab |
| RDN组 | 78.63±19.96 | 92.34±14.83 | 485.87±59.62 | 600.04±79.82 | 14.35±3.66 | 16.30±1.83 |
| DIR组 | 134.75±34.56a | 202.05±20.51abc | 1128.07±348.73a | 1917.14±246.12abc | 26.20±7.88a | 39.39±7.77abc |
注:S为假手术组;IR为肾脏缺血再灌注组;RDN为失神经假手术组;DIR为失神经肾脏缺血再灌注组;BUN为血尿素氮;Cr为肌酐;NAGL为中性粒细胞明胶酶相关脂质运载蛋白;SOD为超氧化物歧化酶;MDA为丙二醛;IL为白细胞介素;Pro为组织蛋白;a与S组比较,P<0.05;b与IR-1组比较,P<0.01;c与IR-7组比较,P<0.01
与对照组相比,RDN-1和RDN-7组中肾脏组织SOD活性和MDA含量差异无统计学意义;IR-1可降低SOD活性并提高MDA的含量(P<0.05);与IR-1组相比,IR-7和DIR-1组肾组织SOD活性进一步降低同时MDA的含量进一步升高;DIR-7组较DIR-1和IR-7组肾组织SOD活性降低,MDA的含量升高(P<0.05)。(表2)
与对照组相比,RDN-1和RDN-7组中肾组织IL-4、IL-10和IL-13水平差异无统计学意义;IR-1和DIR-1组可轻度升高肾脏组织IL-4、IL-10和IL-13水平(P<0.05);IR-7组中肾组织IL-4、IL-10和IL-13水平增高;DIR-7组较IR-7组肾组织IL-4、IL-10和IL-13水平有所降低(P<0.05)。(表2)
在对照组和RDN组肾脏组织中Nrf2、TGF-β及磷酸化Smad3蛋白表达较弱,而IR-1组中Nrf2、TGF-β及磷酸化Smad3蛋白表达增加(P<0.05);与IR-1组比较,DIR-1组中Nrf2蛋白表达下降,TGF-β及磷酸化Smad3蛋白表达升高;DIR-7组较IR-7组肾组织Nrf2蛋白表达升高,TGF-β及磷酸化Smad3蛋白表达降低,差异均有统计学意义(P<0.05)。(图4,表3)


注:S为假手术组;IR为肾脏缺血再灌注组;RDN为失神经假手术组;DIR为失神经肾脏缺血再灌注组;-1和-7分别代表造模后1 d或7 d取材
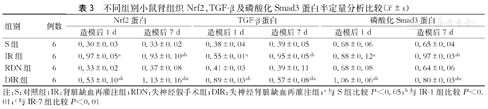
不同组别小鼠肾组织Nrf2、TGF-β及磷酸化Smad3蛋白半定量分析比较( ±s)
±s)
不同组别小鼠肾组织Nrf2、TGF-β及磷酸化Smad3蛋白半定量分析比较( ±s)
±s)
| 组别 | 例数 | Nrf2蛋白 | TGF-β蛋白 | 磷酸化Smad3蛋白 | |||
|---|---|---|---|---|---|---|---|
| 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | 造模后1 d | 造模后7 d | ||
| S组 | 6 | 0.30±0.03 | 0.33±0.02 | 0.38±0.04 | 0.39±0.05 | 0.68±0.06 | 0.65±0.04 |
| IR组 | 6 | 0.97±0.05a | 0.93±0.10ab | 0.55±0.01a | 0.95±0.05ab | 0.88±0.12a | 0.97±0.03ab |
| RDN组 | 6 | 0.33±0.02 | 0.37±0.08 | 0.41±0.03 | 0.39±0.11 | 0.68±0.08 | 0.64±0.06 |
| DIR组 | 6 | 0.53±0.10ab | 1.13±0.16abc | 0.89±0.03ab | 0.57±0.08abc | 1.06±0.06ab | 0.80±0.03abc |
注:S:对照组;IR:肾脏缺血再灌注组;RDN:失神经假手术组;DIR:失神经肾脏缺血再灌注组;a与S组比较P<0.05;b与IR-1组比较P<0.01;c与IR-7组比较P<0.01
IRI是肾移植中最常见的病理损伤,越来越多的实验室研究表明移植肾IRI可引起肾小管可逆/不可逆损伤及修复不充分,以致不同程度的肾小管上皮细胞间质化改变,主要以肾小管间质增宽、炎症细胞浸润、成纤维细胞增殖和细胞外基质增生为病理特征,并直接影响肾脏IRI远期的形态学和功能学恢复[2]。同时,在临床观察研究中[4],对肾移植术后发生肾功能不全的受者进行穿刺活检结果提示,移植肾TIF改变是多种急性和慢性移植肾功能丧失的共同病理过程,其发生率和严重程度与围手术期供肾冷缺血时间以及再灌注引起的氧化应激和炎症损伤指标变化呈阶段式关联性,轻度激活的氧化应激反应可启动肾脏自我修复机制,但过度的氧化应激反应则加重炎症反应,导致纤维化发生。本研究利用小鼠肾脏IRI模型发现,孤立肾脏缺血45 min再灌注7 d后,肾组织出现病理损伤和TIF改变,其机制可能与IRI产生过量的活性氧堆积相关。
另外,失神经支配状态是移植器官不可避免的病理过程。研究表明,肾脏的交感和副交感神经对肾功能以及机体功能的稳定和维持具有重要作用,包括血压、水盐平衡和应激反应;同时在各种疾病状态下的肾脏,其交感神经活性的增加会加重包括高血压、心力衰竭、慢性肾病和糖尿病等病理进程[5]。最新研究显示,去除颈上神经节可阻断肾脏传出神经信号,可降低肾脏去甲肾上腺素(NE)水平,加重肾脏IRI引起的氧化应激损伤和炎症级联反应[6];然而,另一项关于肾纤维化的研究显示,失神经支配后肾纤维化程度减轻,与NE及纤维化相关因子水平下降密切相关[7]。因此,推测失神经支配肾脏对急性氧化应激反应和远期纤维化形成具有不同影响。辅助性T淋巴细胞(T helper cells,Th)分泌的2型细胞因子已成为纤维化形成过程中独特且重要的诱导剂,其中,IL-4和IL-13可直接促进成纤维细胞增生以及胶原合成,IL-10则通过抑制Th1型相关的抑制性细胞因子,发挥促进纤维化形成的作用[8]。本研究亦证实,正常肾脏IRI导致急性期及远期病理损伤和纤维化程度持续加重;失神经支配肾脏IRI导致急性期的病理和功能学损伤均加重,与肾脏氧化应激增加相关,而远期氧化应激和纤维化程度减轻,以及促纤维化相关因子减少。
近年来研究发现,氧化应激反应与远期移植肾发生不明原因纤维化存在密切关系,在移植肾局部,过量的ROS促进间质成纤维细胞的增殖和细胞外基质蛋白的沉积,加速了肾纤维化进展。大量临床及实验室研究发现,Nrf2作为机体对抗氧化应激的核心内源性转录因子,亦具有抑制纤维化的作用;ROS是诱导纤维化的重要介质,激活Nrf2通路,其下游抗氧化应激产物通过清除过量ROS的堆积,抑制纤维化形成[9]。我们之前的研究已证实,Nrf2/ARE信号通路是移植肾再灌注损伤引起的氧化应激反应中的核心机制[10]。本研究中,正常肾脏IRI急性期激活Nrf2通路,Nrf2蛋白表达增加,远期氧化应激持续存在,导致Nrf2蛋白耗竭,纤维化程度加重;在失神经支配的肾脏IRI模型中发现,急性期氧化应激损伤剧烈,Nrf2蛋白表达不足,远期氧化应激损伤缓解,Nrf2通路持续激活,Nrf2蛋白表达增加,同时纤维化程度减轻以及促纤维化相关因子减少。这些结果均表明Nrf2信号通路在肾纤维化形成中起关键作用,提示Nrf2可作为预防移植肾脏TIF发生的新兴靶点。
目前研究关注最多的是TGF-β与各个重要器官纤维化形成过程的关联,其确定为纤维化的触发因素和急性损伤后纤维化发展的关键因子。TGF-β可刺激细胞外基质,抑制蛋白水解酶,以及促进肌成纤维细胞分泌α-SMA蛋白,从而合成大量胶原蛋白、纤连蛋白、层粘蛋白和蛋白聚糖等物质的沉积,引起组织纤维化形成[11]。越来越多的证据表明,TGF-β在不同诱因导致的肺、肝脏、心肌和肾脏纤维化形成中均发挥重要作用,TGF-β在纤维化脏器中均上调[12]。尤其是,TGF-β/Smad3信号通路作为目前公认的主要致纤维化通路与肾纤维化形成的关系密切,TGF-β诱导Smad3磷酸化,促进肌成纤维细胞在受损肾小管间质处聚集,Ⅰ型胶原蛋白等细胞外基质过量分泌,加快TIF进程[13,14]。本研究中,肾脏IRI刺激ROS产生,激活Nrf2通路,TGF-β和磷酸化Smad3蛋白上调;远期氧化应激损伤持续加重,Nrf2蛋白耗竭,TGF-β和磷酸化Smad3蛋白显著增多,导致了肾脏TIF形成。而失神经支配后肾脏IRI模型中,急性期Nrf2蛋白表达不足导致TGF-β蛋白表达增加,启动TIF发生;远期Nrf2蛋白表达增加,抑制了TGF-β蛋白表达及Smad3磷酸化,减轻肾脏TIF程度。目前,已有研究报道,在各种诱因导致的纤维化在体和离体模型中,不同药物通过激活Nrf2通路,清除过量的ROS,可部分抑制TGF-β/Smad3信号通路磷酸化,从而发挥抗纤维化作用[15,16];与此同时,在TGF-β诱导的离体细胞实验中,激活Nrf2通路可有效减少细胞分泌促纤维化相关因子[17]。然而,Nrf2/TGF-β/Smad3通路在肾脏IRI相关的TIF形成中的机制,尚需进一步研究。
综上所述,肾脏IRI可引发远期TIF形成,与氧化应激和炎症级联反应相关,其中ROS激活Nrf2蛋白并介导TGF-β/Smad3通路发挥关键作用。同时,我们推测,移植肾失神经支配,急性期氧化应激反应剧烈,Nrf2表达不足以对抗ROS堆积,TGF-β蛋白表达增加,启动TIF发生;远期可能通过不同途径氧化应激反应得以缓解,Nrf2通路持续激活,抑制了TGF-β蛋白表达及其下游Smad3磷酸化,无法有效促进成纤维细胞向肌成纤维细胞转化,最终表现为肾脏TIF程度减少。因此,围手术期调控IRI引起的氧化应激损伤,可能是实现防治远期纤维化发生和发展的有效途径。
然而,本研究尚存在以下不足:由于交感和副交感神经对肾功能及其内在机制的调节具有不同作用[9],而本研究采用的肾脏失神经支配模型并未分别阻断肾交感和副交感神经,后续将利用交感神经特异性阻断模型进行相关研究。另外肾移植受者均是长期处于肾脏功能不全或衰竭状态的患者,其肾脏神经调节功能及内在机制都与正常肾存在很大程度的不同,因此,对于移植肾脏失神经支配状态下,氧化应激和纤维化形成两者之间的关联研究,尚需要更加深入的探讨。
所有作者均声明不存在利益冲突



























