
探索影响心脏移植受者早期死亡的危险因素及列线图预测模型构建。
回顾性纳入2018年4月至2022年6月在郑州市第七人民医院行心脏移植的163例受者的临床资料,根据受者早期(术后90 d)存活情况,分为存活组(132例)和死亡组(31例),分析比较两组的临床资料,选出危险因素变量,绘制列线图对早期死亡概率进行预测,利用ROC曲线(AUC)下面积、Harrell的C指数和校准曲线用于评估和内部验证该模型的性能。应用决策曲线分析来评估其临床效用。
存活组和死亡组在机械通气、神经系统病变、体外膜氧合使用、红细胞计数≤3.52×1012/L、肺动脉平均压力>27 mmHg、肺血管阻力>4.01 Wood Unit、白蛋白≤33 g/L、天冬氨酸转氨酶>50 U/L、血红蛋白≤108 g/L、血小板计数≤109×109/L、总胆红素>57 μmol/L方面差异存在统计学意义(均P<0.05),是心脏移植受者早期死亡的危险因素。同时根据实际情况和差异变量,围绕血红蛋白≤108 g/L、白蛋白≤33 g/L、血小板计数≤109×109/L、总胆红素>57 μmol/L、天冬氨酸转氨酶>50 U/L、神经系统病变和肺动脉平均压>27 mmHg 7个变量,构造的列线图用来预测心脏移植早期死亡概率,其模型评估AUC曲线下面积0.917,C指数0.910,校准曲线良好,决策曲线分析显示该列线图可使心脏移植受者受益。
根据心脏移植受者实际情况和差异变量构造的列线图用来预测心脏移植受者早期死亡概率可信度高,对心脏移植受者的选择和个体化治疗具有重要的意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心脏移植是终末期心力衰竭患者最有价值的治疗选择。全世界每年进行超过5 000例心脏移植手术,移植后中位生存期超过12年[1]。大多数供心分配方案根据移植等待者目前死亡风险,对候选人名单进行优先级排序,并不考虑移植后早期死亡的风险[2]。在法国心脏移植分配系统中,如果心脏移植后第一年的死亡风险大于50%,则禁止移植[3]。根据心脏移植后死亡率预测评分(index for mortality prediction after cardiac transplantation,IMPACT)和我国心脏移植候选人术前的评估可获知心脏移植的危险因素[4,5],但未见通过危险因素整合和进行死亡的概率预测。本文对2018年4月至2022年6月在郑州市第七人民医院行心脏移植的163例受者的临床资料进行总结分析,观察受者围手术期死亡情况,绘制死亡概率列线图,旨在为临床医师进行临床决策提供参考。
回顾性分析2018年4月至2022年6月在郑州市第七人民医院接受心脏移植的163例受者的临床资料,所有的数据来自受者心脏移植前最后一次术前检查及所处的状态。其中心脏原发病为扩张性心肌病108例(66.2%)、冠状动脉粥样硬化性心脏病38例(23.3%)、心脏瓣膜病5例(3.0%)、肥厚型心肌病心脏病4例(2.5%)、致右室心律失常心肌病8例(5.0%)。所有受者均为常规抗心力衰竭药物治疗无效有心脏移植手术指征的晚期心力衰竭患者,心脏移植术前均经郑州市第七人民医院伦理委员会讨论通过并由受者本人及家属签署手术知情同意书。
163例受者的随访截止时间为心脏移植术后90 d。根据受者随访截止时的状态分为存活和死亡两组进行比较,其中存活组132例(81%),死亡组31例(19%)
完善病史采集,从郑州市第七人民医院的心脏移植名单中收集受者术前资料。根据美国心脏移植注册数据库建立的心脏移植术后IMPACT模型中的因素及结合临床实际收集资料。
病程时间、年龄、性别、身高、体重、血型、吸烟史;合并症[高血压、糖尿病、神经系统病变(Neurological lesions)、心律失常];超声心动图检查[射血分数、左室舒末内径(left ventricular diastolic internal diameter,LVDD)、左房前后径(anteroposterior diameter of left atrium,LADs)、二尖瓣中重度返流(mitral regurgitation,MR)、三尖瓣中重度返流(tricuspid regurgitation,TR)];漂浮导管检查[肺动脉平均压(mean pulmonary artery pressure,mPAP)、肺毛细血管楔压(pulmonary capillary wedge pressure,PCWP)、肺血管阻力(pulmonary vascular resistance,PVR)、纽约心功能分级(New York Heart Association,NYHA)]、实验室检查[白细胞计数(white blood cell count,WBC)、红细胞计数(red blood cell count,RBC)、血小板计数(platelet count,Plt)、血红蛋白、白蛋白、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆红素、血肌酐、N末端B型利钠肽原(N-terminal B-type natriuretic peptidogen,NT-proBNP)]。
包括机械通气、是否植入主动脉内球囊反搏(intra-aortic balloon pump,IABP)、植入体外膜氧合(extracorporeal membrane pulmonary oxygenation,ECMO)、连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)等过渡措施。
采用SPSS 26.0软件进行统计学处理,筛选出具有差异的单因素变量、Prism 9.0软件进行单因素分析具有差异变量绘图。符合正态分布的计量资料以( ±s)表示,采用单因素ANOVA分析进行比较;非正态分布的计量资料用M(Q1,Q3)表示,采用Kruskal-WallisH检验进行比较,计数以例(%)表示,比较采用χ2检验。
±s)表示,采用单因素ANOVA分析进行比较;非正态分布的计量资料用M(Q1,Q3)表示,采用Kruskal-WallisH检验进行比较,计数以例(%)表示,比较采用χ2检验。
利用Medcalc 19.0软件将筛选的计量资料通过ROC曲线分析,计算出曲线下面积(AUC,0.6~0.7具有低度可信度,0.7~0.9具有中度可信度,>0.9具有高度可信度),并进行临界值的计算,将计量资料转变为分类变量,P<0.05为差异具有统计学意义。
利用R语言软件4.1.1版本进行临床预测模型构建。进行Lasso回归筛选变量,排除样本不够多变量模型拟合共线性。与筛选出来具有差异的单因素变量进行比较,合并共同变量。使用Survival和RMS包在R软件中绘制列线图,经bootstrap重复进行1 000次用于计算C指数,以评估列线图的预测准确性。C指数越高,列线图预测的准确性越高(参考范围0.51~0.7为低准确度,0.71~0.9为中等准确度,大于0.90为高准确度)。模型验证采用校正图、ROC曲线,临床决策曲线分析(decision curve analysis,DCA)评估临床获益程度。
存活组和死亡组比较,在机械通气、神经系统病变、ECMO、mPAP、PVR、白蛋白、AST、血红蛋白、RBC、Plt、总胆红素方面的差异均有统计学意义(均P<0.05,表1);在性别、心律失常、糖尿病、高血压、慢性阻塞性肺病、IABP、CRRT、吸烟、血型、NYHA、初发疾病类型、年龄、身高、体重、射血分数、左房前后径、左室舒张末内径、白细胞计数、ALT、血肌酐、NT-proBNP、病程时间方面比较差异无统计学意义(均P>0.05)。
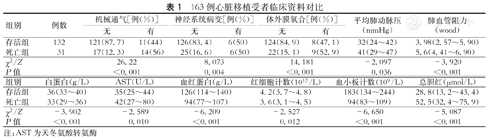
163例心脏移植受者临床资料对比
163例心脏移植受者临床资料对比
| 组别 | 例数 | 机械通气[例(%)] | 神经系统病变[例(%)] | 体外膜氧合[例(%)] | 平均肺动脉压(mmHg) | 肺血管阻力(wood) | |||
|---|---|---|---|---|---|---|---|---|---|
| 无 | 有 | 无 | 有 | 无 | 有 | ||||
| 存活组 | 132 | 121(87.7) | 11(44) | 126(83.4) | 6(50) | 124(84.9) | 8(47.1) | 32(24~42) | 3.98(2.57~5.90) |
| 死亡组 | 31 | 17(12.3) | 14(56) | 25(16.6) | 6(50) | 22(15.1) | 9(52.9) | 41(29~47) | 5.6(4.41~6.90) |
| χ2/Z | 26.22 | 8.073 | 14.181 | -2.097 | -3.920 | ||||
| P值 | <0.001 | 0.004 | <0.001 | 0.036 | <0.001 | ||||
| 组别 | 白蛋白(g/L) | AST(U/L) | 血红蛋白(g/L) | 红细胞计数(1012/L) | 血小板计数(109/L) | 总胆红(μmol/L) |
|---|---|---|---|---|---|---|
| 存活组 | 36(33~40) | 35(25~44) | 126(114~140) | 4.2(3.7~4.8) | 183(134~244) | 28.8(13.2~43.4) |
| 死亡组 | 33(29~36) | 42(27~80) | 94(77~107) | 3.6(3.1~4.5) | 94(83~109) | 52.5(32.4~75.9) |
| χ2/Z | -3.902 | -2.589 | -6.209 | -2.527 | -6.650 | -5.087 |
| P值 | <0.001 | 0.010 | <0.001 | 0.012 | <0.001 | <0.001 |
注:AST为天冬氨酸转氨酶
通过ROC曲线分析计算出mPAP、PVR、血红蛋白、Plt、总胆红素、AST、白蛋白、ALT、RBC的临界值(表2、图1,图2)。
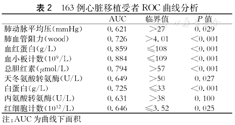
163例心脏移植受者ROC曲线分析
163例心脏移植受者ROC曲线分析
| AUC | 临界值 | P值 | |
|---|---|---|---|
| 肺动脉平均压(mmHg) | 0.621 | >27 | 0.029 |
| 肺血管阻力(wood) | 0.726 | >4.01 | <0.001 |
| 血红蛋白(g/L) | 0.859 | ≤108 | <0.001 |
| 血小板计数(109/L) | 0.884 | ≤109 | <0.001 |
| 总胆红素(μmol/L) | 0.794 | >57 | <0.001 |
| 天冬氨酸转氨酶(U/L) | 0.649 | >50 | 0.027 |
| 白蛋白(g/L) | 0.725 | ≤33 | <0.001 |
| 丙氨酸转氨酶(U/L) | 0.631 | >38 | 0.100 |
| 红细胞计数(1012/L) | 0.646 | ≤3.52 | 0.025 |
注:AUC为曲线下面积
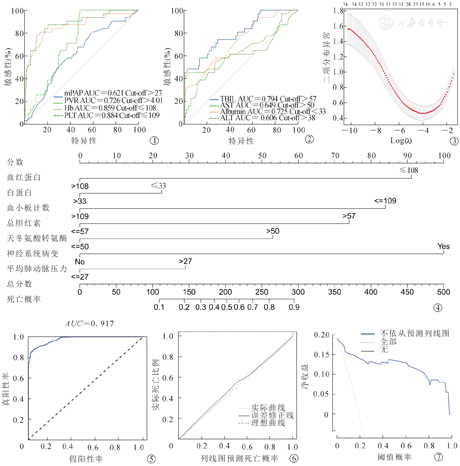

注:mPAP为肺动脉平均压;PVR为肺血管阻力;Hb为血红蛋白;PLT为血小板计数;TBIL为总胆红素;AST为天冬氨酸转氨酶;Albumin为白蛋白;ALT为丙氨酸转氨酶
单因素分析显示出11个变量具有统计学意义、Lasso回归筛选出16个变量拟合模型没有共线性(图3)。取其中的共同变量和与预后关联最紧密的临床因素,进一步构建了基于血红蛋白、白蛋白、Plt、总胆红素、AST、神经系统病变、mPAP 7个变量的心脏移植受者围手术期死亡风险的概率列线图。通过将每个变量对应的点向分数轴投射获得的分数相加,所得总分数可对应相应的预测结果(图4)。
7个变量的列线图,C指数为0.910(C指数越接近于1表示列线图可信度越高),绘制ROC曲线诊断模型,AUC=0.917(图5)。通过绘制7个因素列线图模型的预测值与实际值校准图,显示列线图预后模型与真实结果具有较高的一致性(图6)。
进一步评估7个临床因素的加入是否可以使心脏移植受者在临床实践中受益。列线图的DCA评估了受者的净获益(净获益率越大,预后风险模型的预测性能越好),结果表明基于7个临床因素的预后模型在实际临床中使得受者有更多获益(图7)。
本研究初步探索了心脏移植术后早期死亡的危险因素。研究者关注心脏移植术前的变量,以了解它们与心脏移植早期死亡的关系,并用Logistic回归模型进行临床预测模型列线图的构建,用于早期死亡风险概率的预测。19%的受者发生早期死亡,11个术前变量是心脏移植早期死亡的危险因素,分别是:存在机械通气、存在神经系统病变、存在ECMO使用、mPAP>27 mmHg、PVR>4.01 wood、白蛋白≤33 g/L、AST>50 U/L、血红蛋白≤108 g/L、RBC≤3.52×1012/L、Plt≤109×109/L、总胆红素>57 μmol/L。
本研究在国内第一次构造了心脏移植受者基于列线图早期死亡的临床预测模型,该列线图可信度高。事实上一些研究已经表明列线图比传统的模型具有更好的风险预测性能[6]。该模型在DCA分析的临床实践中显示出较整个阈值概率范围内不使用模型更大的净收益,从而说明了列线图在临床实践中的具有较好的效用。
机械通气对心脏移植的影响尚不清楚,此外,美国心脏移植新的分配系统中已将机械通气移除[7]。一项研究报道60 980例接受心脏移植的受者,其中2.4%在移植时需要机械通气。该研究还发现心脏移植后90 d和1年的死亡率之间具有很强的相关性,但未解释具体的病理机制。ECMO作为桥接心脏移植的方案,在心脏移植等待名单中属于紧急状态,优先分配供者心脏。在新系统中,ECMO作为桥接心脏移植的机械工具,使受者在等待移植的180 d内获得了更好的生存,减少了术前并发症,并且心脏移植受者的预后也得到显著改善[8]。心脏移植前ECMO的使用率正在增加,早期即接受和未接受ECMO的受者在移植后住院死亡率方面的差异无统计学意义,但临时接受ECMO受者移植后并发症的发生率增加[9]。另有研究表明,心脏移植院内并发症在接受ECMO受者中更常见,如:急性肾功能衰竭、急性肝功能衰竭、急性呼吸衰竭、出血、再次手术的并发症和败血症等[10]。
心力衰竭者晚期常合并肺动脉高压(pulmonary arterial hypertension,PAH),其产生原因是左心收缩能力下降,肺充血,继而引发炎症改变,肺小动脉重构[11]。临床将左心衰竭引起的PAH称为毛细血管后肺动脉高压,多数是可逆的,经术前调整到理想标准,可以继续行心脏移植[12]。术前PAH是心脏移植术后肺动脉高压和移植心右心功能恶化的重要危险因素,与早期移植物衰竭相关[13]。《国际心肺移植学会指南》认为:心脏移植术前严重的PAH且PVR≥5 wood是心脏移植的相对禁忌证。在《中国心脏移植受者术前评估与准备技术规范(2019版)》中把不可逆的PAH定义为:肺动脉收缩压>60 mmHg、跨肺压>15 mm、PVR>6 wood,不可逆的PAH被视为心脏移植的绝对禁忌证[14]。本研究中获知大于mPAP>27 mmHg与PVR≥4.01 wood是心脏移植早期死亡的危险因素,具有实际参考价值,在以后的临床中将更多关注。
对于心力衰竭移植等待者,血红蛋白含量往往较低。而且无论心肌收缩功能水平如何,血红蛋白水平都能够独立预测心力衰竭受者死亡和住院风险[15]。供心再灌注时受者血红蛋白水平低与心脏移植后的原发性移植物功能不全独立相关,低血红蛋白可增加早期移植死亡率,使用血液输注进行术中管理,可预防心脏移植后原发性移植物功能不全[16]。另外红细胞体积分布宽度可以作为心脏移植风险评估的重要工具[17]。血小板减少增加了出血的风险,术后出血并发症(如消化道出血)对心脏移植手术早期的存活具有重要影响[18],尤其是术前术后接受ECMO治疗的受者,移植抗凝管理的难度更高。
总胆红素和AST升高提示受者肝功能紊乱,这些可能导致移植的心脏不适应受者的身体。本研究参考法国新的心脏分配系统[19,20](旨在最大程度地降低等待者死亡率和扩大供体库),同样将胆红素纳入预测模型。但现有动物实验模型研究表明,胆红素可以对缺血再灌注的心肌细胞起到保护作用[21]。另外,这些肝酶的升高,会在心脏移植3个月后出现显著下降[22]。因此,对于心脏移植前肝酶谱异常值临界点的评估显得十分重要。
心脏移植受者死亡风险和预后不良事件的增加会随时间发生变化,其中由神经系统事件导致的移植死亡率在持续上升[20]。心脏移植术前术后神经系统病变的发生率为30%~70%,临床常见的包括脑栓塞、脑出血、癫痫发作、头痛等[23]。本研究虽进行严格的移植前筛查,但心脏移植后神经系统并发症仍常见。这些并发症不是受者死亡的实际原因,而是增加其他事件的发病率,如机械通气时间更长,重症监护病房住院时间更长,肺炎和脓毒症的发病率更高。特别是心脏移植术前机械循环支持,是神经系统不良结局的较强预测因素[24]。
本研究发现原发病为肥厚性心肌病和心脏瓣膜病的心力衰竭受者,移植后早期死亡率超过半数,但差异无统计学意义。与收缩性心力衰竭不同,肥厚性心肌病导致的心力衰竭是心室充盈和顺应性下降,导致心腔内压力升高以及心房和心室肌变形。病理生理机制不同可能导致机械辅助插管梗阻、贴壁抽吸、血泵流量不足和血栓形成等不良事件形成,增加了移植等待风险和早期死亡率[25,26]。原发病是心脏瓣膜病的心脏移植受者早期死亡率较高,被认为可能是心脏移植预后不良的一组类型。然而,对心脏瓣膜病心力衰竭的受者结局报道较少[27]。一项研究表明,瓣膜病受者占心脏移植适应证的3%~5%,这些受者经历了多次手术,且PVR的增高是导致早期死亡的主要原因。但在心脏移植的长期生存上与其他受者无异[28]。
本研究尚有一定局限性。首先,这是一项回顾性分析,证据等级有限。其次,研究局限于单中心,缺少多中心数据。第三,本研究时间较长,受者个体化治疗方案有所不同。
综上所述,机械通气、存在神经系统病变、存在ECMO使用、RBC≤3.52×1012/L、mPAP>27 mmHg、PVR>4.01 wood、白蛋白≤33 g/L、AST>50 U/L、血红蛋白≤108 g/L、Plt≤109×109/L、总胆红素>57 μmol/L是心脏移植受者早期死亡的风险因素。根据实际情况和差异变量构造的列线图用来预测死亡概率可信度高,对心脏移植受者的选择和个体化治疗具有重要的意义。
所有作者均声明不存在利益冲突



























