
在肝移植术后早期,受者的凝血功能处于脆弱的平衡之中。受到各种复杂机制的影响,血液通常会倾向于高凝状态。诸如凝血因子与生理性抗凝物质失衡、血管性血友病因子水平升高、纤溶抑制发生以及使用免疫抑制剂等内在或外在因素,都会导致肝移植术后早期血液高凝状态形成。血液高凝状态可能导致肝动脉血栓形成、门静脉血栓形成及深静脉血栓形成等血栓并发症。术后采用药物预防性抗凝,在降低术后早期血栓风险方面有一定效果,但尚缺乏高质量证据。本文重点阐述目前关于肝移植术后早期凝血功能紊乱、血栓事件发生及预防性抗凝中的最新研究进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
终末期肝病患者的凝血功能多出现异常,而作为根治终末期肝病的外科手段,肝移植手术会进一步影响患者的凝血功能,增加围手术期出血及血管并发症的风险。在肝移植术中,处于不同时期的受者,凝血功能会发生不同程度的紊乱。受术中出血及肝素化、移植肝功能尚未恢复、血小板水平较低等因素的影响,受者凝血系统在肝移植术后可短暂呈现低凝状态;但在移植肝复流12~36 h后,随着其功能恢复,受者凝血系统通常会开始持续向高凝状态转变,导致肝移植术后早期(术后4周内)血栓形成的风险升高[1,2]。
在肝移植术后,为了降低肝移植术后早期血栓发生风险,部分移植中心会采用药物进行预防性抗凝;但各中心之间在是否预防性抗凝,以及预防性抗凝药物种类的选择、抗凝治疗时长、出血风险监控方案等方面均存在差异;同时也有文献报道抗凝可能增加出血风险,影响受者预后[3]。
本综述将聚焦肝移植术后早期血液高凝状态形成机制、血栓事件及抗凝治疗现状,以期形成更加合理的凝血功能精细化管理体系,减少肝移植术后凝血相关并发症,进一步提升肝移植受者存活率。
生理凝血过程受多种因素调节,包括血小板、凝血因子[包括血管性血友病因子(von Willebrand factor,vWF)]等促凝因子,以及生理性抗凝物质(包括vWF裂解蛋白酶等)、纤维蛋白溶解系统等抗凝因子(图1A)[4,5]。由于大部分凝血因子、部分生理性抗凝物质以及部分纤溶因子等由肝脏合成,在终末期肝病患者中可出现促凝及抗凝因子合成或消除不足,使患者的凝血功能处于脆弱的平衡之中(图1B)[6]。肝移植则常常会打破这一平衡,使得肝移植术后早期受者的凝血功能倾向于高凝状态(图1C)。
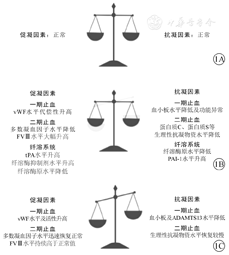

生理性止血分为一期止血(血管收缩与血小板血栓形成)与二期止血(纤维蛋白交织成网加固血栓),此外还存在抗凝系统与纤维蛋白溶解系统以防血栓过度增大。终末期肝病导致的肝功能失代偿会影响上述所有过程[7]。
对于一期止血,失代偿期肝硬化患者因促血小板生成素(thrombopoietin,TPO)水平下降、脾功能亢进、骨髓抑制、酒精及免疫相关损伤等影响,其血小板在生成减少同时破坏增加[8,9]。同时,研究表明肝硬化患者由于花生四烯酸代谢异常、信号转导异常及血小板膜糖蛋白Ib(glycoprotein,GPIb)含量减少等因素,导致血小板黏附功能具有缺陷,从而进一步导致一期止血的异常[10,11]。在此基础上,肝硬化患者的vWF通常会代偿性增加,以维持脆弱的凝血平衡,甚至向高凝状态转变;有研究表明,其机制可能包括潜在的血管内皮损伤及肝硬化诱导的肝脏血管内皮中vWF高表达,但其诱导表达的具体机制或信号通路尚未阐明[12,13]。
对于二期止血,在肝硬化失代偿期,纤维蛋白原及大部分由肝细胞合成的凝血因子(如FII、FV、FVII、FIX、FX、FXI等)水平降低,同时蛋白质C(protein C,PC)及蛋白质S(protein S,PS)等生理性抗凝物质的水平亦降低,使得凝血平衡变得更加脆弱[7]。然而,肝硬化患者的FVIII水平反而可增长至正常水平的数倍,主要原因是肝窦内皮细胞及库普弗细胞此时仍能维持FVIII的合成[9,14]。高水平的vWF可与FVIII结合阻碍其降解,加之介导FVIII降解的低密度脂蛋白受体相关蛋白(low density lipoprotein receptor related protein,LRP)在肝硬化患者中处于低水平,最终导致FVIII水平升高[15]。在此基础上,考虑到肝硬化失代偿期门静脉血流的相对淤滞及血管内皮可能存在损伤,门静脉血栓形成(portal vein thrombosis,PVT)的风险将大大升高[16]。
对于纤溶系统,肝硬化患者肝细胞合成纤溶酶原、纤溶酶抑制剂及凝血酶激活的纤溶抑制物(thrombin-activatable fibrinolysis inhibitor,TAFI)水平降低;而内皮细胞合成组织纤溶酶原激活物(tissue plasminogen activator,t-PA)及纤溶酶原激活物抑制物1型(plasminogen activator inhibitor-1,PAI-1)清除受阻,使其水平升高[9]。不同因子合成或清除异常致使纤溶系统处于脆弱平衡之中,而这些因子的水平波动也可能导致凝血功能倾向高凝状态。Rossetto等[17]报道TAFI和PAI增加可能在肝硬化患者PVT发展中发挥了促进作用。Nicolau-Raducu等[18]用血栓弹力图(thrombelastogram,TEG)评估肝移植受者术前的纤溶状态,发现术前有72%的患者处于纤溶抑制状态,这可能是终末期肝病患者凝血功能失衡的标志之一。
肝移植术后早期,由于移植肝功能逐步恢复,血液中凝血因子与生理性抗凝物质水平均呈上升趋势,但会在一段时间内逐渐恢复正常。然而二者的恢复并不同步,早期研究显示,多数凝血因子在术后第1天即可达到正常参考值范围,生理性抗凝物质则在术后较长时间内持续低于基线水平,尤其是抗凝血酶,通常术后7~14 d才能恢复正常(图2)[19,20]。由此可见,肝移植术后早期凝血因子与生理性抗凝物质水平的失衡,可能促使受者凝血功能在术后早期向高凝状态转变。
关于这一失衡状态的现有文献多着重描述其现象及受者预后相关内容。早期研究显示,儿童肝移植术后早期PC缺乏可能与血栓风险升高有关[21]。Burlage等[22]发现肝移植术后受者血浆对重组人可溶性血栓调蛋白具有抗药性,可能是因为肝移植术后受者血浆PC、PS水平偏低。Wagener等[23]指出,PC活性是肝移植术后代谢性肝功能障碍的早期预测因子。然而,生理性抗凝物质较凝血因子恢复更慢的具体发生机制目前还不甚清楚,仍需进一步阐明。
vWF主要由血管内皮生成,可介导血小板黏附,在凝血过程中起到重要作用。外科手术创伤导致的生理应激及炎症反应等因素均可能导致肝移植术后vWF水平升高(图2),促进受者凝血功能向高凝状态转变 [24]。而失代偿期肝硬化受者vWF水平上升,会进一步加速在肝移植术后早期血液高凝状态的形成[8,12]。
与vWF水平相比,vWF活性对凝血的作用更为重要。vWF活性可由vWF裂解蛋白酶(ADAMTS13)调节,ADAMTS13缺失会导致血小板异常积聚,进而导致血栓无节制地形成[25]。Pereboom等[26]报道ADAMTS13水平在肝移植术中大幅下降(图2),导致vWF与ADAMTS13水平在术后早期严重失衡,可能是这一时期vWF活性升高的重要影响因素,其机制可能与术中无肝期缺乏其合成有关。Ko等[27]的一项研究亦发现大部肝切除术后受者ADAMS13水平的变化比肝移植术后受者更为温和,与Pereboom等[26]的假设相符,但仍需进一步研究阐明其机制。
通常认为免疫抑制剂的使用可能与肝移植术后早期高凝状态有关[1]。钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)包括环孢菌素A、他克莫司等,可用于肝移植术后移植物排斥反应的预防。动物试验表明,环孢菌素A的持续使用不仅会损害血管内皮细胞功能,还可使血管内皮集落形成细胞(endothelial colony forming cells,ECFC)集落形成能力降低,导致血管内皮修复受阻[28,29,30]。有研究认为,CNI可导致舒血管物质(NO、前列环素等)水平降低和缩血管物质(肾素-血管紧张素系统等)水平升高,从而导致血管内皮受损[31]。血管内皮损伤是血栓形成的要素之一[28]。早期体外研究显示,环孢菌素A导致的血管内皮损伤可诱导凝血过程启动[32];而将内皮细胞暴露于地塞米松致其损伤时,也会导致vWF生成增加[33]。
此外,不同免疫抑制剂导致血栓事件的风险可能亦不同。Bedreli等[34]的研究表明,与接受他克莫司治疗的受者相比,接受mTOR抑制剂(mTORi)治疗的肝移植受者术后的血栓事件风险更高。部分研究还发现,mTORi与CNI联用时会导致受者血栓性微血管病的风险显著增加,其机制可能是mTORi诱导血管内皮生长因子表达下调,使血管内皮修复受阻,从而加剧了其损伤[35,36,37]。
但尽管目前已有较多相关研究揭示了CNI及mTORi导致血栓事件风险升高的部分机制,但目前相关研究多为长期临床随访研究或体外研究,难以完全阐明免疫抑制剂的应用与肝移植术后早期高凝状态间的机制。
肝移植术后早期高凝状态与血栓形成直接相关,而血栓形成是肝移植术后早期最危险的并发症[1]。肝移植术后早期主要血栓形成事件包括门静脉血栓形成、肝动脉血栓形成(hepatic artery thrombosis,HAT)及深静脉血栓形成(deep venous thrombosis,DVT)等[38]。
肝移植术后PVT可能导致受者移植后生存率降低,近年文献报道其发生率小于3%,且多数发生于肝移植术后早期[39,40]。肝移植术后PVT的风险因素除血液高凝状态,还包括术前门静脉高压、门静脉发育不良、供体和受体门静脉大小不匹配,以及门静脉高压的部分治疗手段,如脾切除术、经颈静脉肝内门体分流术等[38]。多项研究表明,术前PVT受者的术后PVT风险显著高于术前无PVT受者[41,42]。原因可能有以下2点:一是术前PVT终末期肝病受者的凝血功能往往更差;二是术前PVT受者在术中常需进行静脉取栓,易导致血管内膜发生损伤,使肝移植术后血栓事件风险升高[43,44,45]。
HAT常导致移植物缺血甚至移植物丢失,是肝移植术后最危险的血管并发症之一[38,39]。多项单中心研究显示,成人肝移植术后HAT发生率约为5%,其中术后早期HAT发生率将近2%[46,47]。血液高凝状态、肝动脉解剖结构异常及手术技术等因素皆与肝移植术后HAT有关,术后巨细胞病毒感染也可能增加HAT风险[38,48]。肝移植术后HAT风险升高亦可能与术前PVT有关,其机制可能与围手术期持续的血液高凝状态有关[49]。
包括肝移植在内的大型外科手术是DVT的危险因素之一。早期文献多认为肝移植术后DVT的发生率低于5%[50]。近年Emuakhagbon等[51]报道肝移植术后早期DVT发生率为5.0%;Annamalai等[52]的研究表明,在仅采取机械预防措施的情况下,肝移植术后90 d内DVT的发生率达8.6%(平均发生时间为术后20.7 d)。肝移植术后DVT的风险因素包括血液高凝状态、长时间静止导致的静脉淤滞及凝血因子的过度使用等[38,53]。尽管受者血液的高凝状态可能导致DVT风险升高,但实际上肝移植术后受者DVT风险与其他大型手术相差不大[51],甚至远低于髋关节置换术等大型骨科手术[54]。
由于肝移植术后早期存在血液高凝状态及发生早期血栓并发症的风险,对血液高凝状态的评估和对血栓形成的监测在临床中应用较为普遍。TEG及彩色多普勒超声(color doppler ultrasound,CDUS)等对早期发现出凝血功能障碍及血栓形成具有提示作用。目前TEG广泛用于肝移植术后早期受者凝血功能的评估[55]。研究表明,TEG可用于预测受者出血及血栓形成风险[56]。CDUS是肝移植术后早期HAT及PVT事件早期监测的重要手段,可对受者是否发生血栓形成事件进行早期评估[57]。Gu等[58]的研究表明,CDUS对肝移植术后早期HAT事件早期评估的敏感性可达85.7%;对于CDUS难以诊断的部分疑难病例,亦可用CT血管造影做进一步评估[57]。
部分中心常规采用预防性抗凝的策略以降低高凝状态下血栓的发生风险,但对于肝移植术后早期的抗凝治疗,目前多以经验性用药为主,选择何种药物、如何在剂量上做到精准调控及药物使用时长等方面,都缺乏高质量的临床研究,各中心标准差异较大。另一方面,抗凝治疗是否增加出血并发症目前仍需研究。
现就目前在肝移植术后早期较为常用、研究相对较多的抗凝药物(表1)包括普通肝素(unfractionated heparin,UFH)、低分子量肝素(low molecular weight heparin,LMWH)及阿司匹林等进行详细综述。

可应用于肝移植术后早期预防性抗凝治疗的药物
可应用于肝移植术后早期预防性抗凝治疗的药物
| 分类 | 药物 | 机制 | 给药方式 | 特点 |
|---|---|---|---|---|
| 凝血酶间接抑制剂 | LMWH | 放大抗凝血酶对FXa和凝血酶的抑制活性,间接发挥抗凝作用 | 静脉或皮下注射 | 较UFH导致出血的概率更低,其他副作用包括肝素诱导的血小板减少症;尚无有效的床边监测方法,但可通过FXa监测;其效应仅能被鱼精蛋白部分逆转[59,60] |
| UFH | 机制与LMWH类似,但抑制FXa作用更强,对FIIa抑制作用较小 | 副作用包括出血(最主要)及肝素诱导的血小板减少症(发生率较应用LMWH时更高);可使用ACT、APTT进行床边监测;其效应可被鱼精蛋白逆转[59] | ||
| 抗血小板药物 | 阿司匹林 | 通过抑制COX阻断TXA2的合成,抑制血小板的聚集 | 口服 | 作为非甾体抗炎药,可通过对COX的抑制发挥多种多样的作用,如解热、镇痛、抗炎、抗血小板等[72] |
| 选择性FXa直接抑制剂 | 利伐沙班 | 抑制FXa,阻止凝血酶原转变为凝血酶 | 口服 | 属于新型口服抗凝药,口服生物利用度高[77] |
| 选择性FXa间接抑制剂 | 磺达肝癸钠 | 通过增强抗凝血酶活性,间接对FXa产生抑制作用 | 皮下注射 | 出血风险较低,皮下注射生物利用度高,起效快;在预防深静脉血栓形成方面优于低分子量肝素[81] |
| 维生素K拮抗剂 | 华法林 | 抑制维生素K依赖性凝血因子(FII、FVII、FIX、FX)在肝脏的合成 | 口服 | 水溶性强,口服生物利用度高,但起效慢 |
注:LMWH为低分子量肝素;UFH为普通肝素;COX为环氧化酶;TXA2为血栓素A2;ACT为活化凝血时间;APTT为活化部分凝血活酶时间
UFH及LMWH作为抗凝药物,在肝移植术后早期抗凝治疗中的应用较为广泛,且相关研究相对较多。LMWH通过放大抗凝血酶对FXa和FIIa的抑制活性,发挥抗凝作用。UFH与LMWH作用机制类似,但LMWH对FXa的抑制作用较对FIIa的更强,抗血栓作用更强[59]。
部分观察性研究展示了肝素抗凝受者血栓事件(PVT及HAT)及出血事件的发生率。Kaneko等[60]的一项前瞻性研究中血栓事件发生率为3%,出血事件为15%;该研究同时评估了部分受者术后2周内的纤溶状态,结果显示受者在术后第2周出现高纤溶状态,提示较高的出血事件概率可能与高纤溶状态有关。Gad等[61]的一项回顾性研究中,血栓事件发生率为5.6%,出血事件为1.8%;该研究中术前PVT受者术后血管并发症(血栓事件和血管狭窄)发生率显著高于术前未发生PVT的受者,提示对此类受者应采取更积极的抗凝治疗。此外,多项对照研究表明,肝素抗凝在肝移植术后早期起到了积极作用。Yip等[62]的一项回顾性研究显示,外周中心静脉导管(perpherally inserted central venous catheter,PICC)的放置显著增加了血栓事件(DVT及肺栓塞)的发生率;而无论是否放置PICC,应用肝素受者血栓事件发生率均显著低于未应用肝素受者。Colombo等[63]的一项回顾性研究表明,小儿肝移植术后早期应用肝素与血栓事件发生率降低显著相关,同时肝素组与对照组间出血事件发生率差异无统计学意义,表明小儿肝移植术后早期应用肝素对于预防血栓事件是有效且安全的。
需要注意的是,UFH及LMWH在肝移植术后早期应用时易导致出血事件的发生,临床应用时,应密切监测受者的凝血功能。近年的研究显示,抗Xa活性与围手术期出血的相关性优于湖、活化凝血时间(activated clotting time,ACT)[64];而在UFH剂量的调整上,监测抗Xa活性优于活化部分凝血活酶时间(activated partial thromboplastin time,APTT)[65];所以监测抗Xa活性效果较ACT、APTT好[66,67,68]。不过,虽然ACT监测并不适用于皮下注射LMWH,但有研究表明其在静脉注射LMWH中可能具有监测价值[69]。Marmur等[70]报道静脉注射达肝素时ACT监测的敏感度较高;Uchikawa等[71]的一项小样本回顾性研究显示,根据ACT水平调节静脉注射达肝素剂量的所有受者均未观察到血栓及出血的并发症,但其与对照组间的差异没有统计学意义。
目前UFH及LMWH对肝移植术后早期受者的预防性抗凝可能具有一定效果,但其临床应用多为经验性用药,缺乏高质量证据。考虑到出血风险的增加,在应用UFH及LMWH时监测凝血功能是十分重要的,同时也需开展更多高质量的随机对照研究,以验证在抗凝治疗中受者的临床获益。
阿司匹林可抑制环氧化酶(cyclooxygenase,COX),使其发生不可逆的乙酰化;抑制花生四烯酸转化为血栓素A2(thromboxane A2,TXA2)的前体前列腺素G2(prostaglandin G2,PGG2),从而抑制血小板聚集,发挥抗血小板作用[72]。
阿司匹林预防肝移植术后早期血栓事件的效果并不显著。Vivarelli等[73]的一项回顾性研究表明显示阿司匹林可有效降低肝移植术后晚期(术后1个月后)HAT的发生率,但该研究中阿司匹林起始给药的中位时间过晚,无法评估阿司匹林对早期HAT的影响。Shay等[74]的一项回顾性研究显示,早期HAT发生率和出血事件在阿司匹林组与对照组两组间无统计学差异。但阿司匹林对移植物可能具有保护作用。Shay等[74]的研究中同时提到,阿司匹林组早期HAT导致移植物丢失的发生率显著低于对照组。Oberkofler等[75]的研究显示,在肝移植术后早期应用低剂量阿司匹林可显著降低早期动脉导管闭塞率(阿司匹林组3.7%,对照组12.0%,P<0.001)及总动脉导管闭塞率(阿司匹林组12.0%,对照组22.0%,P=0.001),同时生存分析表明其亦对移植物具有保护作用;但对于出血风险较高受者,研究中在术后阿司匹林的应用上可能存在偏倚;而该研究作为一项多中心回顾性队列研究,不同中心临床实践中采取抗凝治疗的标准可能亦不同。
目前对阿司匹林用药监测的研究主要聚焦于血小板功能测定[76],但尚缺乏高质量证据证明其临床获益。亟须更多随机对照研究验证其效果。
除肝素及阿司匹林,利伐沙班、磺达肝癸钠等抗凝药物也可用于肝移植术后早期的抗凝治疗,华法林等药物亦有可能在肝移植术后的抗凝治疗中起到作用。
利伐沙班属于FXa直接抑制剂,口服生物利用度高[77,78]。目前尚缺乏关于肝移植术后早期应用利伐沙班控制高凝状态的临床研究,但Vuilleumier等[79]曾报道1例利伐沙班相关的肝移植术后大出血;Salerno等[80]报道利伐沙班及达比加群的整体出血风险高于阿哌沙班。因此,为预防出血事件,肝移植术后早期受者在临床上应谨慎应用利伐沙班。
磺达肝癸钠的抗凝机制是通过增强抗凝血酶活性,间接对FXa产生抑制作用[81]。目前尚缺乏关于肝移植术后早期应用磺达肝癸钠控制高凝状态的临床研究。但对于失代偿期肝硬化受者,Zhang等[82]首次报道磺达肝癸钠应用于PVT的抗凝方案。该研究结果显示这一方案可能具有良好的治疗效果与较高的安全性,可能具有应用于肝移植术后早期抗凝治疗的潜力,但该研究纳入样本量过小,亟须更多研究确认其抗凝效果及安全性[83]。
华法林通过影响维生素K依赖的凝血因子合成发挥抗凝效应[84]。Sanchez-Ocaña等[85]的研究表明,长期应用华法林可有效避免肝移植术前或术后PVT复发。然而华法林的抗凝效应平均需要3 d才能达到稳定,且华法林在应用早期会出现一过性高凝状态,故在肝移植术后早期不应使用华法林抗凝[84]。
部分肝移植术后受者(如术前PVT、小儿肝移植术后及因术后并发症行支架植入术受者等)因血管条件不理想等因素,血栓风险较一般受体更高,因此其预防性抗凝方案亦应做出调整。
Gad等[61]建议对术前PVT受者采用更积极的抗凝策略。而Sharshar等[86]建议采用"步进策略" ,即术前按PVT严重程度为受者分级,执行严格的术前评估从而决定是否实施复杂手术;此外,术后持续监测亦十分重要。然而,对于术前PVT受者的术后管理策略,目前仍未达成共识。
通常认为,小儿肝移植术后血栓形成的发生率高于成人,其原因可能包括儿童血管较为纤细、术中吻合难度高等多种因素[19,87]。考虑到较高的血栓风险,目前国内外各中心在小儿肝移植术后多进行预防性抗凝,但不同中心的抗凝方案仍存在较大差异[88]。《儿童肝移植围手术期管理专家共识》推荐小儿肝移植术后早期抗凝首选UFH,持续1~2周后视情况转为口服抗凝药物,同时需密切监测相应指标[87]。不过,部分观察性研究表明,小儿肝移植术后亦具有较高出血风险[89,90]。因此,小儿肝移植术后早期预防性抗凝的临床获益,仍需进一步研究证实。
对于部分肝移植术后发生门静脉及肝动脉狭窄受者,阿司匹林或氯吡格雷常用于支架植入术后支架内血栓形成的长期预防(术后持续用药3个月以上)[91,92,93];部分研究亦在支架植入术后1个月内应用LMWH[92,93]。但目前报道多为经验性用药,缺乏针对肝移植受者支架植入术后抗凝治疗的临床研究。
总之,肝移植术后早期血液高凝状态由多种因素影响,其机制复杂,体内多种因子及生理过程的失衡均参与了这一过程。肝移植术后血栓生成事件的发生与血液高凝状态密切相关,而抗凝不当也可能导致出血事件的发生,故肝移植术后早期应及时、谨慎、科学地运用抗凝治疗。
目前,在肝移植术后早期受者凝血功能这一领域仍有众多问题亟待解决,如高凝状态的具体机制尚未完全阐明、缺乏高质量证据证明抗凝治疗中受者的临床获益等。后续研究可侧重于发生机制及预防性抗凝等方面,阐明高凝状态发生具体机制,同时需进行多中心、大样本、前瞻性随机对照研究验证预防性抗凝效果及其出血风险,以在未来更好地指导临床上肝移植术后出凝血相关并发症预防、诊断及治疗,形成肝移植术后早期受者凝血功能管理的标准化方案。
所有作者声明不存在利益冲突




























