
本文总结了器官移植受者耐药巨细胞病毒(cytomegalovirus,CMV)感染的诊治新进展,包括针对CMV感染的防治药物、耐药CMV的诊断、诊治策略及免疫学治疗策略,旨在为预防和治疗器官移植受者耐药CMV感染提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
巨细胞病毒(cytomegalovirus,CMV)感染是免疫缺陷人群最常见的机会性病毒感染。CMV是一类常见的疱疹病毒,在人类血清中的阳性率为30%~97%[1]。免疫功能正常的人感染CMV后通常表现为短时间的发热或无症状,此后CMV会在多种细胞中呈终生潜伏状态,成为再次活化的储存、携带者或成为易感人群[2]。机体免疫状态良好时,CMV感染者大多数呈隐性感染。但针对造血干细胞移植(hematopoietic stem cell transplants,HSCT)受者、实体器官移植(solid organ transplant,SOT)受者、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者等这类免疫抑制宿主,发生CMV感染的几率不仅远远高于正常人,而且体内潜存的CMV会出现再激活,导致CMV病的发生[1,2]。CMV感染后,不仅通过直接途径损害感染的靶器官、导致组织侵袭性CMV病,还通过间接途径诱发SOT受者的移植物功能丧失、诱发HSCT受者发生移植物抗宿主病(graft-versus-host disease,GVHD),进一步增加其死亡率。由于CMV对移植受者危害严重,关于SOT受者CMV感染诊治的国际指南(以下简称国际指南)将该病毒称为"a transplantation troll",可见,该病毒对移植受者的直接危害和间接危害都很大[1]。随着移植事业的快速发展,CMV病的发病人群也日益增多,其中,耐药CMV的发病率也逐渐增高。耐药CMV感染的移植受者,死亡率显著升高。因此,本文综合国际指南建议及近年来的相关文献,针对耐药CMV诊疗策略方面的新进展进行综述,同时,针对临床面临的实际困境,略谈临床体会。
目前,针对CMV感染的检测手段有多种,其中聚合酶链式反应(polymerase chain reaction,PCR)对CMV-DNA的定量核酸扩增试验(quantitative nucleic acid amplification testing,QNAT)因其高灵敏度和特异性已成为国际指南[1]推荐的首选诊断方法。但是,国内不同平台QNAT检测值在质控、灵敏度、方法学方面均存在差异,而且,目前国际上也缺乏统一的阳性阈值,因此,未来的研究需要在不同移植人群中确定标准检测方法和统一的具有临床意义的阈值。另外,移植后CMV感染发生率报道差异较大,主要因为诊断标准和依据不统一,如何明确CMV在体内的再激活,何时予以抢先治疗,均是临床对于移植受者CMV感染的诊治难点。下表总结了目前针对CMV感染检测手段的临床应用特点及局限性(表1)。

移植患者巨细胞病毒感染常用检测方法
移植患者巨细胞病毒感染常用检测方法
| 检测方法 | 特点和示例 | 临床应用 | 局限性 |
|---|---|---|---|
| 病毒检测方法 | |||
| CMV核酸检测(QNAT法) | 检测并量化CMV核酸,结果以IU/ml报告。例如,罗氏COBAS 6800和8800,凯杰artusⒸ,Altona诊断RealStarⒸ,其他公司自己研发的检测方法 | 快速灵敏诊断CMV感染监测抢先治疗反应预测CMV疾病风险 | 缺乏适用于患者和临床环境的统一病毒载量阈值;检测的可变极限和量化范围、基因靶点和扩增子大小缺乏标准化;具有不同风险特征的患者可能具有不同的病毒阈值 |
| 抗原检测 | 使用单抗检测CMV复制早期白细胞中表达的CMV pp65抗原结果以pp65阳性细胞数/计数白细胞报告 | 检测CMV感染的敏感指标监测抢先治疗的反应预测CMV疾病风险 | 缺乏统一检验标准;样本需要有足够的白细胞(中性粒细胞减少或缺乏会影响结果准确性)对结果解释存在主观性 |
| 病毒培养 | 通过单克隆抗体检测人成纤维细胞(常规细胞培养物)或病毒抗原中的典型细胞病变效应 | 对CMV感染的诊断具有高度特异性;可用于评估抗病毒药物的表型组学检测 | 灵敏度低(与QNAT和抗原血症相比);培养周期耗时长,无法满足临床需求 |
| 细胞学/病理学 | 检测组织样本中的CMV抗原或病毒包涵体 | 组织侵袭性CMV病的诊断金标准 | 需要有创操作获得组织标本 |
| CMV免疫反应的测定 | |||
| 血清学抗体检测 | 主要包括CMV-IgG和IgM检测,可通过补体固定、酶联免疫吸附、放射免疫等手段检测 | 通过对移植受者和潜在供体进行移植前血清学抗体筛查,以获取移植前CMV感染的证据;根据供者和受者的CMV血清学,评估受者CMV感染的风险 | 对于CMV感染的诊断价值有限,不推荐常规使用抗体用于诊断CMV感染;结合移植受者的供受者信息,仅仅作为危险因素分层指标的参考 |
| CMV-特异性T淋巴细胞 | 用CMV抗原进行体外刺激后检测血液或细胞中的INF-γ;主要检测手段包括Quantiferon、ICS、ELISPOT、T-track.CMV等 | 评估移植后CMV疾病风险的指标;指导预防和治疗策略(需要研究来支持这种潜在的适应证) | 检测缺乏标准化;利用这些检测方法进行疾病管理的前瞻性研究和介入试验数量有限 |
注:CMV为巨细胞病毒;IFN-γ为干扰素γ;QNAT为定量核酸扩增试验
目前,临床上常用的抗CMV病毒药物包括静脉注射的更昔洛韦、膦甲酸钠,口服药西多福韦、马利巴韦、缬更昔洛韦等。更昔洛韦是第一个获得美国食品药品监督管理局(FDA)批准的用于预防SOT受者及HSCT受者CMV感染和治疗CMV病的抗病毒药物,随后膦甲酸钠、西多福韦和缬更昔洛韦相继上市。更昔洛韦和缬更昔洛韦为目前最常用的抗病毒药物,也是指南推荐抗CMV感染的一线预防及治疗用药,对CMV感染有较好的抗病毒作用。口服的缬更昔洛韦在体内首先转换为更昔洛韦,后者在体内被转化为三磷酸活化物,再通过抑制病毒DNA复制,从而发挥抗病毒作用。膦甲酸钠、西多福韦也是通过抑制CMV-DNA聚合酶发挥抗病毒作用,马利巴韦主要通过抑制CMV的蛋白激酶发挥抗病毒作用。但这些药物均存在不同程度的毒副作用,如骨髓抑制(主要表现为中性粒细胞、血小板和血红蛋白下降)、肾损害、神经系统毒性、胃肠道副反应等。目前常用的抗CMV药物除了明显毒副作用外,部分患者的CMV病毒株对更昔洛韦、缬更昔洛和磷钾酸钠等药物存在耐药。而长期使用上述抗病毒药物也容易诱导CMV耐药。
在SOT受者中,针对CMV感染的预防方案有两种:普遍预防和抢先治疗。前者是指针对所有SOT受者处于病毒感染的高风险期给予一段时间的抗病毒药物。后者是指针对体内早期检测出有CMV复制、但无相关临床症状的受者应用抗病毒药物,以阻止疾病的进展。目前,不同的移植中心采用不同的预防策略,而很多移植中心采用上述两种策略相结合[3]。
一般来说,CMV对抗病毒药物耐药主要指由于CMV基因突变导致其对1种及以上抗病毒药物失去敏感性。不同人群对CMV天然耐药的发生率不同,耐药的发生主要是针对抗CMV感染的一线药物更昔洛韦/缬更昔洛韦。在接受3个月口服缬更昔洛韦预防用药的SOT受者中,更昔洛韦耐药的发生率约为1.9%~2.2% [4]。理论上讲,更昔洛韦耐药性的产生与延长使用抗病毒药物有关。研究发现,长期使用(平均时间≥5个月)更昔洛韦/缬更昔洛韦预防用药的患者中,耐药CMV的比例增加,约5%~12%;长期小剂量采用缬更昔洛韦口服用药预防CMV感染,可能容易诱导耐药发生。但也有研究显示,长期小剂量采用缬更昔洛韦能够有效预防CMV感染,并未诱发耐药性的发生[5]。因此,针对此观点,目前尚存在一定学术争议。但国际指南推荐,针对高危人群,仍然建议予以长期口服用药进行预防。另外,耐药CMV的发生率在不同器官移植受者中的发生率不同:肺移植受者耐药CMV感染的发生率较高,约18%,小肠移植和多脏器联合移植受者中的发生率更高,约31%,其它器官移植例如肾移植、肝移植、心脏移植受者耐药CMV发生率较低,约<5%;耐药CMV感染可显著增加受者死亡率[6,7]。
有如下情况时应考虑耐药性的产生[4]:(1)接受延长的抗病毒治疗,包括抗病毒预防性用药或抢先治疗;(2)接受全剂量更昔洛韦/缬更昔洛韦治疗≥2周,CMV病的临床症状及体征无明显改善、且病毒载量不减少,或者反而上升;(3)存在其它可致耐药性产生的危险因素。
目前,针对耐药的CMV的治疗手段有限。骨髓毒性、肾毒性以及交叉耐药是目前移植受者抗CMV预防和治疗面临的挑战。由于治疗用的抗病毒药物有限,强烈推荐尽量降低免疫抑制的强度。SOT受者长期使用的免疫抑制剂中,他克莫司是最基本的常规用药,而西罗莫司也属于常用药物。研究发现:与他克莫司相比,西罗莫司与较低的CMV病的发生率存在相关性[8]。可见,西罗莫司可能会在免疫抑制治疗方面发挥有益的补充作用;因此,针对罹患耐药CMV病的SOT受者,可以考虑减少他克莫司剂量、同时联合小剂量西罗莫司,甚至以西罗莫司取代他克莫司。无论CMV感染属于重症或非重症,均应尽快进行耐药基因检测,根据基因型的测定结果来指导药物选择,国际指南推荐的针对耐药CMV的诊治流程详见图1。
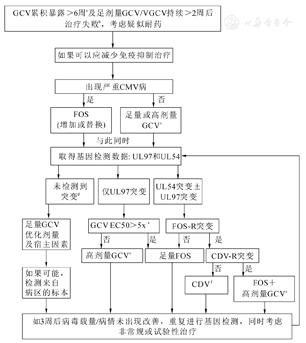

注:GCV为更昔洛韦;VGCV为缬更昔洛韦;CMV为巨细胞病毒;FOS为膦甲酸钠;CDV为西多福韦;EC50为半最大效应浓度;a.6周内少见;b.症状无改善或病毒载量不降;c.根据肾功能选择足量更昔洛韦(5 mg/kg,静脉注射,一日2次)或高剂量更昔洛韦(10 mg/kg,静脉注射,一日2次);d.包括导致<2倍EC50变化的序列变异;e.根据高剂量更昔洛韦成功治疗病例报道,更昔洛韦浓度为5~10倍EC50;f.西多福韦有效性临床研究数据有限,高剂量更昔洛韦是部分突变类型的治疗选择
更昔洛韦/缬更昔洛韦本身并无抗CMV作用,缬更昔洛韦在体内转化为更昔洛韦,之后经过磷酸化活化后才对CMV有作用。更昔洛韦的初始磷酸化是由CMV基因UL97编码的激酶所催化的,细胞内酶对其进行随后的磷酸化,使其成为有活性的更昔洛韦-三磷酸盐,后者可以竞争抑制病毒基因UL54所编码的CMV-DNA聚合酶[9]。因此,UL97或UL54基因的突变会导致耐药性的产生,UL97基因的突变导致的耐药较常见,单独的UL54突变(无UL97突变)比较罕见。UL54基因编码的DNA聚合酶是更昔洛韦、膦甲酸酯和西多福韦等三种常用抗病毒药发挥作用所必需的,其突变导致CMV对这些药物均产生耐药性[10]。更昔洛韦耐药的程度取决于突变位点,可导致高度耐药或低度耐药。UL97和UL54的联合突变通常会导致更昔洛韦的高度耐药,同时对西多福韦、马利巴韦耐药[10]。
膦甲酸钠是治疗UL-97基因突变致更昔洛韦耐药CMV感染的一线药物。然而单用膦甲酸钠存在的主要问题是显著的肾毒性[11]。西多福韦也是具有抗CMV活性的抗病毒药物。尽管尚无西多福韦在治疗SOT受者CMV感染中的对照研究,但相对于更昔洛韦和磷钾酸钠,西多福韦的肾毒性更强。一般来说,UL97基因突变所致更昔洛韦耐药的CMV仍然对膦甲酸钠和西多福韦敏感。由于更昔洛韦、膦甲酸钠及西多福韦通过竞争性抑制UL54基因编码的CMV-DNA聚合酶发挥作用,UL54基因突变可能会导致CMV对其中某些药物或所有药物耐药,而这取决于突变的位点。
新型抗病毒药物莱特莫韦(Letemovir)作用于由pUL56、pUL89和pUL51形成的末端酶复合物,通过抑制DNA的加工和包装,从而抑制CMV复制,因此,该药与其他药物不存在交叉耐药。Letemovir (AIC246)已经在国外完成了Ⅲ期临床研究。目前,莱特莫韦已经获批成人HSCT受者CMV感染的一级预防用药(国内已经上市)[12]。与传统的抗病毒药物相比,莱特莫韦的肾毒性和骨髓抑制的毒副作用显著降低。但需要关注药物之间的相互作用:由于莱特莫韦可以显著升高他克莫司、西罗莫司和环孢素A的血药浓度,因此,在开始使用莱特莫韦时,原有药物剂量需要相应减少[13]。另外,莱特莫韦与抗真菌的三唑类药物之间也有相互作用,需要高度关注。因此,在其他药物不可及或无效时,也可以考虑尝试。尽管马利巴韦被用来治疗几例耐药性CMV病,然而由于在HSCT和肝移植受者人群中的临床试验结果令人失望,其临床开发前景尚不明朗。新型广谱抗病毒药Brincidofovir(布林西多福韦)是西多福韦的前体药物,在体内外对DNA病毒和逆转录病毒有抗病毒作用,具有抗CMV活性;但其在HSCT受者中的临床研究结果显示:该药并未降低CMV感染的全因死亡率,同时却表现出显著的消化系统的毒副作用[14]。
对于存在CMV感染的高危因素、CMV感染的重症患者,单纯采用上述药物预防及治疗,往往难以达到理想的防治效果。研究显示,在进行抗CMV的靶向抗病毒药物治疗的同时,联合采用CMV特异性免疫球蛋白(cytomegalovirus-specific immune globulin,CMVIG)治疗,能显著提高临床疗效、增加CMV转阴率[15,16]。
CMVIG是一种富含高效价抗CMV中和抗体的血浆蛋白制品,由针对人类CMV不同抗原表位的IgG抗体组成。临床研究显示,CMVIG能够发挥重要的蛋白转运和合成功能,提高机体免疫力、促进抗病毒作用。对肾移植受者的研究显示,对于伴有严重淋巴细胞减少及血小板减少症的耐药CMV受者,初始采用大剂量更昔洛韦和膦甲酸钠治疗失败后,改变治疗策略:首先降低免疫抑制剂的使用强度,并同时采用大剂量CMVIG治疗后得到成功救治[15]。另外,近期研究表明,针对存在UL97基因突变的高CMV载量的SOT受者,以莱特莫韦联合CMVIG成功治疗了更昔洛韦耐药的CMV感染。该报道也是新型抗病毒药物莱特莫韦与CMVIG联合方案成功治疗高病毒载量CMV感染的首次报告[16]。在HSCT领域,CMVIG被用于成功治疗1例CMV脑膜炎的受者,证实了鞘内注射高剂量CMVIG和抗病毒药物的联合治疗是安全有效的[17]。由于CMV感染导致中枢神经系统发病是致命性的,死亡率高,因此,鞘内注射CMVIG可能是抗病毒治疗和过继免疫细胞治疗外的一种治疗手段。对于SOT受者人群,近年来多项研究显示,针对心脏移植、肺移植等胸腔脏器移植受者,采用CMVIG联合抗病毒药物,不仅可有效预防CMV病,而且能够治疗耐药CMV病。而且,针对肺移植受者,采用CMVIG联合抗病毒药物治疗,还可以降低慢性移植肺失功的发生率、降低CMV病相关病死率。目前的观点认为,针对CMV感染的高危人群,例如肺移植、心脏移植、小肠移植等受者,在常规用药的基础上加用CMVIG,能提高临床疗效和CMV转阴率。
近期研究表明,输注CMV特异性T淋巴细胞(virus-specific T cell,VST)可预防或治疗CMV病。VST的治疗机理在于直接重建CMV特异性T淋巴细胞的免疫功能。早在1991年,Riddell等[18]在HSCT受者中进行了相关研究,对供者骨髓来源的CMV-特异性CD8+T淋巴细胞在体外进行克隆扩增后产生大量的VST,再输入受者体内,对HSCT受者的CMV感染有预防及治疗作用。近年来CMV-VST的治疗价值也逐渐被认可,尤其是针对HSCT受者耐药CMV病或者顽固性CMV病,VST能有效预防、治疗并清除体内的CMV,治疗的应答率高达94.1%,CMV-VST也已经被用于治疗CMV中枢神经系统感染[19]。然而,在SOT领域,CMV-VST曾尝试用于对更昔洛韦耐药CMV病的治疗,疗效尚存在差异。对肺移植受者的观察显示,罹患CMV肺炎的肺移植受者接受输注自身的VST治疗后,虽然CMV一度得到了清除,后续却出现了移植肺的排斥反应[20]。近年来,对其它SOT受者进行前瞻性研究显示,罹患耐药CMV病的SOT受者,输注与受者自身HLA相容的VST后,该特异性T淋巴细胞在体内扩增后,不仅可以有效清除血液及受累脏器中的CMV,而且可以减少CMV抗病毒药物的使用剂量[21]。因此,针对HSCT及SOT受者耐药CMV病或难治性CMV病,VST是目前较有前景的治疗手段。
CMV感染不仅直接损害感染的靶器官,还可间接诱发移植物失功,是移植受者死亡的重要原因,而耐药CMV的感染,死亡率更高。移植受者耐药CMV感染具有其特殊性,其诊治策略与普通CMV感染存在差异。本文总结了耐药CMV感染的诊治新进展,包括针对CMV感染的防治药物、耐药CMV的诊断、药物治疗及免疫学治疗策略,旨在为移植受者耐药CMV感染的防治提供参考。
所有作者均声明不存在利益冲突



























