
本研究就钠-葡萄糖耦联转运体2抑制剂的肾脏保护机制及在肾移植合并糖尿病受者中应用的有效性和安全性作一综述,旨在将其应用于肾移植受者以改善预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
糖尿病是肾移植后常见的慢性合并症,约50%的肾移植受者需要降糖治疗[1]。肾移植合并糖尿病包括肾移植术前已确诊的糖尿病及肾移植术后新发糖尿病(posttransplant diabetes mellitus,PTDM)。血糖水平异常与器官移植受者的移植物功能、感染、心血管并发症和死亡风险密切相关。钠-葡萄糖耦联转运体2(sodium-glucose transport protein2,SGLT2)抑制剂主要通过阻断近端肾小管的葡萄糖重吸收来增加尿糖排泄,抑制葡萄糖摄取,发挥降糖作用[2]。本文就SGLT2抑制剂的降糖机制、肾脏保护及在肾移植合并糖尿病受者中的临床应用现状作一综述。
糖尿病肾病(Diabetic kidney disease,DKD)发病率逐年升高,造成终末期肾病发病率逐年增加,其中部分患者选择了肾移植治疗。同时PTDM是常见的移植后内分泌代谢紊乱并发症之一,在移植后1年的发生率为5.5%~60.2%[3]。PTDM与移植后心肌梗死、脑血管意外以及与主动脉或下肢动脉疾病的发生关系密切[4]。
PTDM发生的危险因素由移植前的危险因素及移植特异性风险构成(图1)。移植前危险因素包括年龄、种族、家族史、遗传背景、体重、病毒感染,移植后免疫抑制药物的使用包括钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)、类固醇和雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂是与PTDM风险增加相关的特定因素[5]。


注:HLA为人类白细胞抗原;PTMD为肾移植术后新发糖尿病;CNI为钙调磷酸酶抑制剂;mTOR为雷帕霉素靶蛋白
CNI是肾移植术后常用的免疫抑制剂,通过影响钙调神经磷酸酶/活化T淋巴细胞核因子信号通路抑制胰腺细胞生长和功能,促进PTDM[6]。随CNI的浓度增加,糖尿病的风险愈大,而他克莫司比环孢素A更易引起血糖代谢异常。他克莫司可通过激活BMP/Smad及细胞外信号调节蛋白1/2(extracellular signal-regulated kinase 1/2 ERK1/2)信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路和抑制哺乳动物mTOR磷酸化水平及下游信号通路等途径减少胰岛素的释放[7]。他克莫司通过影响胰岛素重吸收障碍导致胰岛素抵抗。Jin等[8]的研究证实,他克莫司可诱导大鼠肾小管上皮细胞SGLT2表达增加2倍,恩格列净降低肾小管上皮细胞SGLT2表达,抑制葡萄糖在肾小管重吸收,减轻他克莫司诱导的糖尿病肾脏疾病。
目前临床肾移植合并糖尿病的治疗方式包括改善生活方式、调整免疫抑制方案及降糖药物治疗。改善生活方式的降糖程度是有限的,移植术后需免疫抑制剂抗排斥反应,所以降糖药物是多数肾移植合并糖尿病受者的必然选择。常用于移植后降糖药物包括口服降糖药(双胍类、磺脲类、格列奈类、二钛基肽酶-4抑制剂及α葡萄糖苷酶抑制剂)、胰高血糖素样肽-1受体激动剂和胰岛素。口服降糖药中二甲双胍被推荐为肾功能正常时PTDM一线用药,但临床应用中需注意其胃肠道反应及乳酸酸中毒的风险,瑞格列奈被推荐为肾功能异常受者的首选降糖药物[5]。上述药物具有确切的降糖证据,但对于器官移植物存活及受者长期存活的影响缺乏大规模临床数据支持。
钠-葡萄糖耦联转运体(sodium-glucose transport protein,SGLT)由溶脂载体5A家族基因编码,与葡萄糖转运所需的辅助蛋白MAP17耦联[9],SGLT2位于近端小管的S1/S2段,重吸收肾脏90%的葡萄糖及65%的钠,SGLT1分布在肾脏近曲小管S3段,重吸收其余10%的葡萄糖[2]。SGLT2抑制剂的糖苷配基通过与葡萄糖竞争性结合近端小管SGLT2蛋白,减少肾脏重吸收葡萄糖和钠,降低肾糖阈,促进排泄尿糖、尿钠和水分,从而改善血糖和容量负荷。Kasichayanula等[10]的研究证实,2型糖尿病(type 2 diabetes mellitus,T2DM)患者服用达格列净(10 mg/d)每日可稳定增加尿糖70 g左右。Ji等[11]的研究证实,服用达格列净(10 mg/d)24周,糖化血红蛋白(glycosylated hemoglobin,HbA1c)可降低1.11%。Inagaki等[12]研究证实,服用卡格列净(100 mg/d)16周后HbAlc可降低0.97%。上述研究提示,SGLT2抑制剂通过促进尿糖排泄,产生较好的降糖作用。
SGLT2抑制剂在DKD和非糖尿病肾脏疾病中具有肾脏保护作用,包括血流动力学和非血流动力学机制。SGLT2抑制剂通过调节管球反馈、改善肾小球高滤过状态发挥血流动力学作用;通过改善氧化应激、多重代谢因素、炎症反应等减轻因非血流动力学因素引起的肾脏损害[13]。
肾小球高滤过是慢性肾脏病(chronic kidney disease,CKD)进展的重要机制。在T2DM患者肾组织中,近端肾小管SGLT2 mRNA及蛋白水平表达上调,肾脏重吸收葡萄糖和钠增加,流经致密斑钠离子减少,入球小动脉扩张,出球小动脉收缩,引起肾小球高灌注、高压力、高滤过状态,促使内皮损伤、基底膜增厚,逐渐发生肾小球硬化。SGLT2抑制剂可通过减少近端肾小管钠离子重吸收,流经致密斑钠离子增加,通过调节管球反馈,入球小动脉收缩,减轻肾小球局部高灌注、高滤过[14],发挥肾脏的血流动力学保护作用。
mTOR是一种高度保守的丝氨酸/苏氨酸蛋白激酶,与不同蛋白结合形成雷帕霉素靶蛋白复合体(mechanistic target of rapamycin complex,mTORC),包括mTORC1和mTORC2。mTORC1可影响肾脏能量代谢及氧化应激。Tomita等[15]在高脂饮食喂养的载脂蛋白E(apolipoprotein E,ApoE)基因敲除的DKD小鼠模型中证实,近端小管mTORC1的靶点过度激活,小管上皮三磷酸腺苷(adenosine triphosphate,ATP)的生成从葡萄糖的氧化代谢转变为酮体分解,小鼠肾脏ATP水平降低,肾小球损伤和肾小管炎症及间质纤维化明显加重。恩格列净喂养的ApoE-/-小鼠,mTORC1信号通路的过度激活被抑制,酮体水平增加,肾脏缺氧状态明显改善。db/db小鼠模型中补充恩格列净可通过抑制mTORC1信号通路的过度激活,减轻足突融合,改善足细胞损伤。
低氧诱导因子(hypoxia-inducible factor HIF)信号紊乱与DKD发病机制有关。HIF包括HIF-1α和HIF-2α两种亚型。HIF-1α可促进血管生成、炎症纤维化、受损线粒体自噬,抑制组织细胞内耗氧。HIF-2α刺激促红细胞生成素增加、减轻肾脏纤维化、促进过氧化物酶体自噬清除、减少氧气利用率[16]。DKD时HIF-1α过度激活,但HIF-2α表达受到抑制[17]。Bessho等[18]研究证实,常氧状态下,db/db小鼠近端肾小管上皮细胞中微弱表达HIF-1α,缺氧预处理(1% O2)诱导肾小管上皮细胞HIF-1α表达增加,鲁格列净(100 μmol/L)抑制缺氧诱导的肾小管HIF-1α蛋白及靶基因表达,减轻小鼠的肾小管间质纤维化(P<0.05)。Takagi等[19]的研究证实,SGLT2抑制剂通过模拟低氧状态,促进沉默信息调节因子1/腺嘌呤核糖核苷酸活化蛋白激酶信号激活,刺激HIF-2α表达,促进肾小管线粒体生成,增加ATP,减轻肾损伤。
大量临床研究证实SGLT2抑制剂可有效降低尿蛋白,延缓估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)下降,为非移植患者带来肾脏保护[20,21]。卡格列净与糖尿病合并肾病患者的肾脏事件之间关系的临床评价(Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation,CREDENCE)研究随访4 401例合并CKD的T2DM患者,研究证实卡格列净可降低肾脏主要复合结局(终末期肾病、血清肌酐倍增、肾性或心血管性死亡)的发生率30%[20]。达格列净与慢性肾脏病患者不良结局的预防(Dapagliflozin and Prevention of Adverse Outcomes in Chronic Kidney Disease,DAPA-CKD)纳入4 304例2~4期CKD患者,结果证明达格列净显著降低肾脏特异性复合终点(eGFR下降≥ 50%,进展至肾终末期,肾性死亡)风险44%,心血管复合终点(心血管死亡或心衰住院)风险29%,全因死亡风险31%[21]。
上述研究提示SGLT2抑制剂对DKD及NDKD具有心肾双重获益,然而目前已知的大型临床研究均将肾移植合并糖尿病受者作为排除标准,仅有少量小样本研究证实SGLT2抑制剂治疗在肾移植受者中的疗效及安全性。
目前学者在肾移植合并糖尿病受者中开展了SGLT2抑制剂的小样本临床研究,这些研究证明肾移植受者使用SGLT2抑制剂具有一定的降糖及肾脏保护作用,但也可能引起一些不良反应(表1)。
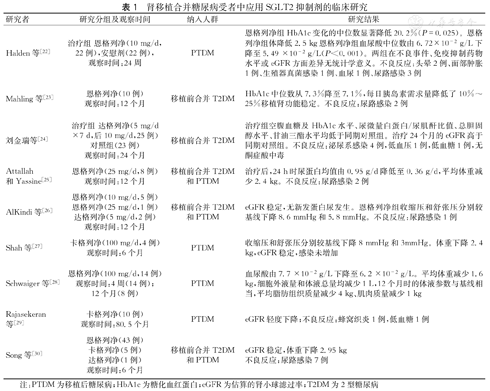
肾移植合并糖尿病受者中应用SGLT2抑制剂的临床研究
肾移植合并糖尿病受者中应用SGLT2抑制剂的临床研究
| 研究者 | 研究分组及观察时间 | 纳入人群 | 研究结果 |
|---|---|---|---|
| Halden等[22] | 治疗组 恩格列净(10 mg/d,22例),安慰剂(22例),观察时间:24周 | PTDM | 恩格列净组HbA1c变化的中位数显著降低20.2%(P=0.025)。恩格列净组体降低2.5 kg恩格列净组血尿酸中位数由6.72×10-2 g/L下降至5.49 ×10-2 g/L(P<0.001)。两组在不良事件、免疫抑制药物水平或eGFR方面差异无统计学意义。不良反应:头晕2例、面部肿胀1例、生殖器真菌感染1例、血尿1例、尿路感染3例 |
| Mahling等[23] | 恩格列净(10例)观察时间:12个月 | 移植前合并T2DM | HbA1c中位数从7.3%降至7.1%,每日胰岛素需求量降低了10%~25%移植肾功能稳定。不良反应:尿路感染2例 |
| 刘金瑞等[24] | 治疗组 达格列净(5 mg/d×7 d,后10 mg/d,25例)对照组(23例)观察时间:24个月 | 移植前合并T2DM | 治疗组空腹血糖及HbA1c水平、尿微量白蛋白/尿肌酐比值、总胆固醇水平、甘油三酯水平均低于同期对照组。治疗24个月的eGFR高于同期对照组。不良反应:泌尿系感染4例,低血压1例,低血糖1例,无酮症酸中毒 |
| Attallah和Yassìne[25] | 恩格列净(25 mg/d,8例)观察时间:12个月 | 移植前合并T2DM和PTDM | 治疗后,24 h时尿蛋白均值由0.95 g/d降低至0.36 g/d,平均体重减少2.4 kg。不良反应:尿路感染2例 |
| AlKindi等[26] | 恩格列净(10 mg/d,5例)恩格列净(25 mg/d,1例)达格列净(5 mg/d,2例)观察时间:12个月 | 移植前合并T2DM和PTDM | eGFR稳定,无新发蛋白尿发生。恩格列净组收缩压和舒张压分别较基线下降8.6 mmHg和5.8 mmHg。不良反应:尿路感染1例 |
| Shah等[27] | 卡格列净(100 mg/d,4例)观察时间:6个月 | PTDM | 收缩压和舒张压分别较基线下降8 mmHg和3mmHg。体重下降2.4 kg,eGFR稳定,感染未增加 |
| Schwaiger等[28] | 恩格列净(100 mg/d,14例)观察时间:4周(14例);12个月(8例) | PTDM | 血尿酸由7.7 ×10-2 g/L下降至6.2 ×10-2 g/L。平均体重减少1.6 kg,细胞外液量和体液总量均减少1 L,12个月时的体液参数与基线相当,平均脂肪组织质量减少4 kg、肌肉质量减少1 kg |
| Rajasekeran等[29] | 卡格列净(10例)观察时间:80.5个月 | PTDM | eGFR轻度下降;不良反应:蜂窝织炎1例,低血糖1例 |
| Song等[30] | 恩格列净(43例)卡格列净(5例)达格列净(1例)观察时间:6个月 | 移植前合并T2DM和PTDM | eGFR稳定,体重下降2.95 kg不良反应:尿路感染7例 |
注:PTDM为移植后糖尿病;HbA1c为糖化血红蛋白;eGFR为估算的肾小球滤过率;T2DM为2型糖尿病
Halden等[22]的研究纳入44例PTDM受者,分别予恩格列净(22例)及安慰剂(22例)治疗,恩格列净组HbA1c变化的中位数降低20.2%(P=0.025)。Mahling等[23]纳入10例合并T2DM肾移植受者的研究显示,使用恩格列净12个月后HbA1c中位数从7.3%降至7.1%,每日胰岛素需求量降低了10%~25%。刘金瑞等[24]的研究纳入48例肾移植前合并T2 DM受者,分为达格列净+基础降糖组(25例)及基础降糖组(23例),治疗24个月观察达格列净组空腹血糖及HbA1c水平均低于同期对照组。
Attallah和Yassìne[25]对8例肾移植受者进行回顾性研究,其中包括移植前确诊T2DM(4例)和PTDM(4例)受者,在接受肾素-血管紧张素-醛固酮系统抑制剂的基础上予恩格列净(25 mg/d)降糖,治疗12个月后,24 h尿蛋白均值由0.95 g/d降低至0.36 g/d。
AlKindi等[26]研究在6例肾移植受者使用恩格列净,随访12个月,收缩压和舒张压分别较基线下降8.6 mmHg和5.8 mmHg。Shah等[27]在24例肾移植受者中使用卡格列净(100 mg/d)治疗6个月,收缩压和舒张压分别较基线下降8 mmHg和3 mmHg。SGLT2抑制剂通过排钠利尿、降低动脉硬化、减少交感神经活动等发挥降压作用[31]。
Schwaiger等[28]报告14例PTDM患者在使用恩格列净4周后,血尿酸水平由458.15 μmol/L下降至368.9 μmol/L(P=0.03)。研究表明,近端小管中葡萄糖与尿酸竞争性结合葡萄糖转运蛋白9(glucose transporters 9,GLUT9)亚型2(GLUT9b),SGLT2抑制剂增加尿糖排泄,GLUT9b更多地与葡萄糖结合,因此尿酸与GLUT9b结合减少,重吸收减少,从而导致血尿酸降低[32]。
Xu等[33]研究证实,SGLT2抑制剂可促进饮食诱导的肥胖小鼠氧耗增加及白色脂肪棕色化。Schwaiger等[28]的研究,纳入14例PTDM受者服用恩格列净4周,平均体重减少1.6 kg(P=0.02),12个月时的体液参数与基线相当。SGLT2抑制剂通过促进尿糖排出,相关热量损失约300 kcal/d,渗透性利尿约0.4 L/d[34]。SGLT2抑制剂减重主要归因于渗透性利尿和通过尿糖排泄减少热量。
在肾移植受者中使用SGLT2抑制剂主要问题包括容量稳态和急性肾损伤风险,以及感染性并发症,同时需考虑药物与CNI药物之间的相互作用。CNI通过细胞色素P450 3A4 (CYP3A4)代谢,与CYP3A4通路相互作用的药物可以改变CNI药物浓度。在美国食品药品监督管理局及欧洲药品监督管理局评估文件中,未发现卡格列净、达格列净或恩格列净与移植相关药物的相互作用[35]。Halden等[22]证实,SGLT2抑制剂并不影响免疫抑制药物水平。Shah等[27]的研究表明卡格列净不会改变他克莫司的谷值浓度。
Halden等[22]的研究中,44例PTDM受者服用恩格列净,发生头晕2例、面部肿胀1例、生殖器真菌感染1例、血尿1例、尿路感染3例。Attallah和Yassìne[25]的研究中,8例PTDM受者使用恩格列净,其中有2例发生泌尿系感染。Song等[30]研究共纳入50例PTDM受者,14%的受者在使用SGLT2抑制剂后平均69.4天出现泌尿系感染。所有上述肾移植术后的临床观察中均未发生酮症酸中毒及截肢事件。
综上所述,SGLT2抑制剂是具有心肾双重获益的新型降糖药,现有的研究中证实与传统降糖药相比,该药对肾移植合并糖尿病受者具有血糖控制、蛋白尿减轻、血压降低、血尿酸下降、体重减轻、移植肾功能的稳定的优点,但也可能引起不良反应,如增加泌尿系感染及低血糖等风险。此类药物的临床使用给器官移植受者的治疗带来了新的选择,但仍需大规模随机对照研究来明确相关药物的疗效和安全性,从而使器官移植受者从这一新药中受益。
所有作者均声明不存在利益冲突































