
神经源性吞咽障碍是一种常见的神经系统疾病的并发症,预后差且治疗方法有限。因此,将神经刺激的基础研究转化为临床应用成为当务之急。本文重点介绍咽腔电刺激(pharyngeal electrical stimulation,PES)技术在人类吞咽运动系统中的治疗应用,阐明咽腔电刺激调控吞咽功能的机制,通过大量研究结果证明该刺激能够增加咽部运动皮质的兴奋性,该技术在神经源性吞咽障碍已经完成和正在进行的临床研究也可窥见一斑。尽管目前的研究结果提示咽腔电刺激技术是一种具有广阔临床应用前景的神经调控干预手段,但仍需要进行更多的临床研究,以便充分地探索其潜在用途。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经系统疾病继发吞咽障碍是临床常见问题之一,目前的治疗方法和疗效仍然有限。此类神经源性吞咽困难不仅会造成患者的喂养困难(涉及最佳喂养时间、喂养方法的选择),严重者甚至会增加死亡率。神经源性吞咽障碍主要发生于脑卒中后,同时也涉及帕金森病、多发性硬化症、头部外伤等疾病。脑卒中后吞咽障碍的发病率约50%,最常见的症状是误吸,可增加3倍的死亡风险[1]。部分患者的吞咽功能可在发病数周后自然恢复,但对尚无法自愈的患者传统治疗和肠内营养难以达到让人满意的疗效。研究表明,存在误吸的患者发生肺部感染的相对危险程度是无合并误吸患者的2.47倍[2]。目前本课题组尚未发表的研究结果显示,误吸患者死亡的相对危险程度是无合并误吸者的2.7倍(P>0.001);还有研究显示,脑卒中后吞咽障碍在内的需要肠内营养支持的患者,30 d的早期死亡率高达28%[3]。虽然全球针对吞咽功能的研究已经开展了数十年,也取得了一定的成果,但仍然存在诸多问题,例如研究课题数量少、样本量低、缺乏高水平的实验研究、随访评估期过短、评估标准不够确切统一、实验设计缺乏足够的科学依据等。有鉴于此,临床应用亟需行之有效的治疗方法[4],而目前在欧洲各国临床应用的咽腔电刺激(pharyngeal electrical stimulation,PES)展示了良好的疗效,应用前景广阔,但在中国从事吞咽障碍评估与治疗的专业人士却知之甚少。本文围绕PES的基本概念、临床应用及研究现状等进行介绍。
PES是一种周围神经调控技术,即将电脉冲通过悬置在咽部表面的电极导管被输送到咽部粘膜而发挥作用[5]。目前,PES确切的作用机制尚未完全阐明,但其作用外周途径已基本清楚,主要是通过PES激活粘膜内的感觉(可能还有传入运动)神经。这些感觉神经包括面神经、舌咽神经、迷走神经和颅神经等,PES刺激咽部粘膜的信息(烧灼样)会被传送至脑干中的孤束核以及更高级的吞咽中心——大脑皮质和皮质下,由脑干来处理传入的信息。受传入神经支配的孤束核与周围神经传出网络密切关联[6],并以此在脑干水平将感觉输入和协调运动输出连接起来。然而,感觉输入和运动皮质、皮质下区域的连接机制尚不清楚[5]。通过这些复杂的相互连接,PES影响吞咽皮质运动信号输出,见图1。
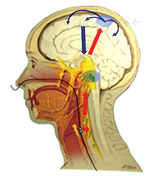

注:红色箭头为感觉信号传入,蓝色箭头为运动信号输出
研究证明,PES可增加咽部运动皮质的兴奋性[7]。1998年,Hamdy等[8]第一次证明,PES可激发健康受试者的运动皮质兴奋。2002年,Fraser等[7]进行了一系列不同PES频率影响皮质兴奋性的研究,证明了与10 Hz、20 Hz和40 Hz相比,5 Hz的频率在75%的最大耐受强度下能产生最佳兴奋效应。功能性磁共振成像研究证实,PES可增加脑卒中后急性吞咽困难患者吞咽感觉运动皮质区域的活动[7],且主要增强未受损的大脑半球的活动。随后Fraser等[7]对16例脑卒中后吞咽困难患者进行了第二阶段的随机试验,治疗组应用最优PES治疗参数(频率5 Hz,75%的最大耐受强度持续10 min),并采用咽部运动诱发电位(motor evoked potential,MEP)和吞咽造影检查(video fluoroscopic swallowing study,VFSS)评估治疗结果,结果提示,PES干预治疗后咽运送时间缩短,渗透-误吸量表(penetration aspiration scale,PAS)评分降低,且误吸的改善与吞咽皮质兴奋性的增加呈显著正相关性。因此该研究的结论是,增加咽部的感觉输入可促进脑损伤后神经可塑性和功能恢复。在神经化学研究中,PES也被证明可增加唾液中P物质的水平,P物质是一种与促进吞咽有关的神经肽[9]。2016年Magara等[10]针对14例健康受试者的研究发现,与假刺激组相比,PES真刺激可引起更持久的咽部皮质兴奋。
2010年,Jayasekeran等[11]对PES的剂量进行了研究,该研究将急性脑卒中后吞咽障碍患者22例根据脑卒中的严重程度和年龄因素分为5个治疗组,结果显示,每日1次,每次刺激10 min,连续治疗3 d为PES的最佳干预方案[11]。随后,Jayasekeran等[11]开展了第二阶段的临床PES随机对照试验,将急性脑卒中后吞咽障碍患者28例随机分为PES干预组和假刺激组,主要评估标准为吞咽造影检查的PAS评分,次要标准为吞咽困难严重程度评定量表以及住院时长。结果显示,PES干预组的PAS评分和吞咽困难严重程度评分显著下降,而住院时长也明显缩短。2016年,Vasant等[12]对发病6周内的急性脑卒中后吞咽障碍患者36例进行了后续长达4年的多中心随机对照试验。本研究与Jayasekeran等研究的主要区别在于,患者脑卒中病情更重,吞咽困难严重程度评定量表是主要评估标准,PAS是次要评估标准;结果显示,干预2周后,PES真刺激组的吞咽困难严重程度评定量表评分和PAS评分有改善的趋势,但由于该研究没有招募到理想数量的患者,假刺激组和实验组的主次评估结果组间差异均无统计学意义(P>0.05)。2015年Scutt等[13]发表了一篇关于脑卒中后吞咽障碍PES研究的Meta分析,结果也提示,干预2周后,PES组的PAS和吞咽困难严重程度评定量表评分与假刺激组同时间点比较,差异均有统计学意义(P<0.05),虽然2组患者住院时间没有统计学差异,但趋势仍然具有提示意义。
2016年,Bath等进行了大规模的多中心随机对照试验(Swallowing Treatment Using Pharyngeal Electrical Stimulation,STEPS)[14],研究涵盖了来自英国和其他欧洲国家等15个医疗机构的脑卒中后吞咽障碍患者162例,该研究结果提示,PES干预后2周和3个月时,真刺激组的PAS评分与假刺激组同时间点比较,差异无统计学意义(P>0.05)。对于这个结果,该课题组认为这可能是由于接受治疗的患者以轻度吞咽障碍为主,而这些轻度的吞咽障碍是有较大的自愈可能性,所以假刺激组也呈现了明显的吞咽功能改善,这些情况均可能掩盖了PES相关的改善作用。目前,另一个大型随机对照试验(Pharyngeal Electrical Stimulation Evaluation for Dysphagia after Stroke,PHEED)正在研究PES对脑卒中后吞咽困难的影响[15],该研究的目的是纠正早期随机对照试验中发现的一些问题,其中最主要的措施是招募病情更为稳定和更为严重的脑卒中后吞咽障碍患者。该研究初步的研究结果提示,PES对脑卒中后吞咽障碍的治疗的确有一定改善作用。这项正在进行的PHEED试验的结果应该会为PES研究提供更为清晰明确的方向。
2018年,Dziewas等[16]进行了多中心PHAST-TRAC(Pharyngeal electrical stimulation for early decannulation in tracheotomised patients with neurogenic dysphagia after stroke)三期临床随机对照试验研究,脑卒中气管切开术后患者69例被招募并随机分成2组。其中一组接受PES真刺激干预,而另一组接受假刺激干预,结果发现,接受PES真刺激组患者达到拔除气管插管水平的人数明显多于假刺激组,但2组间严重不良反应发生情况组间比较,差异无统计学意义(P>0.05)。近期,Koestenberger等[17]对一系列气管插管的ICU患者进行了PES研究,并观察评估了这些患者包括肺炎发病率在内的临床结果,这是规模更大的欧洲注册性研究PHADER(Pharyngeal Electrical Stimulation for Treatment of Neurogenic Dysphagia: a European Registry)的一部分。研究将PES应用于15例混合病因的经口插管患者,并与25例对照组进行比较,结果发现,与对照组比较,经PES治疗的患者,其肺炎发生率明显降低,需要再次插管率也显著降低,差异均有统计学意义(P<0.05)。
PES治疗也可应用于其他疾病引起的吞咽困难的研究。Restivo等[18]的研究比较了PES真、假刺激对多发性硬化患者的疗效,与假刺激组相比,PES真刺激组的PAS评分在治疗后即刻、治疗后2周和治疗后4周,与假刺激组同时间点比较,差异均有统计学意义(P<0.05)。2013年,Michou等[19]对恢复期脑卒中合并吞咽困难患者18例进行了单次PES干预研究,结果发现,单次剂量的PES对恢复期的脑卒中吞咽困难亦有改善吞咽功能作用,PES干预组的咽部运动皮质兴奋性显著增加,而PAS评分亦显著降低,且2项指标与假刺激组比较,差异均有统计学意义(P<0.05)。
综上所述,PES是一种具有广阔的临床应用前景的神经调控干预手段。对神经性吞咽障碍有一定疗效,但其确切中枢作用机制仍需进行更多的研究,以便更充分地探索其应用价值。



























