
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
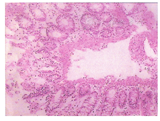
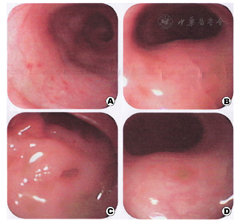
例1 男,3 d,生后面色发绀、气促、哭吵不安,在生产医院治疗无效于2012年10月入本院。患儿系G8P2孕38+3周剖宫产,羊水胎粪污染,脐带绕颈1周,出生体重3 kg,Apgar评分:1~8分,5~9分。其母38岁,人工流产3次,自然流产3次,否认此次孕期感染史。入院体查:体温37.5 ℃,呼吸62次/min,脉搏140次/min,体重2.95 kg。足月儿貌,稍易激惹,哭声响亮,皮肤无黄染,前囟平软,双肺呼吸音粗,可闻及少许湿罗音,心腹无异常,四肢肌张力可,原始反射引出不完全。辅助检查,血常规:白细胞24.6×109/L,中性比值0.716,血红蛋白182 g/L;血气分析示Ⅰ型呼衰;胸片示肺炎;CRP 19.2 mg/L;ESR 11 mm/h。入院诊断:新生儿重症肺炎并Ⅰ型呼吸功能衰竭,新生儿败血症。后经腰穿脑脊液检查排除"化脓性脑膜炎"。入院后予抗感染及对症支持治疗,患儿病情一度好转,复查血常规及CRP均正常。入院第18天病情反复,出现发热,体温最高达39 ℃,拒奶,哭闹,无明显呼吸道症状,病情进行性加重,于第21天解黄稀水样便,10+次/d,伴血及黏液。调整抗生素(最强时为万古霉素与亚胺培南、氟康唑、甲硝唑联合应用),静脉用丙种球蛋白(2.5 g×5 d),维持水电解质平衡,改腹泻奶和减量喂养至完全禁食等综合治疗,病情仍进行性加重,并出现腹胀,肠鸣音减弱。第2次复查脑脊液正常,胸片示肺炎好转,腹部立位片未见特异性改变。但血常规示白细胞进行性升高,最高达126.8×109/L;多次大便常规见红细胞和白细胞,黏液、潜血阳性,轮状病毒抗原阴性,大便培养阴性;骨髓片示骨髓增生明显活跃,粒系增生明显活跃,红系增生明显减低,血片中可见幼粒细胞,可见中毒颗粒。体液免疫发现IgE↑(412.10 KIU/L),补体C3、C4↓,余正常;食物过敏原筛查阴性;行结肠镜检查发现横结肠以下黏膜充血水肿,点片状糜烂,并发现数个溃疡,最大为0.5 cm×0.5 cm(图2);送两处病理活检:黏膜明显水肿、血管扩张充血、部分黏膜坏死脱落伴有较多炎症细胞浸润,以淋巴细胞为主,结合临床符合黏膜慢性炎症伴有溃疡形成(图1、图2)。于第49天考虑"炎症性肠病"加用糖皮质激素[甲泼尼龙2 mg/(kg·次)],停万古霉素,微量母乳喂养(3 ml/次)。随后病情迅速好转,外周血白细胞、CRP逐渐下降,大便次数及性状好转。甲泼尼龙逐步减量于第59天(用药第10天)改为泼尼松2 mg/kg分3次口服,第61天带药出院,随访指导激素逐步减量至用药30 d停药。继续随访至今,生长发育、大便情况均良好。


例2 男,14 d,因"口腔疱疹、发热6 d"于2016年10月入院。曾当地医院抗感染等治疗6 d,口腔疱疹稍好转,但体温反复。G2P1孕40周顺产,出生体重3.5 kg,其母人工流产1次,孕期无异常。查体:体温36.4 ℃,呼吸45次/min,脉搏146次/min,体重3.72 kg。精神反应可,颈部可见散在红色皮疹,前囟平软,上颚有散在白色疱疹,双肺呼吸音粗,无罗音,心腹无异常,四肢肌张力可,原始反射可引出。辅助检查,血常规:白细胞16.81×109/L,中性比0.341,血红蛋白124 g/L,血小板452×109/L;CRP 27.68 mg/L;ESR 42 mm/h;降钙素原0.16 ng/ml;胸片示肺炎。入院诊断:新生儿败血症,新生儿肺炎,疱疹性口腔炎,新生儿脓疱病。两次查脑脊液均正常,但头颅MRI提示双侧颞部化脓性脑膜炎并颞部少量硬膜下积液改变,后颅窝少量硬膜下血肿。入院先后予头孢吡肟、美罗培南+万古霉素+氟康唑抗感染,口腔护理等对症支持治疗,仍反复发热,外周血白细胞、CRP无好转,狼疮全套:核小体抗体、双链DNA抗体、抗组蛋白抗体均可疑阳性;食物过敏源IgE阴性;T淋巴细胞亚群:总T淋巴细胞稍高,Th/Ts偏低;免疫全套:IgG、IgM、IgA稍高,IgE 213 IU/ML(参考值<15 IU/ML),CRP 21.6 mg/L;高IgE综合征基因检测未见异常。于住院第12天发现肛周脓肿,外科切开引流后,有反复流脓,并出现肛瘘。第27天口腔疱疹基本愈合。第33天出现腹泻、腹胀,改氨基酸奶粉及减量喂养至完全禁食等治疗,病情仍加重,并出现体重下降。查大便病毒及培养均为阴性,CRP进行性升高,最高达71.25 mg/L,家属拒绝完善结肠镜,住院39 d无好转,家属要求出院。出院后第3天因病情加重入本院PICU科。查体:体重3 kg,营养不良,腹部皮下脂肪菲薄,肛门左侧伤口有流脓。查血气示代谢性酸中毒合并呼吸性碱中毒、低钾;血常规:白细胞19.81×109/L;CRP 179.99 mg/L;降钙素原1.59 ng/ml;IL-6 233.7 pg/ml;予美罗培南、万古霉素抗感染,维持内环境稳定等治疗,发热、腹泻、腹胀无好转。住院第6天因呼吸衰竭行气管插管,第8天呼吸机机械通气下血氧饱和度逐渐下降,心率、血压不稳定,顽固性代谢性酸中毒,多次抢救无效,放弃治疗后死亡。死亡后20 d亚全外显子基因结果回报:该样本在炎症性肠病28型相关基因(IL10RA),发现两处杂合突变(c.301C>T、c.493C>T),家系验证结果显示两个突变分别来自父母双方,父母均为杂合突变(表1)。

病例2亚全外显子基因结果
病例2亚全外显子基因结果
| 基因 | 突变位点 | 患儿 | 患儿之父 | 患儿之母 |
|---|---|---|---|---|
| IL10RA | c.301C>T | 杂合突变 | 杂合突变 | 无突变 |
| IL10RA | c.493C>T | 杂合突变 | 无突变 | 杂合突变 |
炎症性肠病(inflammatory bowel disease,IBD)是原因不明的一组非特异性慢性胃肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)、克罗恩病(Crohn′s disease,CD)和未定型结肠炎(indeterminate colitis,IC)[1]。IBD的发病率在世界各地的成人和儿童中越来越多,其中大约20%的患者在16岁以前被确诊[2]。小儿IBD主要发生在青春期,婴儿期起病的IBD报道不多,新生儿则更少,有研究表明,IBD在婴儿期发病占儿科IBD病例总数的1%,而在生后3个月内发病的病例仅为0.25%[3]。其病因和发病机制尚不完全清楚,通常认为遗传、环境、肠道微生物群和免疫应答都参与了IBD的发病机制[4,5]。对于新生儿而言,外源性因素影响较小,且免疫系统尚在发育,故宿主遗传因素显得尤为重要,近年来全世界多个研究中心均表明,早期IBD尤其是新生儿期发病的患儿,多为单基因突变引起[5,6,7]。与IBD发病相关的基因很多,目前报道最多的为白细胞介素-10受体A(IL-10RA)基因,其纯合突变及复合杂合突变与IBD发病相关[7,8,9]。本文病例2为IL-10RA基因的c.301C>T、c.493C>T位点复合杂合突变,两个突变位点分别来自父母双方。c.301C>T位点的纯合突变及复合杂合突变(如c.301C>T、c.537G>A)均有其致病性的报道[10,11];目前人类基因突变数据库(HGMD)未见c.493C>T突变位点报道,但根据美国医学遗传学与基因组学学会(ACMG)基因突变解读指南,该突变位点分级为:致病。国内刘黎黎等[12]报道了一例婴儿IBD,其基因突变类型为c.301C>T、c.493C>T复合杂合突变,与本文病例2突变位点相同。IL-10RA基因突变引起的IBD通常起病年龄早,临床症状重,特别是在新生儿发病的病例中,常表现为严重的肛周疾病[5,9,13]。本文病例2临床表现为肛周脓肿、肛瘘,并因严重脓毒血症放弃抢救后死亡。
IBD的临床表现包括肠道及肠道外表现。典型的肠道表现为腹痛、腹泻和黏液血便,可伴有肠穿孔、瘘管、肛周脓肿等;肠道外表现主要为发热、贫血、皮肤黏膜病变、骨关节病变、生长发育迟缓、营养不良等。新生儿IBD临床表现重,病情进展快,症状不典型,极易误诊和漏诊。IBD活动期的治疗主要根据病变范围和疾病严重程度制定治疗方案。以氨基水杨酸、糖皮质激素、免疫抑制剂、生物制剂等为基础的治疗方案为主。对于轻中度活动性IBD患者,首选氨基水杨酸制剂,如美沙拉嗪、莎尔福等;而对于重症IBD患者或足量氨基水杨酸制剂治疗无效者,可予糖皮质激素治疗;激素无效或激素依赖的急性重症或难治性IBD则用免疫抑制剂。近年来,生物制剂的应用逐渐增多,其对于难治、重症、激素依赖的IBD有较好的效果。根据目前国内外文献报道显示,早期IBD尤其是新生儿期起病的患儿对常规的激素、免疫抑制剂及肿瘤坏死因子拮抗剂的治疗反应欠佳[7,9]。例1于生后21 d起病,继发于严重感染后,出现顽固性腹泻,伴腹胀、血便,外周血白细胞进行性增高,抗感染治疗无效,及时完善结肠镜检查,加用激素针对性治疗,预后良好。例2表现为反复发热、口腔疱疹,后出现肛周脓肿、肛瘘,顽固性腹泻、腹胀,生长发育迟缓、营养不良,白细胞、CRP等感染指标增高,抗感染治疗无效,但该患儿伴有明显IgE升高,干扰了诊断思路,且缺乏结肠镜及病理活检结果,早期未能诊断明确,延误了治疗。基因结果虽有助于IBD的诊断,但检测时间过长,可能在一定程度上限制了基因检测在临床上的应用。
综上,临床医生应以此为鉴,提高新生儿科医生对该病的认识,新生儿不明原因的顽固性腹泻、腹胀,伴有口腔病变、肛周病变、营养不良等肠外表现,炎症指标增高,经抗生素治疗无效等,应考虑到IBD的可能,及时行电子结肠镜检查,必要时可完善基因检测,以早期诊断及治疗,改善患儿预后。
所有作者均声明不存在利益冲突


























