
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
抗Jo-1抗体综合征又称为抗组氨酰-tRNA合成酶综合征,是多发性肌炎/皮肌炎的特殊类型,可累及肺部、肌肉、皮肤、关节等多个脏器,其中间质性肺病(interstitial lung disease,ILD)发生率高达70.0%~90.0%,并可以是抗Jo-1抗体综合征的首发表现[1],极易导致误诊和漏诊。为了提高对本病认识,现将本院收治的1例以间质性肺病为首发表现的抗Jo-1抗体综合征报道如下。
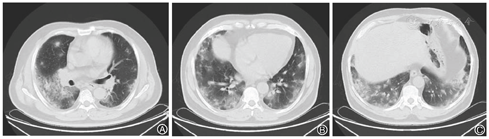
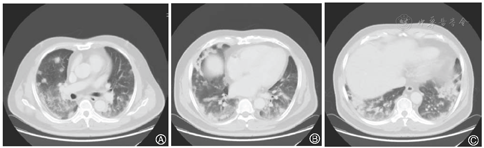
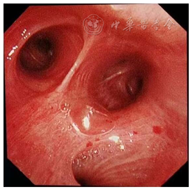
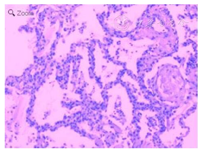
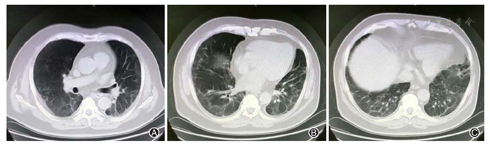
患者,男,56岁,因发热、咳嗽、咳痰伴活动后胸闷3 d于2019年9月10日入院。患者3 d前无诱因出现发热,体温在38 ℃左右,无畏寒、寒战,无盗汗,发热无明显规律性,伴咳嗽,咳少许黄白痰,无胸痛、咯血,伴胸闷、憋气,活动后加重,无消瘦,无头晕、恶心、呕吐,门诊行胸部CT考虑双肺感染性病变,为进一步诊治收住院。患者入院的20 d前在日本出差时出现咽痛,自服感冒药物(具体不详)后好转。既往有“冠心病、高血压”病史4年,2015年行冠脉造影示冠状动脉肌桥,无吸烟史,无禽类、粉尘、工业毒物接触史。体格检查:体温36.5 ℃,脉搏84次/min,呼吸23次/min,血压137/75 mmHg(1 mmHg=0.133 kPa),神志清,全身皮肤无皮疹,口唇发绀,双肺呼吸音粗,双下肺可闻及湿性啰音,心率84次/min,律齐,未闻及杂音。腹软,无压痛、反跳痛,双下肢无浮肿,四肢肌力正常。入院后查动脉血气分析(未吸氧):pH为7.374,二氧化碳分压为39.4 mmHg,氧分压为52.6 mmHg,血氧饱和度为84.8%,乳酸为1.1 mmol/L;血常规:白细胞计数为7.68×109/L,中性粒细胞百分比为 72.1%,淋巴细胞百分比为17.2%,红细胞计数为4.47×1012/L,血沉为16 mm/h;血生化:白蛋白为36.3 g/L,葡萄糖为6.44 mmol/L,乳酸脱氢酶为284 U/L,C反应蛋白为30.9 mg/L,三酰甘油为2.25 mmol/L;血凝常规:纤维蛋白原含量为4.67 g/L;肺肿瘤标志物CYFRA21-1为11.3 ng/ml;降钙素原为0.052 μg/L;病原学检查:半乳甘露聚糖试验(GM试验)为0.38 μg/L;痰细菌培养、真菌涂片、结核菌涂片阴性;肺炎支原体抗体、衣原体抗体、呼吸道合胞病毒抗体、出血热病毒抗体、真菌葡聚糖、巨细胞病毒核酸检测均阴性;免疫相关:抗核抗体(ANA)、抗环瓜氨酸肽抗体(CCP)、抗中性粒细胞胞浆抗体(ANCA)均阴性;机体细胞免疫评价正常;尿常规、大便常规、肌钙蛋白、脑钠肽均正常;乙肝表明抗原、丙肝抗体、梅毒抗体、HIV抗体均阴性;心电图示窦性心律、心电轴中度左偏、ST-T异常;胸部CT考虑双肺感染,建议治疗后复查,心影饱满,冠脉钙化,两侧胸膜略增厚(图1A~C)。入院后给予经鼻高流量湿化氧疗(氧浓度50.0%,氧流量50 L/min),美洛西林舒巴坦(2.5 g,1次/12 h)联合左氧氟沙星(0.6 g,1次/d)抗感染,奥司他韦胶囊(75.0 mg,2次/d)抗病毒,多索茶碱(0.3 g,1次/d)扩张支气管,溴己新(4.0 mg,2次/d)止咳化痰,低分子肝素钠(5 000 U,ih,1次/d)抗凝,硝苯地平缓释片(10.0 mg,2次/d)降压治疗,患者体温逐渐降为正常,但活动时胸闷无改善,经皮血氧饱和度在95.0% 左右(上述氧疗情况下),考虑抗感染解痉平喘治疗效果不佳,不除外间质性肺病,遂于9月14日加用甲泼尼龙(40.0 mg,1次/12 h)静滴,自觉症状略有好转,于9月17日复查胸部CT示双肺片状影较前增多(图2A~C),提示疾病进展,与患者及家属沟通后于9月17日行床旁支气管镜检查,镜下见左右肺各叶段支气管通畅,黏膜轻度充血,可见少量白色泡沫样分泌物,未见狭窄、出血及新生物(图3),于右肺下叶后基底段行肺泡灌洗及透壁肺活检,肺泡灌洗液(BALF)细胞分类示淋巴细胞百分比为63.0%,中性粒细胞百分比为24.0%,巨噬细胞百分比为8.0%,上皮细胞百分比为5.0%;BALF细菌、真菌涂片和培养均阴性;BALF结核菌涂片、结核菌核酸扩增检测(Gene Xpert)均阴性;BALF脱落细胞学检查阴性;BALF-GM试验0.55 ng/ml;BALF病原微生物宏基因组检测(NGS)示产黑色素普雷沃菌(序列数12)、龋齿罗氏菌(序列数7)、简明弯曲杆菌(序列数1);支气管镜肺活检病理考虑肺间质纤维化(图4)。患者对治疗反应不佳,为排除肿瘤于9月20日行正电子发射计算机断层显像(PET-CT)示双肺多发斑片影、结节灶,大部分见支气管充气征,部分结节边缘见分叶和毛刺,SUVmax 6.4,考虑感染性疾病,霉菌感染可能性大,肉芽肿性炎和MALT淋巴瘤不除外(图5)。请北京协和医院专家会诊,考虑ILD,不除外结缔组织病相关,建议加大甲泼尼龙(80.0 mg,1次/8 h)用量,升级抗生素为美罗培南(1.0 g,1次/8 h),完善肌炎谱13项示抗Jo-1抗体阳性,最终诊断为抗Jo-1抗体综合征,加用环磷酰胺(0.4 g,1次/周)静滴8次,并逐渐减少甲泼尼龙用量,患者胸闷症状明显好转,2019年11月18日复查胸部CT示肺内病变较前明显吸收好转(图6A~C),随访1年,病情稳定。




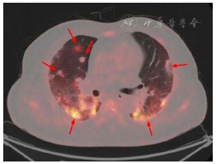


该患者急性起病,表现为发热、咳嗽、胸闷,双下肺湿啰音,血、痰、BALF病原学检查阴性,胸部CT示双肺间质性病变,支气管镜肺活检考虑肺间质纤维化,抗Jo-1抗体阳性,因此抗Jo-1抗体综合征合并ILD诊断明确。抗Jo-1抗体综合征是PM/DM的一个特殊类型,ILD发生率高达70.0%~90.0%,有学者观察91例抗Jo-1抗体综合征患者胸部CT,发现72.5%的患者存在ILD,其中12例为急性进展型[2]。此患者急性起病,快速进展为呼吸衰竭,提示早期诊断对本病预后至关重要。
ILD可发生于抗Jo-1抗体综合征患者病程中的任何时期,包括发生于皮炎/皮肌炎之前,之后或同时发生,也可以是唯一的临床表现[2]。此患者仅表现为呼吸道症状,无明显肌炎及皮损表现,给诊断增加了困难。试验室检查可见血清肌酶升高,血沉增快,CRP升高,抗Jo-1抗体阳性,而且有研究显示抗Jo-1抗体滴度与ILD、肌炎活动程度相关[3],但抗核抗体可阴性,因为抗核抗体检测的是细胞核内抗原,而抗Jo-1抗体的靶抗原是组氨酰tRNA合成酶,主要存在于细胞浆内,故抗核抗体阴性不能除外抗Jo-1抗体综合征,此患者因为ANA、ANCA、CCP均阴性,给诊断增加了迷惑性,故临床上高度怀疑结缔组织病相关性肺损害时需行肌酶谱检测[4]。肺功能检查表现为限制性通气功能障碍和弥散功能减低,此患者因入院时即进展为呼吸衰竭,胸闷症状明显,故未能进行肺功能检查,是本病例的一个缺陷。支气管镜检查在鉴别弥漫性肺病病因时具有十分重要的价值,肺泡灌洗液细胞分类和肺活检病理类型对判断患者预后和糖皮质激素治疗反应具有重要的价值,其中淋巴细胞偏高时对糖皮质激素治疗效果明显,中性粒细胞偏高时对激素治疗反应欠佳,此患者BALF中淋巴细胞明显升高,但中性粒细胞亦明显升高,与患者对激素治疗反应不理想相符,加大激素用量并联合免疫抑制剂后症状改善。抗Jo-1抗体综合征肺活检病理可表现为寻常型间质性肺炎(usual interstitial pneumonia,UIP)型、非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP)型、机化性间质性肺炎(orgnizing pneumonia,OP)型和弥漫性肺泡损伤(diffuse alveolar damage,DAD)型,NSIP型和OP型对激素治疗效果明显[1],此患者肺活检病理示肺间质纤维化,因支气管镜活检标本较小,无法对ILD进行病理分型,但对于排除肿瘤、真菌等其他疾病具有一定价值。
有研究表明,以ILD为主要表现的抗Jo-1抗体综合征患者,以后仍然有发生关节炎、肌炎、皮炎的风险,并且有较高的复发风险[5]。抗Jo-1抗体综合征与肿瘤关系密切,有研究显示抗Jo-1抗体和抗Ro-52同时阳性患者患恶性肿瘤的风险高[6],但也有学者认为抗Jo-1抗体阴性者患恶性肿瘤的风险更高[2]。这提示我们在以后的随访过程中需高度警惕疾病复发和肿瘤。
抗Jo-1抗体综合征的治疗目前尚无统一标准,以糖皮质激素和免疫抑制剂为主,具体治疗方案需要根据患者病情、BALF细胞分类、胸部CT表现、肺组织病理类型来综合确定[7],对于BALF中以淋巴细胞为主、胸部CT和病理为NSIP型或OP型对糖皮质激素治疗反应较好,而UIP型对糖皮质激素治疗反应差,可联合应用免疫抑制剂。有研究显示伊马替尼、妥珠单抗、吡非尼酮、利妥昔单抗对PM/DM-ILD有抑制肺纤维化作用[8, 9, 10, 11, 12],可在今后的临床工作中进一步验证。
总之,在临床工作中,对于不明原因的ILD,应仔细询问病史,细致查体,及早完善肌酶谱、抗核抗体谱、肌电图等相关检查,早诊断、早治疗,改善患者预后。


























