
探讨进展期胃癌患者行根治性全胃切除术时脾门淋巴结清扫的手术方式选择,并评价No.4s淋巴结对脾门淋巴结转移的预警效能。
本研究采用前瞻性、单中心、随机对照研究方法(Clinicaltrials.gov注册号NCT02980861)。纳入标准:(1)>18岁且<65岁;(2)肿瘤位于近端或胃体的胃腺癌;(3)术前临床分期为cT2~4aN0~3M0;(4)术前判断为可行D2根治手术;(5)体能评分0或1分;(6)美国麻醉医师协会分级为Ⅰ~Ⅲ级。排除怀孕或哺乳期女性、有严重精神疾病、既往上腹部手术史、近5年内曾患有其他恶性肿瘤疾病、术前判断为影响手术的心肺系统疾病及术前曾行化疗、放疗或其他靶向治疗者;剔除术中发现有远处转移者。根据上述标准,前瞻性纳入2016年12月至2017年12月期间,解放军总医院第一医学中心收治的222例近端和胃体胃癌患者,并根据随机数表随机分为腹腔镜脾门淋巴结清扫组(腹腔镜手术组,114例)和开腹脾门淋巴结清扫组(开腹手术组,108例),对比两组的手术指标、术后恢复指标和并发症发生情况,并评价No.4s淋巴结对脾门淋巴结转移的预警敏感性和特异性。
腹腔镜手术组中男性80例,女性34例,年龄为(56.1±10.2)岁;开腹手术组中男性69例,女性39例,年龄为(58.4±10.9)岁。两组基线资料差异无统计学意义(均P>0.05)。腹腔镜手术组的总失血量和清扫脾门淋巴结的出血量均少于开腹手术组[(96.3±82.4)ml比(116.6±101.9)ml,t=1.124,P<0.001;(25.3±17.8)ml比(59.5±36.4)ml,t=1.172,P<0.001],而两组手术时间、脾门淋巴结清扫时间、淋巴结清扫数目和脾门淋巴结清扫数目相近(均P>0.05)。腹腔镜手术组患者的术后排气时间[(1.3±1.2)d比(1.6±1.5)d,t=1.665,P=0.021]、进流质饮食时间[(4.6±1.4)d比(4.9 ± 1.6)d,t=1.436,P=0.007]、胃管拔除时间[(3.9±2.6)d比(4.3±2.4)d,t=0.687,P<0.001]和住院时间[(10.3±6.6)d比(12.1±7.2)d,t=0.697,P<0.001]均短于开腹手术组患者。腹腔镜手术组和开腹手术组分别有16例(14.0%)和13例(12.0%)发生术后并发症,差异无统计学意义(χ2=6.723,P=0.331)。No.4s淋巴结对脾门淋巴结转移预测的敏感性达到89.5%,特异性达到99.6%。
腹腔镜技术在进展期胃癌全胃切除手术脾门淋巴结清扫中安全可行,No.4s淋巴结对于预测脾门淋巴结是否转移具有较好的示警效能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尽管胃癌的发病率在近些年有所下降,但是近端胃癌和食管胃结合部癌的发病率却在逐年升高[1]。胃癌的高死亡率仍是导致我国恶性肿瘤死亡率较高的重要原因之一[2]。根据文献报道,进展期胃癌患者发生脾门淋巴结(No.10淋巴结)转移的比率为9.8%~27.9%,并且与患者预后有关[3,4]。因此,按照日本胃癌规约推荐的近端和胃体胃癌标准手术切除范围,应进行包括脾门淋巴结在内的D2淋巴结清扫术[3]。考虑到脾切除术并没有为进展期胃癌患者带来生存获益,反而会增加术后严重并发症的发生风险,且脾脏具有一定的免疫功能,可能在抗肿瘤中发挥一定作用[5,6,7]。因此,开腹手术同时保留脾脏的脾门淋巴结清扫已经被广泛接受并用于临床实践。然而,由于脾门区域位置较深、血管解剖复杂、邻近脾动静脉等大血管,清扫脾门淋巴结会显著增加脾脏切除、胰腺损伤和大出血等严重并发症的发生率[8]。
随着微创治疗理念和技术的发展,腹腔镜辅助的D2淋巴结清扫已被广泛用于进展期胃癌的手术[9,10]。腹腔镜脾门淋巴结清扫也在临床实践中逐步得到应用。有研究报道,腹腔镜手术清扫脾门淋巴结安全可行,并且符合微创治疗原则[11,12,13,14]。然而,这些研究多为小样本量的回顾性研究,缺乏高质量的循证医学证据来证明腹腔镜技术在脾门淋巴结清扫中的优劣势。而目前尚无有效的手段可在术前或术中判断脾门淋巴结是否存在转移。有学者利用纳米碳颗粒研究发现,在近端胃癌中,No.4sa和No.4sb淋巴结为脾门淋巴结的上游淋巴结[15,16,17]。而已有研究报道,No.4sb淋巴结是脾门淋巴结转移的独立危险因素[18]。因此,如能在术中判断No.4s淋巴结有无转移,可以为临床医生是否行脾门淋巴结的清扫提供决策依据。为此,我们开展了一项前瞻性随机对照试验,对比腹腔镜和开腹手术在脾门淋巴结清扫中的优势和劣势,并评价No.4s淋巴结对脾门淋巴结转移的预警效能,以期为胃癌精准治疗提供新的循证学依据。
本研究为前瞻性、单中心、随机对照研究。自2016年12月起,前瞻性收集解放军总医院第一医学中心收治的近端和胃体胃癌病例。患者入组、排除和剔除标准见表1。本研究已通过解放军总医院第一医学中心伦理委员会审批(S2016-080-01),并于Clinicaltrials.gov注册(NCT02980861),所有入组患者均签署了知情同意书。

本研究病例入组、排除和剔除标准
本研究病例入组、排除和剔除标准
| 标准 | 项目 |
|---|---|
| 入组标准 | 年龄>18岁且<65岁; |
| 术前病理诊断为胃腺癌,肿瘤位于近端或胃体; | |
| 术前临床分期为cT2~4aN0~3M0(根据第7版AJCC指南); | |
| 术前判断为可行D2根治手术; | |
| ECOG体能评分0或1分; | |
| ASA分级为Ⅰ,Ⅱ或Ⅲ级; | |
| 签署知情同意书 | |
| 排除标准 | 怀孕或哺乳期女性; |
| 严重精神疾病患者; | |
| 既往上腹部手术史; | |
| 近5年内曾患有其他恶性肿瘤疾病(宫颈原位癌和已治愈的皮肤癌除外); | |
| 术前判断为影响手术的心肺系统疾病(近1年内出现的心绞痛、心肌梗死或其他心血管事件,FEV1<50%); | |
| 术前曾行化疗、放疗或其他靶向治疗 | |
| 剔除标准 | 术中发现有远处转移 |
注:AJCC为美国癌症联合会(American Joint Committee on Cancer);ECOG为美国东部肿瘤协作组(Eastern Cooperative Oncology Group);ASA为美国麻醉医师协会(American Society of Anesthesiology);FEV1为1秒内最大呼气量(forced expiratory volume in 1 second)
所有患者需在术前接受腹部+盆腔增强CT/MRI检查、普通胃镜检查和选择性的超声胃镜检查。符合入组条件的患者在试验小组处登记入组,并根据电脑随机生成的随机数表,随机分配至腹腔镜手术组和开腹手术组。
参与本研究的外科主刀医生均需满足下列要求:(1)具备高级职称,每年至少完成50例腹腔镜和50例开腹根治性全胃切除术;(2)课题实施前,对参与手术的医生进行研究方案实施细则和手术关键技术培训。每例手术录像均由其他的外科医生进行事后质量评价。
根治性全胃切除术的手术步骤应遵循日本胃癌规约[3]。消化道重建方式取决于主刀医生的习惯和既往经验。腹腔镜全胃切除术辅助切口需<10 cm。D2根治手术的关键部位需拍照留存档案,包括:(1)胰尾和脾门区域;(2)幽门下区;(3)小弯侧区域;(4)胰腺上区。
所有入组患者均需按照标准临床路径进行操作。每日早晚分别对患者进行肠蠕动功能恢复评估,所有患者术后第2天开始少量饮水。一旦患者排气后,可进食流食。如患者进食流食2 d后无明显不适,可进食半流质饮食。如患者进食半流质饮食2 d后无明显不适,同时无明显并发症发生,可办理出院手续。手术方法见文献[3]。
本研究主要指标为脾门No.10淋巴结清扫数目;次要指标包括手术时间、No.10淋巴结清扫时间、术中出血量、清扫No.10淋巴结的出血量、总淋巴结清扫数以及术后并发症发生率,并评价No.4s淋巴结对脾门淋巴结转移预警的敏感性和特异性。
本研究采用非劣效性试验方法,以脾门No.10淋巴结清扫数目为主要评价指标估算样本量。本研究假设,腹腔镜手术效果非劣于开腹手术,根据文献报道,预期开腹手术No.10淋巴结清扫数目为(2.7±1.4)枚,腹腔镜手术No.10淋巴结清扫数目为(3.8±1.9)枚[6]。取非劣效界值δ=-1,α=0.025(单侧),检验效能80%,两组比例1∶1,将参数代入SAS软件,利用公式n=2 ×(Uα+Uβ)2×(σ/δ)2,估算得每组需清扫No.10淋巴结的患者为45例。由于本研究中需清扫No.10淋巴结的为No.4s阳性患者,而根据前期研究发现,进展期胃中上部癌No.4s淋巴结转移阳性比率为50%,因此每组共需90例患者。假定实验脱落10%,初步估算出每组样本量为100例。
为了验证No.4s淋巴结能否作为No.10淋巴结转移的预警指标,对全组222例患者均进行了术中快速免疫组织化学和快速冰冻苏木精-伊红染色。手术医生在术中将No.4sa和No.4sb淋巴结清扫后,送快速冰冻免疫组织化学检测。试剂采用CK20-EPOS抗体[EPR1622Y](ab76126)和EPOS抗体检测试剂盒。具体检测方法参照文献[19]。由两位专职病理科医生、技师对淋巴结进行快速免疫组织化学染色,出具病理报告,手术医生根据病理结果制定下一步淋巴结清扫范围的方案。术后常规苏木精-伊红染色。
采用SPSS 18.0进行统计分析,符合正态分布的计量资料采用 ±s表示,两组间比较用独立样本t检验;计数资料用例(%)表示,组间比较采用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
±s表示,两组间比较用独立样本t检验;计数资料用例(%)表示,组间比较采用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
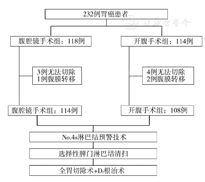
在2016年12月至2017年12月期间,共计232例胃癌患者纳入本研究,并随机分配至腹腔镜手术组和开腹手术组。10例患者符合剔除标准而被排除。最终222例患者入组,腹腔镜手术组114例,开腹手术组108例。见图1。

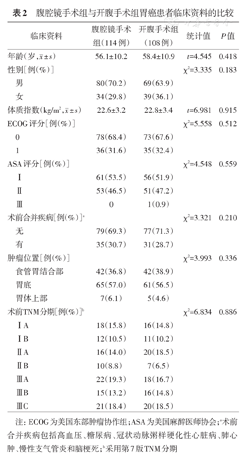
腹腔镜手术组中男性80例,女性34例,年龄为(56.1±10.2)岁;开腹手术组中男性69例,女性39例,年龄为(58.4±10.9)岁。两组性别、年龄、体质指数、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能评分等基线资料的差异均无统计学意义(均P>0.05),具有可比性。见表2。
腹腔镜手术组与开腹手术组胃癌患者临床资料的比较
腹腔镜手术组与开腹手术组胃癌患者临床资料的比较
| 临床资料 | 腹腔镜手术组(114例) | 开腹手术组(108例) | 统计值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 56.1±10.2 | 58.4±10.9 | t=4.545 | 0.418 | |
| 性别[例(%)] | χ2=3.335 | 0.183 | |||
| 男 | 80(70.2) | 69(63.9) | |||
| 女 | 34(29.8) | 39(36.1) | |||
体质指数(kg/m2, ±s) ±s) | 22.6±3.2 | 22.8±3.4 | t=6.981 | 0.915 | |
| ECOG评分[例(%)] | χ2=5.558 | 0.512 | |||
| 0 | 78(68.4) | 73(67.6) | |||
| 1 | 36(31.6) | 35(32.4) | |||
| ASA评分[例(%)] | χ2=4.548 | 0.559 | |||
| Ⅰ | 61(53.5) | 56(51.9) | |||
| Ⅱ | 53(46.5) | 51(47.2) | |||
| Ⅲ | 0 | 1(0.9) | |||
| 术前合并疾病[例(%)]a | χ2=3.321 | 0.210 | |||
| 无 | 79(69.3) | 77(71.3) | |||
| 有 | 35(30.7) | 31(28.7) | |||
| 肿瘤位置[例(%)] | χ2=3.993 | 0.336 | |||
| 食管胃结合部 | 42(36.8) | 42(38.9) | |||
| 胃底 | 65(57.0) | 61(56.5) | |||
| 胃体上部 | 7(6.1) | 5(4.6) | |||
| 术前TNM分期[例(%)]b | χ2=6.834 | 0.886 | |||
| ⅠA | 18(15.8) | 16(14.8) | |||
| ⅠB | 12(10.5) | 11(10.2) | |||
| ⅡA | 16(14.0) | 20(18.5) | |||
| ⅡB | 10(8.8) | 7(6.5) | |||
| ⅢA | 22(19.3) | 18(16.7) | |||
| ⅢB | 15(13.2) | 16(14.8) | |||
| ⅢC | 21(18.4) | 20(18.5) | |||
注:ECOG为美国东部肿瘤协作组;ASA为美国麻醉医师协会;a术前合并疾病包括高血压、糖尿病、冠状动脉粥样硬化性心脏病、肺心肿、慢性支气管炎和脑梗死;b采用第7版TNM分期
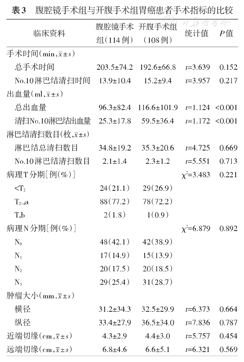
两组患者均顺利完成手术,腹腔镜手术组1例患者因脾脏损伤而中转开腹手术。尽管腹腔镜手术组的平均总手术时间比开腹手术组长11 min,但是两组差异无统计学意义(P=0.152)。同样,两组在No.10淋巴结清扫时间方面的差异亦无统计学意义(P=0.217)。腹腔镜手术组的总出血量和清扫No.10淋巴结的出血量均明显低于开腹手术组,差异有统计学意义(均P<0.001)。两组在淋巴结总清扫数目、No.10淋巴结清扫数目、病理T分期、病理N分期、肿瘤大小、近端切缘和远端切缘方面的差异均无统计学意义(均P>0.05)。见表3。
腹腔镜手术组与开腹手术组胃癌患者手术指标的比较
腹腔镜手术组与开腹手术组胃癌患者手术指标的比较
| 临床资料 | 腹腔镜手术组(114例) | 开腹手术组(108例) | 统计值 | P值 | |
|---|---|---|---|---|---|
手术时间(min, ±s) ±s) | |||||
| 总手术时间 | 203.5±74.2 | 192.6±66.8 | t=3.639 | 0.152 | |
| No.10淋巴结清扫时间 | 13.9±10.4 | 15.2±9.4 | t=3.957 | 0.217 | |
出血量(ml, ±s) ±s) | |||||
| 总出血量 | 96.3±82.4 | 116.6±101.9 | t=1.124 | <0.001 | |
| 清扫No.10淋巴结出血量 | 25.3±17.8 | 59.5±36.4 | t=1.172 | <0.001 | |
淋巴结清扫数目(枚, ±s) ±s) | |||||
| 淋巴结总清扫数目 | 34.8±19.2 | 35.3±20.6 | t=4.725 | 0.669 | |
| No.10淋巴结清扫数目 | 2.1±1.4 | 2.3±1.2 | t=5.551 | 0.713 | |
| 病理T分期[例(%)] | χ2=3.483 | 0.221 | |||
| <T2 | 24(21.1) | 29(26.9) | |||
| T2~4a | 88(77.2) | 78(72.2) | |||
| T4b | 2(1.8) | 1(0.9) | |||
| 病理N分期[例(%)] | χ2=6.879 | 0.892 | |||
| N0 | 48(42.1) | 42(38.9) | |||
| N1 | 17(14.9) | 15(13.9) | |||
| N2 | 20(17.5) | 20(18.5) | |||
| N3 | 29(25.4) | 31(28.7) | |||
肿瘤大小(mm, ±s) ±s) | |||||
| 横径 | 31.2±34.3 | 32.5±29.9 | t=6.373 | 0.664 | |
| 纵径 | 33.4±27.9 | 36.5±34.0 | t=7.836 | 0.787 | |
近端切缘(cm, ±s) ±s) | 4.3±2.9 | 4.4±3.0 | t=5.757 | 0.454 | |
远端切缘(cm, ±s) ±s) | 6.8±4.6 | 6.6±5.1 | t=6.321 | 0.569 | |
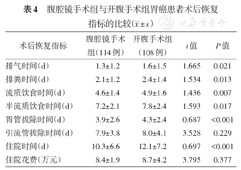
腹腔镜手术组患者的排粪时间(P=0.013)、排气时间(P=0.021)、进流质饮食时间(P=0.007)和进半流质饮食时间(P=0.017)均早于开腹手术组,差异均有统计学意义。此外,腹腔镜手术组患者胃管的拔除时间和住院时间也短于开腹手术组,差异均有统计学意义(均P<0.001)。但两组患者的引流管拔除时间(P=0.229)和住院花费(P=0.377)差异无统计学意义。见表4。
腹腔镜手术组与开腹手术组胃癌患者术后恢复指标的比较( ±s)
±s)
腹腔镜手术组与开腹手术组胃癌患者术后恢复指标的比较( ±s)
±s)
| 术后恢复指标 | 腹腔镜手术组(114例) | 开腹手术组(108例) | t值 | P值 |
|---|---|---|---|---|
| 排气时间(d) | 1.3±1.2 | 1.6±1.5 | 1.665 | 0.021 |
| 排粪时间(d) | 2.1±1.2 | 2.4±1.4 | 1.534 | 0.013 |
| 流质饮食时间(d) | 4.6±1.4 | 4.9±1.6 | 1.436 | 0.007 |
| 半流质饮食时间(d) | 7.2±2.1 | 7.8±2.4 | 1.593 | 0.017 |
| 胃管拔除时间(d) | 3.9±2.6 | 4.3±2.4 | 0.687 | <0.001 |
| 引流管拔除时间(d) | 7.9±3.8 | 8.0±4.1 | 3.528 | 0.229 |
| 住院时间(d) | 10.3±6.6 | 12.1±7.2 | 0.697 | <0.001 |
| 住院花费(万元) | 8.4±1.9 | 8.7±4.2 | 3.795 | 0.377 |
腹腔镜手术组和开腹手术组分别有16例(14.0%)和13例(12.0%)发生术后并发症,差异无统计学意义(χ2=6.723,P=0.331)。在腹腔镜手术组中,1例患者因腹腔出血而二次手术,术中证实为脾动脉分支出血;在开腹手术组中,2例患者因腹腔出血而行保守治疗后好转;两组差异无统计学意义(χ2=3.439, P=0.244)。此外,两组患者在伤口感染、消化道出血、肠梗阻、乳糜漏、胰漏、肺部感染和深静脉血栓方面差异均无统计学意义(均P>0.05)。尽管腹腔镜手术组和开腹手术组分别有3例和2例患者出现医源性脾脏损伤,但是两组医源性脾脏损伤率差异也无统计学意义(χ2=5.453,P=0.492)。两组均无病例死亡。见表5。
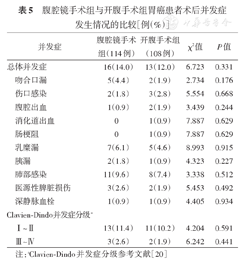
腹腔镜手术组与开腹手术组胃癌患者术后并发症发生情况的比较[例(%)]
腹腔镜手术组与开腹手术组胃癌患者术后并发症发生情况的比较[例(%)]
| 并发症 | 腹腔镜手术组(114例) | 开腹手术组(108例) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 总体并发症 | 16(14.0) | 13(12.0) | 6.723 | 0.331 | |
| 吻合口漏 | 5(4.4) | 2(1.9) | 2.734 | 0.176 | |
| 伤口感染 | 2(1.8) | 3(2.8) | 5.554 | 0.668 | |
| 腹腔出血 | 1(0.9) | 2(1.9) | 3.439 | 0.244 | |
| 消化道出血 | 0 | 1(0.9) | 7.887 | 0.629 | |
| 肠梗阻 | 0 | 1(0.9) | 7.887 | 0.629 | |
| 乳糜漏 | 7(6.1) | 5(4.6) | 8.993 | 0.915 | |
| 胰漏 | 2(1.8) | 1(0.9) | 4.323 | 0.227 | |
| 肺部感染 | 11(9.6) | 8(7.4) | 3.338 | 0.512 | |
| 医源性脾脏损伤 | 3(2.6) | 2(1.9) | 5.453 | 0.492 | |
| 深静脉血栓 | 1(0.9) | 1(0.9) | 4.405 | 0.934 | |
| Clavien-Dindo并发症分级a | |||||
| Ⅰ~Ⅱ | 13(11.4) | 11(10.2) | 4.204 | 0.591 | |
| Ⅲ~Ⅳ | 3(2.6) | 2(1.9) | 6.242 | 0.441 | |
注:aClavien-Dindo并发症分级参考文献[20]
在纳入研究的222例患者中,18例术中证实为No.4s淋巴结阳性,转移比率为8.1%,其中腹腔镜组10例,开腹组8例;19例患者No.10淋巴结阳性,转移比率为8.6%,其中腹腔镜组12例,开腹组7例。19例No.10淋巴结阳性的患者中,17例为在No.4s淋巴结阳性预警的前提下进行的选择性No.10淋巴结清扫。No.4s淋巴结预警No.10淋巴结转移的敏感性为89.5%(95%CI:82.1%~93.4%),特异性为99.6%(95%CI:93.4%~99.9%),准确度为94.3%(95%CI:92.2%~98.2%),阳性预测值为94.4%(95%CI:92.2%~96.2%),阴性预测值为99.0%(95%CI:81.5%~99.8%)。见表6。

222例胃癌患者的No.4s淋巴结对No.10淋巴结转移的预警效能评价(例)
222例胃癌患者的No.4s淋巴结对No.10淋巴结转移的预警效能评价(例)
| 淋巴结转移情况 | 例数 | No.10淋巴结阳性(19例) | No.10淋巴结阴性(203例) |
|---|---|---|---|
| No.4s淋巴结阳性 | 18 | 17 | 1 |
| No.4s淋巴结阴性 | 204 | 2 | 202 |
根据文献报道,脾门淋巴结的转移比率不尽相同,对于T3期的近端胃癌,其转移比率为13.4%,而对于T4期的近端胃癌,其转移比率可高达34.4%[21]。黄昌明团队回顾性分析了346例近端胃癌患者资料发现,No.10淋巴结转移比率为10.1%,且与患者的预后显著关联[22]。由于脾门淋巴结转移的比率较高,日本胃癌规约建议将No.10淋巴结作为D2淋巴结清扫的重要一环。然而,学者们对于脾门淋巴结是否清扫以及能否带来生存获益仍存在争议。一项包含453例全胃切除患者的回顾性研究分析发现,No.10淋巴结清扫患者的5年生存率要高于未清扫组(46.44%比37.43%),但是差异无统计学意义[23]。Kosuga等[24]认为,全胃切除患者同时行No.10淋巴结清扫后的5年生存率可高达51.3%,可为患者带来生存获益,尤其是肿瘤位于胃大弯侧或Borrmann Ⅳ型胃癌。我们团队前期研究发现,No.10淋巴结是否转移是影响胃癌患者预后的一个重要因素,尤其是对于那些术后病理证实No.10淋巴结有转移的患者[19]。更有学者研究发现,T2期胃癌患者不伴有No.10淋巴结转移的5年生存率高达65.4%,而发生No.10淋巴结转移的患者生存率仅为45.5%[25]。因此,尽管有学者认为No.10淋巴结的转移比率较低,但是按照根治性的原则仍需要进行No.10淋巴结的清扫。更重要的是,近端胃癌的发病率在逐年升高,相应的No.10淋巴结转移的比率也会升高。因此,我们研究团队认为,No.10淋巴结的清扫可以改善近端胃癌患者的预后,并提供更加精准的病理分期。
脾脏由于其特殊的解剖位置,脆弱的组织特性和丰富的血液供应,在清扫脾门淋巴结时,外科医生需要复杂的手术技术避免损伤脾脏及其血管,这使得外科医生不断尝试新的方法以求达到最佳的清扫效果。近年研究已证实,腹腔镜手术可以达到与开放手术相似的短期手术效果,且患者生存预后不劣于开腹手术[26,27]。因此,不断有学者尝试采用更加微创的腹腔镜技术进行脾门淋巴结清扫。自从韩国外科医师在2008年首次报道了腹腔镜No.10淋巴结清扫,陆续有多项研究报告了No.10淋巴结腹腔镜清扫,并具有令人满意的肿瘤学效果[28,29,30,31]。然而,这些研究主要是回顾性的,与传统的开放式手术缺乏比较。更重要的是,接受腹腔镜手术患者的长期随访结果,与开放手术相比仍不清楚。因此,我们进行了第一项随机对照试验,比较了腹腔镜和开腹手术对进展期近端胃癌脾门淋巴结清扫的临床疗效,并旨在确定哪种手术方法可带来最大的益处。
在本研究中,No.10淋巴结的转移比率为8.6%,这与以往研究报道一致[7]。腹腔镜手术组与开腹手术组之间清扫的淋巴结总数差异无统计学意义(P=0.669),这表明腹腔镜与开腹手术的进展期近端胃癌中具有相似的淋巴结清扫术效果。重要的是,腹腔镜手术组与开腹手术组之间的No.10淋巴结清扫数目也相近(P=0.713),这表明腹腔镜手术具有与开腹手术相同的根治作用。此外,腹腔镜手术组清扫No.10淋巴结所花费的时间与开腹手术组相近,但出血量更少。这表明经验丰富的外科医生在腹腔镜条件下清扫No.10淋巴结可以与开放手术一样快,且失血更少。此外,腹腔镜手术组的术后恢复效果优于开腹手术组,术后并发症发生率也在可接受范围内,与开腹手术组相当。因此,在本研究中,与开腹手术组相比,腹腔镜手术组表现出相似的淋巴结清扫术效果,并且术后恢复更快。但是,胃切除术最重要的评估指标是长期生存,其评估仍在进行中。
在No.4s淋巴结预警效能评价方面,我们团队在前期进行了单中心的回顾性研究,发现No.4s淋巴结对脾门淋巴结预警的敏感性为93.1%,特异性为92.8%[19]。本次前瞻性研究中发现:No.4s淋巴结对脾门淋巴结预警的敏感性为89.5%,特异性为99.6%。目前关于脾门淋巴结是否清扫仍存在争议,我们的研究结果表明,通过No.4s淋巴结预警选择性清扫脾门淋巴结安全可行,具有较高的敏感性和特异性,可以满足临床实际使用需要。
虽然本研究初步表明了腹腔镜在No.10淋巴结清扫中的短期优势以及No.4s淋巴结的预警效能,但是本研究仍存在一下不足:(1)本研究为单中心的研究,仍需要进行多中心的随机对照研究,以减少偏倚的存在;(2)本研究仅探讨了腹腔镜手术的短期疗效,以及No.4s淋巴结预警的优劣势,仍需要获得患者的长期随访数据,才能确定腹腔镜手术和No.10淋巴结选择性清扫能否最终为患者带来获益。虽然本研究存在一定的局限性,但是我们团队认为:本研究为进展期胃癌患者的精准和个体化治疗提供了新的思路和依据,在后续的研究中,我们团队将完成后续随访工作,并适时组织多中心的随机对照研究,为No.10淋巴结清扫提供更加精准的循证学证据。
本研究是目前第一篇前瞻性评价腹腔镜脾门淋巴结清扫的随机对照研究。本研究表明了腹腔镜在脾门淋巴结清扫中的微创优势,以及不劣于开腹手术的清扫效果,同时,No.4s淋巴结对脾门淋巴结转移具有较好的示警作用。虽然患者仍在随访中,但是初步的结果表明,腹腔镜手术在脾门淋巴结清扫中安全可行。
所有作者均声明不存在利益冲突



























