
比较中低位局部进展期直肠癌术前采用新辅助放化疗(nCRT)和全程新辅助治疗(TNT)两种模式的近期疗效与安全性。
采用回顾性队列研究方法。病例入组标准:(1)病理证实为距离肛缘12 cm以内的直肠腺癌;(2)经磁共振(MRI)或直肠腔内超声诊断为cT3~4N0或cT1~4N1~2者;(3)经肠镜证实为直肠单发肿瘤;(4)能够耐受放化疗;(5)既往无其他肿瘤史。排除标准:既往接受过直肠癌根治手术,此次为局部复发者;(2)不能完整完成nCRT疗程者;(3)远处转移者;(4)临床病理资料不完善者。按照上述标准,2016年1月至2019年1月期间,首都医科大学附属北京朝阳医院普通外科收治的134例直肠癌患者纳入本研究。其中男性82例,女性52例,男女比例为1.58∶1.00,年龄26~81(59.6±11.2)岁。根据患者接受的辅助治疗方案(2017年12月前为nCRT治疗,2018年1月后为接受TNT治疗),将患者分为nCRT组(55例)和TNT组(79例)。两组患者年龄、性别、肿瘤距肛缘距离、美国东部肿瘤协作组(ECOG)体力状态评分、肿瘤TNM分期等基线资料的比较,差异均无统计学意义(均P>0.05)。两组患者均采用三维适形调强放疗(IMRT),放疗剂量为50.4 Gy/28 f。nCRT组放疗期间口服卡培他滨化疗,放疗结束休息6~8周后行手术治疗。TNT组于放疗前给予CapeOX方案(奥沙利铂+卡培他滨)诱导化疗1个周期后开始同步放化疗;巩固化疗结束后2周行手术治疗。比较两组新辅助治疗疗效、放化疗不良反应发生情况以及围手术期安全性。
两组患者均完成nCRT疗程。nCRT组和TNT组患者不良反应发生率比较,中性粒细胞减少[7.3%(4/55)比10.1%(8/79)]、贫血[3.6%(2/55)比3.8%(3/79)]、血小板减少[5.5%(3/55)比7.6%(6/79)]、胃肠功能紊乱[3.6%(2/55)比6.3%(5/79)]和放射性肠炎[9.1%(5/55)比8.9%(7/79)]发生率差异均无统计学意义(均P>0.05)。130例患者完成TME手术,nCRT组54例,TNT组76例。相比nCRT组,TNT组采用经腹会阴联合切除术(APR)的比例较高,差异具有统计学意义[31.6%(25/76)比13.0%(7/54),χ2=9.382,P=0.009],但两组术后并发症发生率以及手术时间、术中出血量、术后住院时间方面的差异也均无统计学意义(均P>0.05)。所有患者的手术远切缘和环周切缘均阴性。nCRT组pCR为7.4%(4/54),TNT组为22.4%(17/76),差异有统计学意义(χ2=5.217,P=0.022)。两组术后病理分期、神经侵犯和脉管癌栓的差异均无统计学意义(均P>0.05)。
在中低位进展期直肠癌的治疗中,TNT在不增加放化疗不良反应和手术并发症发生率的前提下,pCR率高于nCRT。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前在全球范围内,结直肠癌的发病率和死亡率仍是排第三的恶性肿瘤[1]。对于中低位进展期直肠癌,美国国家综合癌症治疗协作网(National Comprehensive Cancer Network,NCCN)推荐的标准治疗是新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)+全直肠系膜切除术(total mesorectal excision,TME)+术后辅助化疗[2]。这种方法尽管使局部复发率降低,但是远处转移仍是患者的主要死亡原因[3]。基于此,有些临床研究提出,在手术前进行诱导化疗或者巩固化疗,与nCRT相结合的治疗策略,称为全程新辅助治疗(total neoadjuvant therapy,TNT),其具有改善患者的放化疗依从性、增加肿瘤学降期效果、早期引入化疗以消除可能存在的微转移病灶和评估化疗敏感性以及减少患者术后带造口化疗的时间等优点[4,5,6,7,8]。
纪念斯隆-凯特琳癌症中心的一项纳入61例患者的研究发现,在nCRT之前增加FOLFOX(奥沙利铂+氟尿嘧啶+亚叶酸钙)化疗使患者的放化疗耐受性和治疗反应得到改善,共22例(36%)获得病理完全缓解(pathological complete response,pCR)或临床完全缓解(clinical complete response,cCR)[7]。其他的研究结果也有类似报道[4,5]。由此而使TNT成为2019年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中治疗局部进展期直肠癌的一种策略。
目前,关于TNT的研究在国内报道相对较少,本研究回顾性收集在首都医科大学附属北京朝阳医院同期行TNT或nCRT模式治疗的患者的临床病理资料,比较两种模式的近期疗效、放化疗不良反应和围手术期安全性,旨在探讨TNT模式能否为国内局部进展期直肠癌患者带来获益,以期能够为倾向非手术策略来保留器官的等待观察患者们带来希望。
采用回顾性队列研究方法。病例入组标准:(1)病理证实为距离肛缘12 cm以内的直肠腺癌;(2)经磁共振(MRI)或直肠腔内超声诊断为cT3~4N0或cT1~4N1~2者;(3)经胸部、腹部CT等检查除外远处转移;(4)经肠镜证实为直肠单发肿瘤;(5)未接受术前化疗、盆腔放疗或免疫治疗;(6)既往无其他肿瘤史;(7)经美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分[9]或Karnofsky评分≥70分[10],患者无严重心、肺、肾等并发症,能够耐受放化疗。排除标准:(1)既往接受过直肠癌根治手术,此次为局部复发者;(2)不能完整完成新辅助治疗疗程的患者;(3)临床病理资料不完善患者。
按照上述标准,2016年1月至2019年1月期间,首都医科大学附属北京朝阳医院普通外科收治的134例直肠癌患者纳入本研究。其中男性82例,女性52例,男女比例为1.58∶1.00,年龄26~81(59.6±11.2)岁。采用美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版TNM分期系统进行临床分期[11]。根据患者接受的辅助治疗方案(2016年1月至2017年12月期间予以nCRT治疗,2018年1月至2019年1月期间予以TNT治疗),将患者分为nCRT组(55例)和TNT组(79例)。两组间年龄、性别、肿瘤距离肛缘的距离、ECOG评分、TNM分期等基线资料的比较,差异均无统计学意义(均P>0.05)。见表1。本研究获得首都医科大学附属北京朝阳医院伦理委员会的批准(批号:2016-科-350),患者及家属均签署知情同意书。
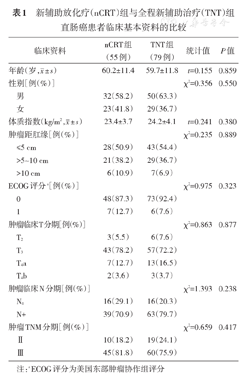
新辅助放化疗(nCRT)组与全程新辅助治疗(TNT)组直肠癌患者临床基本资料的比较
新辅助放化疗(nCRT)组与全程新辅助治疗(TNT)组直肠癌患者临床基本资料的比较
| 临床资料 | nCRT组(55例) | TNT组(79例) | 统计值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ± s) ± s) | 60.2±11.4 | 59.7±11.8 | t=0.155 | 0.859 | |
| 性别[例(%)] | χ2=0.356 | 0.550 | |||
| 男 | 32(58.2) | 50(63.3) | |||
| 女 | 23(41.8) | 29(36.7) | |||
体质指数(kg/m2, ± s) ± s) | 23.4±3.7 | 24.2±4.1 | t=0.241 | 0.380 | |
| 肿瘤距肛缘[例(%)] | χ2=0.235 | 0.889 | |||
| ≤5 cm | 28(50.9) | 43(54.4) | |||
| >5~10 cm | 21(38.2) | 29(36.7) | |||
| >10 cm | 6(10.9) | 7(6.9) | |||
| ECOG评分a[例(%)] | χ2=0.975 | 0.323 | |||
| 0 | 48(87.3) | 73(92.4) | |||
| 1 | 7(12.7) | 6(7.6) | |||
| 肿瘤临床T分期[例(%)] | χ2=0.863 | 0.877 | |||
| T2 | 3(5.5) | 6(7.6) | |||
| T3 | 43(78.2) | 57(72.2) | |||
| T4a | 7(12.7) | 13(16.5) | |||
| T4b | 2(3.6) | 3(3.7) | |||
| 肿瘤临床N分期[例(%)] | χ2=1.393 | 0.238 | |||
| N0 | 16(29.1) | 16(20.3) | |||
| N+ | 39(70.9) | 63(79.7) | |||
| 肿瘤TNM分期[例(%)] | χ2=0.659 | 0.417 | |||
| Ⅱ | 10(18.2) | 19(24.1) | |||
| Ⅲ | 45(81.8) | 60(75.9) | |||
注:aECOG评分为美国东部肿瘤协作组评分
两组患者均采用三维适形调强放疗(intensity-modulated radiation therapy,IMRT),放疗靶区均有经验丰富的放疗医师勾画确定,靶区包括原发肿瘤区域及转移淋巴结区域。放疗剂量为50.4 Gy/28 f。
放疗期间口服卡培他滨化疗,卡培他滨的剂量为825 mg/m2,口服,2次/d。放疗结束休息6~8周后行手术治疗。
于放疗前给予CapeOX方案诱导化疗1个周期;之后开始同步放化疗,期间给予CapeOX方案化疗两周期;同步放化疗结束后再给予CapeOX方案巩固化疗两周期。CapeOX方案为:奥沙利铂130 mg/m2,静脉注射,第1天;卡培他滨1 000 mg/m2,口服,2次/d,第1~14天;每3周1次。巩固化疗结束后2周行手术治疗。
年龄、性别、体质指数、肿瘤距离肛缘的距离、ECOG评分、TNM分期等基线资料。
cCR定义为:综合多种临床检查和影像学检查手段(肛门指检、肠镜、超声内镜、CT、核磁等)均未发现病变残留[12]。肿瘤消退分级(tumor regression grading,TRG)按照NCCN指南推荐的Ryan R改良的评估肿瘤治疗反应分级系统[13]:TRG 0级:完全退缩,TRG 1级:接近完全退缩,TRG 2级:部分退缩。TRG 3级:退缩不良或无退缩。对所有患者术后病理进行重新分期。pCR定义为nCRT及手术后病理证实直肠原发肿瘤完全缓解(ypT0期)和无肿瘤细胞残留,无论区域淋巴结是否受累[14]。
根据常见不良事件评价标准(common terminology criteria adverse events,CTCAE)5.0版[15]进行分级评估。
比较两组术中情况及术后30 d内出现的手术相关感染、出血、心肺系统等并发症。
应用SPSS 23.0软件进行统计分析。符合正态分布的计量资料采用 ±s表示,两组比较采用两独立样本t检验。计数资料采用例(%)表示,两组数据采用χ2检验或Fisher确切概率法;等级资料采用Kruskal-Wallis秩和检验进行比较。P<0.05表示差异有统计学意义。
±s表示,两组比较采用两独立样本t检验。计数资料采用例(%)表示,两组数据采用χ2检验或Fisher确切概率法;等级资料采用Kruskal-Wallis秩和检验进行比较。P<0.05表示差异有统计学意义。
两组患者均完整完成nCRT疗程,治疗过程发生的3~4级不良反应,见表2。两组患者在中性粒细胞减少、贫血、血小板减少、胃肠功能紊乱和放射性肠炎方面不良反应发生率差异均无统计学意义(均P>0.05)。
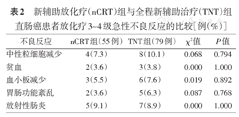
新辅助放化疗(nCRT)组与全程新辅助治疗(TNT)组直肠癌患者放化疗3~4级急性不良反应的比较[例(%)]
新辅助放化疗(nCRT)组与全程新辅助治疗(TNT)组直肠癌患者放化疗3~4级急性不良反应的比较[例(%)]
| 不良反应 | nCRT组(55例) | TNT组(79例) | χ2值 | P值 |
|---|---|---|---|---|
| 中性粒细胞减少 | 4(7.3) | 8(10.1) | 0.068 | 0.794 |
| 贫血 | 2(3.6) | 3(3.8) | 0.000 | 1.000 |
| 血小板减少 | 3(5.5) | 6(7.6) | 0.019 | 0.892 |
| 胃肠功能紊乱 | 2(3.6) | 5(6.3) | 0.087 | 0.768 |
| 放射性肠炎 | 5(9.1) | 7(8.9) | 0.000 | 1.000 |
共130例患者完成TME手术,nCRT组54例,TNT组76例。nCRT组放化疗结束至手术时间间隔为(7.0±0.1)周,TNT组为(11.0±0.1)周。相比nCRT组,TNT组采用经腹会阴联合切除术(abdominoperineal resection,APR)的比例较高,差异具有统计学意义(P=0.009)。130例患者总的并发症发生率为14.6%,包括术后吻合口漏7例,其中3例合并盆腔感染,均行二次手术治疗,其余4例经过持续冲洗治疗好转;切口感染6例,均行局部换药直至伤口愈合;吻合口出血1例,经结肠镜下止血治疗;肺部感染2例,均经抗炎治疗后痊愈;术后肠梗阻2例,均经保守治疗后好转。两组术后并发症发生率差异均无统计学意义(P>0.05)。两组手术时间、术中出血量、术后住院时间方面的差异也均无统计学意义(P>0.05)。见表3。
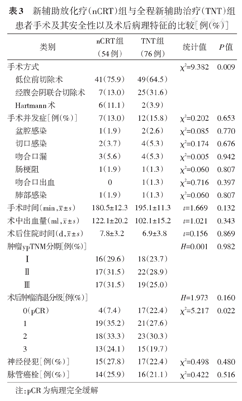
新辅助放化疗(nCRT)组与全程新辅助治疗(TNT)组患者手术及其安全性以及术后病理特征的比较[例(%)]
新辅助放化疗(nCRT)组与全程新辅助治疗(TNT)组患者手术及其安全性以及术后病理特征的比较[例(%)]
| 类别 | nCRT组(54例) | TNT组(76例) | 统计值 | P值 | ||
|---|---|---|---|---|---|---|
| 手术方式 | χ2=9.382 | 0.009 | ||||
| 低位前切除术 | 41(75.9) | 49(64.5) | ||||
| 经腹会阴联合切除术 | 7(13.0) | 25(31.6) | ||||
| Hartmann术 | 6(11.1) | 2(3.9) | ||||
| 手术并发症[例(%)] | 7(13.0) | 12(15.8) | χ2=0.202 | 0.653 | ||
| 盆腔感染 | 1(1.9) | 2(2.6) | χ2=0.085 | 0.770 | ||
| 切口感染 | 2(3.7) | 4(5.3) | χ2=0.174 | 0.676 | ||
| 吻合口漏 | 3(5.6) | 4(5.3) | χ2=0.005 | 0.942 | ||
| 肠梗阻 | 1(1.9) | 1(1.3) | χ2=0.060 | 0.807 | ||
| 吻合口出血 | 0 | 1(1.3) | χ2=0.716 | 0.397 | ||
| 肺部感染 | 1(1.9) | 1(1.3) | χ2=0.060 | 0.807 | ||
手术时间(min, ± s) ± s) | 180.5±12.3 | 195.1±11.3 | t=1.669 | 0.132 | ||
术中出血量(ml, ± s) ± s) | 122.1±20.2 | 102.1±15.2 | t=1.021 | 0.343 | ||
术后住院时间(d, ± s) ± s) | 7.8±3.2 | 6.9±3.8 | t=0.156 | 0.869 | ||
| 肿瘤ypTNM分期[例(%)] | H=0.001 | 0.982 | ||||
| Ⅰ | 16(29.6) | 18(23.7) | ||||
| Ⅱ | 17(31.5) | 22(28.9) | ||||
| Ⅲ | 17(31.5) | 19(25.0) | ||||
| 术后肿瘤消退分级[例(%)] | H=1.973 | 0.160 | ||||
| 0(pCR) | 4(7.4) | 17(22.4) | χ2=5.217 | 0.022 | ||
| 1 | 19(35.2) | 21(27.6) | ||||
| 2 | 18(33.3) | 23(30.3) | ||||
| 3 | 13(24.1) | 15(19.7) | ||||
| 神经侵犯[例(%)] | 15(27.8) | 17(22.4) | χ2=0.498 | 0.480 | ||
| 脉管癌栓[例(%)] | 14(25.9) | 16(21.1) | χ2=0.422 | 0.516 | ||
注:pCR为病理完全缓解
nCRT和TNT组在术前检查发现各有1例患者出现远处转移,未行手术治疗,两组比较,差异无统计学意义(1.8%比1.3%,χ2=0.060,P=0.807)。nCRT组有3例患者新辅助治疗后评价为cCR,全部行TME手术病理证实为pCR;而TNT组有8例评价为cCR,其中有2例拒绝行TME手术要求采取等待观察策略,目前随访6个月无明显复发转移。
130例行TME手术治疗的患者,所有手术的远切缘、环周切缘均为阴性。与nCRT组比较,两组TRG分级的差异并无统计学意义(P>0.05),但TNT组达到pCR更高,差异有统计学意义(P=0.022)。两组术后病理分期及神经侵犯和脉管癌栓的差异均无统计学意义(均P>0.05)。见表3。
随着手术技术的进步和nCRT的应用,直肠癌的局部复发得到有效控制。TME的应用极大地降低了切缘阳性率及局部复发率[16]。而nCRT使进展期直肠癌的局部复发率从18%左右降至8%,效果显著[17];但是在提高无病生存率(disease free survival,DFS)和总体生存率方面(overall survival,OS)并无明显效果[3,18]。在欧洲有研究提出,经过nCRT之后直肠癌的术后辅助化疗不能给患者带来生存获益[19]。近年来,将直肠癌的术后辅助化疗转移至手术之前,联合术前同步放化疗的模式,即TNT治疗发展起来。
本研究中共有79例采取TNT模式治疗,76例完成TME手术,术后病理TNT组22.4%获得pCR,明显高于同期nCRT组的7.4%,差异有统计学意义(P<0.05)。Cercek等[8]开展一项较大样本的研究发现,接受TNT的308例患者有110例(35.7%)获得pCR。本研究pCR率略低于上述研究。在Garcia-Aguilar等[7]最近的一项前瞻性多中心的二期试验结果显示,在nCRT和手术之间不增加、增加2个、增加4个及增加6个周期的mFOLOX6(奥沙利铂、亚叶酸钙、氟尿嘧啶),局部进展期直肠患者pCR率分别为18%、25%、30%及36%(P=0.0036)。本研究TNT组pCR率偏低可能与术前化疗周期较少有关。目前关于TNT的具体模式没有统一的规定,术前诱导化疗及同步放化疗后巩固化疗的方案、疗程和剂量都无统一标准。一项荟萃28项研究,纳入2 688例患者接受TNT模式治疗的Meta分析发现,接受TNT的患者pCR率平均为22.4%[20]。获得pCR的患者与非pCR的患者相比,有着更低的转移率和更高的生存率[21]。患者的预后与术后病理息息相关,在欧洲癌症与研究组织的临床研究亚组分析表明,降期到ypT0~2期者比降期到ypT3~4期者更可能受益于辅助化疗[22]。另外一项入组725例的回顾性研究也指出,肿瘤的病理降期与患者的预后相关,病理完全缓解、中度缓解及较差缓解的直肠癌患者5年DFS分别为90.5%、78.7%及58.5%,差异有统计学意义(P<0.001)[23]。
在放化疗急性不良反应上,本研究结果未显示两组之间的差异具有统计学意义(均P>0.05)。本研究在围手术期安全方面,TNT组手术时间(195.1±11.3)min长于nCRT组(180.5±12.3)min,这可能与TNT组中行APR的患者较多有关(31.6%比13.0%,P<0.05)。在术中出血量以及其他术后恢复的方面,两组的差异均无统计学意义(P>0.05)。这与目前的国外的研究结果类似[7]。提示,TNT的手术安全性与nCRT类似。
目前,NCCN指南推荐的nCRT后的手术间隔是5~12周。GREECCAR-6试验验证了nCRT后与手术间隔(7周比11周)对pCR率的影响,发现两组的pCR率差异无统计学意义(15.0%比17.4%,P=0.598),而且间隔11周组的术后并发症发生率均显著高于间隔7周组(44.5%比32.0%,P=0.040)[24]。本研究中,TNT组患者放疗至手术的间隔为(11.0±0.1)周,并未增加术后并发症的发生概率。Habr-Gama等[25]研究发现,CRT后间隔≥12周是安全的,且并不影响患者远期生存状况,认为较长的间隔利于肿瘤的退缩。在Cercek等[8]的研究中,TNT组的手术间隔大都在12周左右。
本研究TNT组中有8例患者nCRT后评价为cCR,其中有2例拒绝行TME手术,要求采取等待观察策略。在Habr-Gama等[26]的另一项研究中,对nCRT出现cCR的患者和术后pCR的患者进行了对比,结果表明cCR的患者术后5年DFS与pCR的患者差异无统计学意义,而在5年的OS方面,CCR者高于pCR者(100%比88%,P<0.05)。另外一项研究也显示,21例cCR患者在平均随访25个月后,只有1例出现了局部复发;cCR与pCR者比较,2年DFS差异无统计学意义[27]。本研究存在的不足之处:(1)本研究为回顾性非随机对照研究,在患者的分组上可能存在偏倚,例如,TNT组有更多的患者行APR术式。(2)本研究缺乏长期的随访资料,无法对比评价两组患者远期生存情况。(3)本研究术前化疗周期偏少,尤其是术前诱导化疗仅为1个周期,可能也是术后pCR率较低的原因之一。期待在以后的研究中,我们能够进一步扩大样本量,设计增加诱导化疗的周期,开展多心前瞻性随机对照研究,以更好地证实TNT模式在进展期直肠癌中的作用。
综上所述,在中低位进展期直肠癌的治疗中,TNT在不增加放化疗不良反应率及手术并发症发生率的前提下,pCR率高于nCRT,以期能够为采用等待观察非手术策略的患者带来希望。
所有作者均声明不存在利益冲突



























