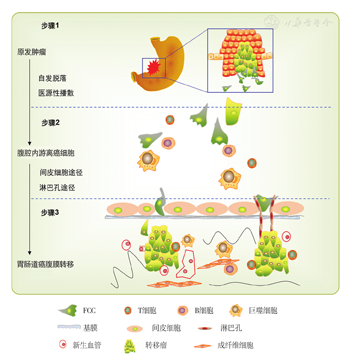
胃肠道癌腹膜转移是目前临床治疗的最大难题,解决该难题的根本之道在于临床医生准确把握胃肠道癌腹膜转移的核心细胞病理学机制,基本掌握分子病理学机制,并融会贯通地运用到每一例患者诊治的临床决策过程中,做到"防""治"并举,积极预防、主动治疗。与临床治疗决策密切相关的胃肠道癌腹膜转移的核心细胞病理学机制有4点:(1)腹腔游离癌细胞或微癌灶定植于腹膜,对腹膜间皮细胞造成不可逆病理性损害;(2)定植的癌细胞进一步侵袭腹膜特定结构乳斑,启动加速侵袭性生长过程;(3)腹膜间质纤维化过程加重腹膜的结构性破坏;(4)癌细胞与乳斑中免疫细胞的相互作用,形成促进腹膜转移癌生长的容受性免疫微环境。这4条核心细胞病理学机制互为因果,相互促进,构成腹膜转移发展的恶性循环。临床医生只要准确把握这4点,就有可能掌握临床诊治决策先机,将应对性被动治疗变为预防性主动治疗,改善胃肠道癌腹膜转移临床诊治现状。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃肠道癌是临床肿瘤治疗的重点[1,2]。在进展期癌占我国绝大多数胃肠道肿瘤的今天,临床医生关注的焦点就是肿瘤的进展方式,以及针对性的治疗策略。胃肠道癌的主要进展方式是侵袭和转移,而肿瘤转移则是其最本质特性。胃肠道癌的经典转移途径包括淋巴结转移、血道转移和腹膜种植转移3种。梳理胃肠道癌外科临床综合治疗的发展历史脉络,可以清晰看到3个历史性飞越阶段。首先是发展了针对淋巴结转移的外科综合治疗技术体系,包括诊断分期和治疗技术标准,从而大大提升了胃肠道癌淋巴结转移的外科综合治疗能力;然后是发展了针对血道转移的外科综合治疗技术体系,包括针对肝转移、肺转移的诊断分期和外科综合治疗技术标准,从而明显提升了肿瘤肝脏寡转移和肺脏寡转移的外科综合治疗能力;最后是发展了针对腹膜种植转移外科综合治疗技术体系,包括腹膜转移癌的诊断分期和外科综合治疗技术,从而逐步提高了胃肠道癌腹膜转移(gastrointestinal cancer peritoneal metastasis,GICPM)外科综合治疗能力。然而,就我国总体而言,GICPM仍然是临床肿瘤治疗中的最大难题。解决该难题的根本之道,在于广大肿瘤临床医师不仅关注单纯治疗技术,更要着力研究并准确把握GICPM的基本临床病理机制[3,4]。
GICPM通常起源于腹腔内游离癌细胞(free cancer cell,FCC)的微转移,而FCC又有两个不同来源:(1)肿瘤侵袭的自然过程所导致的原发肿瘤细胞脱落;(2)手术切除肿瘤过程中,由于手术操作导致癌细胞的医源性扩散[5]。FCC可通过间皮细胞途径和(或)淋巴孔途径形成腹膜转移癌:(1)间皮细胞途径:部分FCC附着于腹膜间皮细胞后,释放细胞因子使间皮细胞骨架收缩,FCC通过间皮细胞间裂隙转移并侵入至间皮下,破坏腹膜屏障,增殖生长,形成有新生血管的转移瘤;(2)淋巴孔途径:FCC分泌的细胞因子使间皮细胞收缩,导致腹膜乳斑上的淋巴孔暴露,FCC直接通过淋巴孔迁移至间皮下淋巴管,增生并新生血管,形成转移瘤,见图1[6,7]。随着肿瘤从黏膜到浆膜的深度侵袭,腹腔细胞学中的FCC阳性率增加。腹膜转移癌患者的腹腔灌洗液(或腹水)内FCC阳性率达到93%~100%[8]。传统根治性手术不能根治FCC,这也是GICPM发生率高、预后差的主要原因[9]。
目前,对临床诊治决策有决定性影响的核心病理学因素包括以下4点。
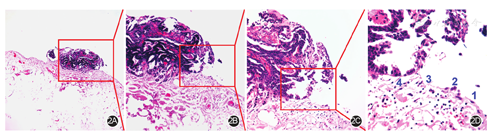
癌细胞在腹腔内定植的过程是形成腹膜转移癌的第一个核心步骤。图2展示了一个微转移灶定植于腹膜的基本病理过程,包括定植部位腹膜的间皮细胞产生一系列细胞变性,间皮细胞凋亡脱落,暴露间皮下的纤维结缔组织粗糙面,癌细胞通过异质性黏附作用,紧密锚定于纤维结缔组织,启动侵袭性生长过程[10]。该病理机制的临床治疗学意义在于:(1)癌细胞或微转移灶的定植过程有部位趋向性,核心部位包括盆底腹膜、左右膈肌腹膜、大小网膜等,因此这种定植一开始就呈广域性特点;(2)该定植阶段,肿瘤的侵袭深度仍局限于浅表,尚未对腹膜造成深层结构性破坏,因此对各种机械性、物理性及化学性干预措施都比较敏感;(3)凡是直接损伤腹膜间皮细胞理化屏障的各种操作,如果不辅助以预防性的保护技术,则均可导致腹膜种植转移,如各种二氧化碳气腹技术下的腹腔种植。

GICPM的形成也是"种子与土壤学说"的一种表现形式,在腹膜中这种特定"土壤"是一种称之为乳斑的淋巴样组织,见图3。该结构的基本细胞组成是巨噬细胞和各种表型的淋巴细胞,其中巨噬细胞是启动癌细胞侵袭乳斑的关键。
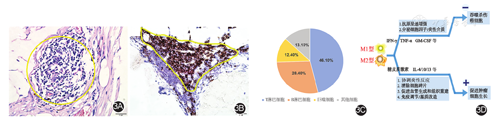

癌细胞种植后,乳斑巨噬细胞数增多,体积增大,形态不规则,电镜下观察其胞核浓密,染色质聚集,胞浆内含有丰富的线粒体、高尔基复合体、内质网,胞膜表面有长而密的突起,与癌细胞毗邻。乳斑内巨噬细胞对癌细胞的种植具有双向调控作用。根据调控肿瘤细胞生长和诱导Th1或Th2应答的不同,可以把巨噬细胞分成M1型(经典活化型)和M2型(替代活化型)[11]。M1型巨噬细胞抗原呈递功能增强,分泌细胞因子或其他炎性介质,起到抗肿瘤作用;M2型巨噬细胞即肿瘤相关巨噬细胞(tumor-associated macrophage,TAM),表达多种细胞因子刺激肿瘤增生和存活,其中转化生长因子β1(transforming growth factor-β1,TGF-β1)参与上皮间质转化,诱导网膜间皮纤维化,截留肿瘤细胞定植,形成微转移灶。TAM合成尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,u-PA)、MMP等参与肿瘤细胞外基质的降解,促进肿瘤血管的形成、侵袭和浸润[12]。
研究乳斑转移病理机制的治疗学意义在于:(1)GICPM会产生特定的腹膜微环境免疫学紊乱,典型表现为乳斑中巨噬细胞表型转变及淋巴细胞的功能障碍;(2)调节乳斑免疫微环境的治疗措施,应当作为未来防控GICPM的重要方向;(3)可以通过系统用药或区域用药来调节肿瘤免疫微环境。
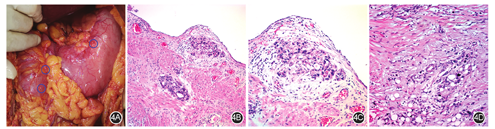
癌细胞一旦进入乳斑后,即开启快速发展的侵袭性生长模式。其主要表现为:(1)肿瘤细胞出现异质性变化,一部分细胞保持原有细胞形态,另一部分细胞出现上皮-间质转化的特征;(2)癌细胞迅速诱发周围的间质细胞转变为纤维细胞,出现持续进展的广泛腹膜纤维化过程;(3)该纤维化过程主要呈表面延伸性发展,但在小肠系膜缘往往出现深入潜掘式生长,迅速导致小肠系膜挛缩[13],见图4。这些病理特征的治疗学意义在于,必须采取一些局部的处理措施来减缓或终止该病理过程,尤其是通过创新性外科手段。

腹膜免疫微环境的动态变化,一直贯穿于GICPM病理发展的全过程。采用量子点标记探针技术,标记癌细胞及腹腔内各种关键免疫细胞,研究癌细胞与腹腔内免疫细胞的关系,发现随着癌细胞与免疫细胞数量比例关系的变化,腹腔内的免疫微环境逐步从免疫攻击型变为免疫容受型,腹膜免疫微环境不但失去了对癌细胞的抵抗作用,还越来越有利于癌细胞的侵袭性生长[14]。见图5。
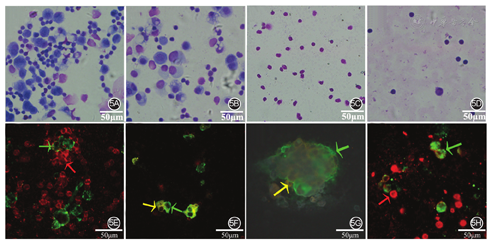

注:5A~5D:吉姆萨染色;5E~5H:量子点标记分子探针技术
从细胞病理角度研究腹膜免疫微环境变化的意义在于,临床医师务必明确认识到,GICPM的形成,一定是腹膜腔大区域免疫微环境紊乱后的必然表现,在设计和实施针对GICPM的治疗方案时,一定要想方设法维护和促进腹膜自身免疫力的抗肿瘤作用。
正如其他形式的癌转移一样,GICPM形成过程也涉及到一系列复杂的分子信号调控通路。虽然不同来源的FCC在腹膜转移的早期阶段表现出多样性,但在转移过程中均经历黏附、降解、迁移、血管生成和免疫逃逸等几个方面[15]。目前GICPM所涉及的主要分子信号调控通路见图6[15]。
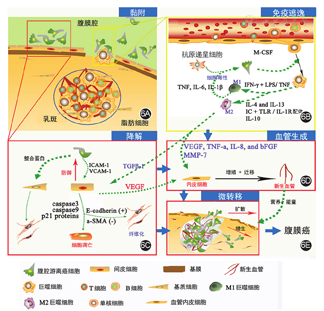

注:M-CSF:巨噬细胞集落刺激因子;TNF-α:肿瘤坏死因子α;IL:白细胞介素;IFN-γ:干扰素γ;LPS:脂多糖;IC:免疫复合物;TLR:Toll样受体;TGFβ-1:转化生长因子β1;ICAM-1:细胞间黏附分子-1;VCAM-1:血管细胞粘附分子-1;VEGF:血管内皮生长因子;a-SMA:a-血管平滑肌肌动蛋白;bFGF:碱性成纤维细胞生长因子;MMP-7:基质金属蛋白酶7;FCC:腹腔内游离癌细胞;GICPM:胃肠道癌腹膜转移
"研究腹膜肿瘤病理,做好腹膜表面文章",是本领域的学科发展要义。GICPM核心病理机制的主要观点包括:(1)GICPM的形成,FCC是关键,FCC既可能是由于自然病程进展,也可能来自各种不恰当干预操作造成的"医源性播散";(2)腹膜转移有独特的肿瘤生物学规律和特点,其核心机制是腹膜间皮细胞破坏,癌细胞与腹膜表面特定结构乳斑的相互作用,形成有利于癌细胞在腹膜定植和增生的微环境;(3)腹膜转移有特定的分布形式,集中分布于膈肌腹膜、盆腔腹膜、大小网膜、小肠系膜缘、结直肠肠脂垂;(4)GICPM临床期有特殊的表现形式,3个经典表现是难治性腹水、顽固性腹痛和进展性肠梗阻;(5)GICPM往往表现为广域性分布和浅表性发展的特点,故临床治疗中要重点关注大区域的腹膜表面综合治疗。
上述核心病理机制的治疗学意义在于:(1)GICPM有准确的诊断学认识,这是一种区域性癌转移而非广泛的全身转移。(2)在胃肠道癌的外科治疗中,首先要深化、强化、拓展"无瘤原则",做到"手里拿着柳叶刀,心里想着癌细胞",这包括手术中尽量减少FCC或微癌灶脱落;同时注意预防腹膜间皮细胞理化屏障的损伤,对于可能损伤其理化屏障的操作,需辅以相应保护措施;围手术期腹腔化疗技术也可用于GICPM的预防。(3)在做好传统手术的同时,务必重点发展腹膜表面综合治疗技术,包括传统切除外科和现代的水、火、电外科技术等。(4)GICPM的核心治疗策略,是以肿瘤细胞减灭术加灌注化疗为主的外科整合治疗技术,肿瘤细胞减灭术尽可能切除腹盆腔肉眼可见的病灶,灌注化疗清除肉眼不可见的腹盆腔内微转移灶和FCC,两者结合以期达到"细胞学根治"[16]。(5)联合腹腔化疗技术、分子靶向治疗技术、系统性和区域性免疫增强技术,维护和促进腹膜自身免疫力的抗肿瘤作用,要点是强调区域控制、重视整体稳定。
因此,临床医生准确把握GICPM的核心细胞病理学机制,基本掌握分子病理学机制,从而融会贯通地运用到每一例患者诊治的临床决策过程中,做到"防""治"并举,积极预防、主动治疗,这就是临床医生必须熟知GICPM病理机制的治疗学意义。
所有作者均声明不存在利益冲突