
结直肠癌是全球第三大肿瘤,治疗手段包括手术、化疗、放疗和靶向治疗等。免疫检查点抑制剂的出现改写了许多瘤种的诊治指南。免疫检查点抑制剂在不同微卫星状态结直肠癌中有着显著的疗效差别,微卫星高度不稳定(MSI-H)结直肠癌无论是在后线、一线、辅助还是新辅助治疗方面,均取得了突破。KEYNOTE-177研究已经成功地改写了指南,帕博利珠单抗成为一线MSI-H晚期结直肠癌的标准治疗。NICHE研究将免疫治疗用于结直肠癌的新辅助治疗,在MSI-H结直肠癌中也取得了令人振奋的成绩。而对于微卫星稳定(MSS)结直肠癌,许多研究正在进行,免疫治疗尚不能挑战传统治疗的地位。本文就免疫检查点抑制剂治疗结直肠癌的相关临床研究进行梳理,期望为结直肠癌免疫治疗的发展提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌在全球范围内,发病率在肿瘤中排第3位,是肿瘤死亡的第2大常见原因[1]。结直肠癌标准的治疗方法包括手术、化疗、放疗和靶向治疗等。免疫治疗的出现极大地改变了许多晚期肿瘤的治疗格局,但在结直肠癌中,比较明显的获益仅限于微卫星高度不稳定(microsatellite instability-high,MSI-H)或错配修复缺陷(mismatch repair deficient,dMMR)的患者[2]。目前,结直肠癌免疫治疗的临床试验涵盖了晚期后线、一线或二线,甚至早期新辅助或辅助治疗,这些临床试验已经改写了部分诊治指南,使得免疫治疗在结直肠癌的综合治疗中已占一席之地[3]。本文对免疫检查点抑制剂治疗结直肠癌的临床研究进行梳理,并讨论未来免疫治疗在结直肠癌中的应用价值和前景,以期为同行提供参考。
在发现MSI-H生物标志物的意义之前,免疫检查点抑制剂的初步研究就已经开展。在纳武利尤单抗治疗39例不同瘤种患者的试验中,14例晚期结直肠癌患者中有1例获得了持续3年以上的完全缓解,该患者后来被诊断为MSI-H[4,5]。在涉及20种不同类型肿瘤的KEYNOTE-028研究中,只有MSI-H晚期结直肠癌患者应用帕博利珠单抗后得到了部分缓解[6]。KEYNOTE-016研究提示,帕博利珠单抗三线或以上方案治疗dMMR结直肠和非结直肠患者均表现出良好的抗肿瘤活性,并可获得持续应答。晚期结直肠癌dMMR患者的客观缓解率(objective response rate,ORR)为40%(4/10),而pMMR组ORR为0[7,8]。这些临床试验促进了2017年5月美国FDA批准帕博利珠单抗用于二线及以上的MSI-H晚期实体瘤[9]以及2020年FDA批准帕博利珠单抗用于TMB-H肿瘤[10]。NCCN和CSCO指南推荐的关键临床研究见表1。
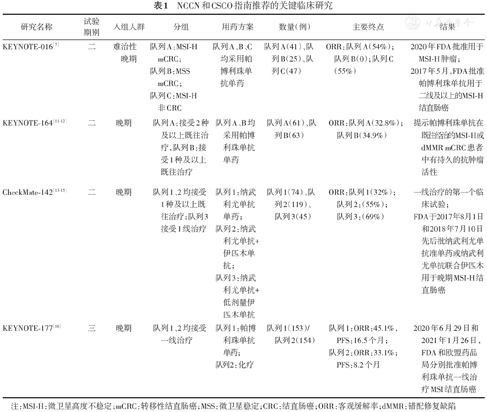
NCCN和CSCO指南推荐的关键临床研究
NCCN和CSCO指南推荐的关键临床研究
| 研究名称 | 试验期别 | 入组人群 | 分组 | 用药方案 | 数量(例) | 主要终点 | 结果 |
|---|---|---|---|---|---|---|---|
| KEYNOTE-016[7] | 二 | 难治性晚期 | 队列A:MSI-H mCRC;队列B:MSS mCRC;队列C:MSI-H非CRC | 队列A、B、C均采用帕博利珠单抗单药 | 队列A(41)、队列B(25)、队列C(47) | ORR:队列A(54%);队列B(0);队列C(55%) | 2020年FDA批准用于MSI-H肿瘤;2017年5月,FDA批准帕博利珠单抗用于二线及以上的MSI-H结直肠癌 |
| KEYNOTE-164[11,12] | 二 | 晚期 | 队列A:接受2种及以上既往治疗,队列B:接受1种及以上既往治疗 | 队列A、B均采用帕博利珠单抗单药 | 队列A(61)、队列B(63) | ORR:队列A(32.8%);队列B(34.9%) | 提示帕博利珠单抗在既往经治的MSI-H或dMMR mCRC患者中有持久的抗肿瘤活性 |
| CheckMate-142[13,14,15] | 二 | 晚期 | 队列1、2均接受1种及以上既往治疗;队列3接受1线治疗 | 队列1:纳武利尤单抗单药;队列2:纳武利尤单抗+伊匹木单抗;队列3:纳武利尤单抗+低剂量伊匹木单抗 | 队列1(74)、队列2(119)、队列3(45) | ORR:队列1(32%);队列2:(55%);队列3:(69%) | 一线治疗的第一个临床试验;FDA于2017年8月1日和2018年7月10日先后批纳武利尤单抗准单药或纳武利尤单抗联合伊匹木用于晚期MSI-H结直肠癌 |
| KEYNOTE-177[16] | 三 | 晚期 | 队列1、2均接受一线治疗 | 队列1:帕博利珠单抗单药;队列2:化疗 | 队列1(153)/队列2(154) | 队列1:ORR:45.1%,PFS:16.5个月;队列2:ORR:33.1%;PFS:8.2个月 | 2020年6月29日和2021年1月26日,FDA和欧盟药品局分别批准帕博利珠单抗一线治疗MSI结直肠癌 |
注:MSI-H:微卫星高度不稳定;mCRC:转移性结直肠癌;MSS:微卫星稳定;CRC:结直肠癌;ORR:客观缓解率;dMMR:错配修复缺陷
KEYNOTE-164研究带领MSI-H结直肠癌进入了免疫治疗的时代。这项二期临床研究纳入了既往接受过2线及以上(队列A)和接受过1线及以上(队列B)治疗的晚期MSI-H结直肠癌患者,应用帕博利珠单抗治疗共2年或至疾病进展、不可耐受的毒性或研究者决定终止治疗,研究结果显示,中位随访5年后,队列A和队列B的ORR分别为32.8%和34.9%,中位OS分别为31.4个月和47个月,中位持续缓解时间均未达到,3年持续缓解率高达93%。此外,KEYNOTE-164研究允许进展后重启17周期的PD-1单抗治疗,9例患者中2例再次获得部分缓解,6例疾病稳定,有效持续时间超过12个月[11]。KEYNOTE-164研究提示,帕博利珠单抗显示出持久的抗肿瘤活性,可延长既往接受过治疗的晚期MSI-H或dMMR结直肠癌患者的OS,且安全性可控。KEYNOTE-164研究重启治疗的数据提示,部分经帕博利珠单抗治疗后发生病情进展的患者重启帕博利珠单抗后仍可见临床获益。
CheckMate-142研究是PD-1单抗和CTLA-4抑制剂联合治疗MSI-H结直肠癌的探索性研究,这项二期临床试验比较了纳武利尤单抗对比纳武利尤单抗联合伊匹木单抗治疗二线或以上MSI-H晚期结直肠癌,研究结果显示,后线治疗中双免疫联合组的ORR优于单免疫组(55%比32%),这提示在不考虑毒性及经济成本时,后线采用双免疫联合治疗可能会达到更高的应答率[14]。但对于MSI-H后线患者的治疗,无论单免疫还是双免疫,ORR均能得到提升,有持续生存获益的趋势,生存有待延长随访时间进一步验证。
CheckMate-142研究提示了免疫治疗从后线向一线的发展,这项研究中的队列3采用纳武利尤单抗(3 mg/kg,每2周1次)加低剂量伊匹木单抗(1 mg/kg,每6周1次)的联合用药作为一线治疗。截止2019年10月,这组患者的中位随访时间为29.0个月,ORR和疾病控制率分别为69%和84%,完全缓解率为13%;中位无进展生存时间(PFS)和中位总体生存率(OS)未达到24.2个月的最短随访,2年无进展生存率(PFS)为74%,2年OS为79%。无论基线人口统计学和肿瘤特征如何,无论BRAF或KRAS是否突变,均能观察到临床获益[15]。CheckMate-142研究具有划时代的意义,它将免疫治疗从三线治疗前移到一线治疗。
KEYNOTE-177研究可以说是目前一线治疗中最重要的临床试验。这是一项三期国际开放标签随机对照研究,比较帕博利珠单抗治疗(200 mg,每3周1次,最多35个周期)与在一线中使用或不使用抗VEGF或抗EGFR单克隆抗体的标准双药化疗,对MSI-H转移性结直肠癌患者的疗效,这项试验的主要终点是PFS和OS。KEYNOTE-177研究结果显示,帕博利珠单抗组患者的中位PFS为16.5个月(95%CI:5.4~38.1),而化疗组为8.2个月(95%CI:6.1~10.2);帕博利珠单抗组和化疗组的3年PFS分别为42%、11%,3年OS分别为61%、50%。帕博利珠单抗组最终确定的ORR为45.1%(20例完全缓解,49例部分缓解),化疗组为33.1%(6例完全缓解,45例部分缓解);帕博利珠单抗组83.5%的患者至少维持缓解了2年;在化疗组中,只有33.6%的患者缓解持续时间≥2年[16]。KEYNOTE-177研究证实了帕博利珠单抗可以作为MSI-H或dMMR患者的一线标准治疗。KEYNOTE-177研究成功地改写了NCCN结直肠癌诊疗指南[17],同时在国内也获得了2021年CSCO结直肠癌诊疗指南的一级专家推荐[18]。
COMMIT研究是一项前瞻随机开放标签的三期临床研究(NCT02997228),评估了阿特珠单抗单药治疗对比mFOLFOX6(氟尿嘧啶、奥沙利铂、亚叶酸钙)+贝伐单抗+阿特珠单抗一线治疗dMMR或MSI-H转移性结直肠癌的疗效和安全性,目前该试验还在进行中。未来该项研究的结果将回答对于MSI-H晚期结直肠癌,在一线免疫治疗的基础上联合化疗和抗血管靶向药物是否可以进一步提高免疫治疗的疗效[19]。
CheckMate 8HW是另一项随机对照三期临床研究,在一线治疗dMMR或MSI-H转移性结直肠癌中,比较纳武利尤单抗单药、纳武利尤单抗联合伊匹木单抗以及研究者选择的化疗这3种方案的疗效(NCT04008030)。这项研究将头对头地比较对于MSI-H晚期结直肠癌双免联合是否优于单免的疗效。
晚期结直肠癌的研究数据提示我们,对于MSI-H结直肠癌常规化疗疗效欠佳,那么对于MSI-H结直肠癌术后标准辅助化疗的作用到底如何?术后辅助免疫治疗能否提高这一亚型患者的预后?目前正在开展的以下几个三期临床研究正试图回答这一问题。
ATOMIC研究(NCT02912559)是阿特珠单抗联合化疗对比化疗辅助治疗Ⅲ期dMMR结直肠癌的临床研究,主要终点是DFS。化疗组最多12个周期,而化疗联合阿特珠单抗组化疗12个周期,阿特珠单抗在第一或第二次化疗时开始,不超过25个周期。研究目前正在进行中。这项研究对辅助治疗的模式进行了探索,结果值得期待。
POLEM试验(NCT03827044)是阿维鲁单抗联合含氟嘧啶化疗辅助治疗dMMR或POLE核酸外切酶突变的结肠癌多中心三期随机临床研究。所有患者均接受12或24周的辅助化疗,之后试验组的患者接受24周阿维鲁单抗(每2周1次)治疗。该研究主要终点为DFS,试验目前正在进行中,如果POLEM试验达到主要终点,对于dMMR或POLE核酸外切酶突变的患者,标准辅助治疗后联合免疫治疗将成为可能。
在美国进行的另一项三期临床试验(NCT-03803553),将在循环肿瘤DNA(circulating tumor DNA,ctDNA)阳性患者人群中,评估MSI-H结直肠癌在标准辅助化疗后纳武利尤单抗的疗效,结果值得期待。
新辅助免疫治疗可以在肿瘤切除前,提前使患者的免疫系统识别肿瘤的变异,从而使患者的免疫系统更好地产生免疫应答。目前结直肠癌新辅助治疗的探索均为二期研究,探索模式多为双免疫或免疫联合化疗方案,直肠癌多为免疫联合放化疗(同步或序贯)的模式。
NICHE研究是探索纳武利尤单抗联合伊匹木单抗用于早期结肠癌新辅助治疗的二期临床研究,研究共纳入40例结肠癌患者,其中21例为dMMR,20例为pMMR(1例患者同时为pMMR和dMMR),81%的dMMR患者和40%的pMMR患者为临床Ⅲ期结肠癌。在3例患者接受纳武利尤单抗单药安全性用药后,其余37例患者接受伊匹木单抗+纳武利尤单抗方案治疗。患者在接受首次免疫治疗后不迟于6周内接受结肠癌手术,dMMR结肠癌患者接受新辅助免疫治疗的缓解率达到100%,其中完全缓解的患者占60%(12/20);pMMR治疗组27%的患者也对免疫治疗产生了良好的应答[20]。NICHE研究提示,dMMR结肠癌患者术前新辅助免疫治疗可以获得非常高的pCR率,pMMR组的治疗反应也非常可观。鉴于所有非转移性结肠癌患者中有85%为pMMR,该研究表明pMMR结肠癌也有可能从新辅助免疫治疗中获益。
对于MSI-H或dMMR结直肠癌,在2021第1版NCCN结肠癌和直肠癌指南上,新辅助治疗增加纳武利尤单抗±伊匹木单抗或帕博利珠单抗单药方案;转化治疗可以选择双免疫或单免疫用药方案[21,22]。在2021版CSCO结直肠癌诊疗指南中,MSI-H结直肠癌姑息一至三线均推荐免疫治疗,其中帕博利珠单抗作为一线治疗的一级推荐;不可切除结肠癌(部分T4b、M0的患者即使采用联合脏器切除也无法达到根治的目的)的治疗中新增注释f "基于KEYNOTE 177研究结果,MSI-H或dMMR患者在转化治疗或姑息性治疗中可考虑使用PD-1抑制剂免疫治疗"[18]。
绝大多数结直肠癌是微卫星稳定(microsatellite stability,MSS)的,但MSS结直肠癌患者几乎不能从单药免疫检查点抑制剂中获益。KEYNOTE-016研究和KEYNOTE-028研究分别纳入了18例和22例MSS转移性结直肠癌患者,均观察到对免疫治疗无反应[6,7]。目前,临床研究的重点均在免疫检查点抑制剂的联合用药方面。联合治疗可使肿瘤向"免疫活性"转变,使"冷"肿瘤升温,最终达到治疗目的[23]。目前常用的联合方式包括免疫联合化疗、免疫联合MEK抑制剂、免疫联合酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)、双免联合、免疫联合抗EGFR及免疫联合放疗等。
化疗与免疫治疗之间具有协同作用,肿瘤细胞在受到化疗药物作用后凋亡,特异性抗原暴露,直接激活免疫系统,诱发免疫应答;另一方面,肿瘤细胞对免疫系统有抑制作用,化疗可以降低这些抑制作用,从而改善免疫抑制性的肿瘤微环境。化疗通过对免疫治疗的抗肿瘤增强效应,进一步提高缓解率,扩大免疫治疗的获益人群。免疫联合化疗已经成为许多瘤种的一线治疗标准。在MSS结直肠癌中也在进行免疫联合化疗的临床试验。然而,数据并没有那么令人振奋。
KEYNOTE-651研究(NCT03374254)是一项二期临床研究,队列B采用的是帕博利珠单抗联合mFOLFOX7方案一线治疗晚期结直肠癌,队列D采用的是帕博利珠单抗联合FOLFIRI方案二线治疗晚期结直肠癌,根据2020年ESMO公布的队列B和D的结果,队列B帕博利珠单抗+mFOLFOX7方案初治非MSI-H或pMMR的患者,研究结果显示在31例初治患者中仅1例出现疾病进展;队列D帕博利珠单抗+FOLFIRI组中位随访时间43个月,PFS为17.4个月,客观缓解率为16%[24]。这提示帕博利珠单抗联合化疗在一线、二线均有一定疗效。
BACCI研究(NCT02873195)也是一项二期临床研究,纳入的是标准治疗失败的患者,后线分别采用卡培他滨+贝伐珠单抗、卡培他滨+贝伐珠单抗+阿特珠单抗,两组的ORR(4.35%比8.54%,P=0.5)、PFS(3.3个月比4.4个月,P=0.051),差异均无统计学意义[25]。在该研究中,卡培他滨+贝伐珠单抗+阿特珠单抗组的PFS和OS没有得到明显改善,但ORR由4.35%提高到8.54%,值得进一步探索和关注。
AVETUXIRI研究(NCT03608046)是一项阿维鲁单抗联合西妥昔单抗和伊立替康治疗难治性MSS转移性结直肠癌的临床研究,该研究根据RAS突变状态分组,第一阶段研究结果显示:RAS野生组ORR为30%,达到预先设定的阈值,继续进行第二阶段研究[26]。RAS野生组中没有观察到部分缓解,但RAS野生组和RAS突变组的DCR分别为60%和61.5%,PFS分别为4.2个月和3.8个月,OS分别为12.7个月和14.0个月,6个月PFS分别为40.0%和38.5%,12个月OS分别为53.3%和57.7%。本研究中RAS突变组的DCR、PFS、OS结果令人鼓舞,未来可以对RAS突变队列做更多拓展研究,也提示在转移性结直肠癌免疫联合治疗领域还有非常大的探索空间[26]。
AtezoTRIBE研究是一项二期临床研究,采用FOLFOXIRI+贝伐珠单抗±阿特珠单抗一线治疗不可切除晚期结直肠癌。三药化疗被认为能最大程度释放肿瘤抗原,贝伐珠单抗被认为可以调节免疫微环境,因此三药联合贝伐珠单抗再联合免疫治疗也被大家所期待。结果显示:联合阿特珠单抗组的PFS更优(13.1个月比11.5个月,P=0.012),但ORR没有显著优势(59%比64%,P=0.412),阿特珠单抗并没有显著增加不良反应发生率,表明在FOLFOXIRI+贝伐珠单抗中添加阿特珠单抗,可延长转移性结直肠癌患者的PFS[27]。但是这种强强组合所带来的PFS获益与不良反应之间的平衡,也引起了广泛的争议。
METIMMOX研究是一项二期临床研究,旨在对比MSS转移性结直肠癌一线治疗的疗效,试验组采用FLOX方案+纳武利尤单抗(FLOX 2周期续贯纳武利尤单抗2周期,共8周期),对照组单独使用FLOX方案,主要终点是PFS。在平均6.4(0.5~20)个月的随访中,FLOX组患者的中位PFS为5.6个月,FLOX+纳武利尤单抗组的中位PFS为6.6个月。FLOX+纳武利尤单抗组中,4例(16%)RAS或BRAF突变患者在8个月后完全缓解,9例(32%)患者持续客观缓解。FLOX组8个月时无完全缓解者,持续客观缓解6例(23%)[28]。这项研究提示,MSS转移性结直肠癌患者短程奥沙利铂化疗后,可能改变肿瘤的免疫原性,诱发对免疫检查点抑制剂的反应,相关预测生物标志物的工作正在进行中。
NCT04547166研究是一项HLX10(重组抗PD-1人源化单克隆抗体注射液)联合HLX04(贝伐珠单抗)及化疗(XELOX),对比安慰剂联合安维汀(贝伐珠单抗)及化疗(XELOX)一线治疗转移性结直肠癌的多中心随机双盲平行对照、分三阶段开展的二期和三期临床试验。这是我国研究者开展的结直肠癌免疫联合治疗进一步探索的研究,主要终点为PFS。这项研究探索在化疗联合靶向的基础上,联合应用免疫治疗是否会进一步提高疗效。
MODUL研究是针对一线治疗后稳定的患者采用氟尿嘧啶+贝伐珠单抗联合或不联合阿特珠单抗作为维持治疗,联合组和非联合组的PFS分别为7.39和7.20个月,OS分别为21.91和22.05个月,表明免疫治疗加入维持治疗并不改善晚期MSS结直肠癌患者的预后[29]。
MEK抑制剂可能使肿瘤对免疫疗法更敏感,具体机制可能是增加了肿瘤中活跃的免疫细胞数量(如CD8+),并增加了促免疫系统活化因子的表达。IMblaze370研究是一项探索阿特珠单抗+考比替尼、阿特珠单抗、瑞戈非尼治疗化疗耐药的转移性结直肠癌的三期临床研究,纳入363例患者,中位随访时间为7.3个月,3组的中位OS分别为:阿特珠单抗+考比替尼组为8.87个月,阿特珠单抗组为7.10个月,瑞戈非尼组为8.51个月。IMblaze370未达到主要终点,各组相比,总生存时间未改善。研究结果表明,对于MSS、免疫炎性基线水平较低的转移性结直肠癌患者而言,免疫治疗并未带来更多获益[30]。
临床前数据已经证明抗血管生成抑制剂具有广泛的调节肿瘤免疫微环境的作用。VEGF可促进有缺陷和渗漏的肿瘤血管生长,阻碍免疫效应细胞的肿瘤浸润,产生免疫抑制。VEGF还可以直接抑制局部和全身的免疫反应。抗VEGF治疗可以逆转这些免疫抑制机制,可能会使肿瘤微环境"正常化",促进免疫治疗的疗效。免疫治疗联合抗VEGF组合已在多种肿瘤中显示出优势。多种联合治疗的尝试中最具代表性的是多靶点TKI联合免疫治疗。多靶点TKI对肿瘤的微环境起调控作用,不同的药物调控机理不尽相同。例如,瑞戈非尼可通过VEGFR、TIE2、CSF-1R三条通路调节Treg和TAM细胞的活性,解除免疫抑制,从而改善肿瘤微环境,为联合治疗起到铺垫作用[31]。
REGONIVO研究是来自日本的一项ⅠB期研究,该研究采用瑞戈非尼联合纳武利尤单抗治疗MSS晚期胃癌和结直肠癌,ORR达40%,中位PFS达7.8个月,其中MSS结直肠癌患者ORR能够达到36%[32]。然而,来自北美的单臂瑞戈非尼联合纳武利尤单抗治疗pMMR或MSS结直肠癌患者的二期研究(NCT04126733)中,ORR只有7%,PFS为1.8个月[33]。在法国的二期REGOMUNE试验中,使用瑞戈非尼联合阿维鲁单抗治疗48例MSS转移性结直肠癌患者,ORR为0[34]。我国的REGOTORI研究(瑞戈非尼联合特瑞普利单抗)提示ORR只有15.2%,PFS为2.6个月[35]。我国的一项真实世界研究(NCT04771715)收集了84例患者接受免疫检查点抑制剂联合瑞格非尼治疗,其中76例(90%)患者确认为MSS状态,中位随访5.5个月,4例(5%)患者部分缓解,37例(45%)患者最佳疗效为病情稳定,PFS为3.1个月,OS为17.3个月。该研究认为,免疫检查点抑制剂联合瑞格非尼治疗对部分化疗难治性MSS结直肠癌可能是一种有价值的治疗方案[36]。综上所述,目前瑞戈非尼+不同免疫治疗的组合的研究,疗效差异较大,正在进行的三期试验(瑞戈非尼联合纳武利尤单抗,NCT04879368)可能会对这种治疗组合提供明确的结论。
"可乐组合"在各种实体瘤中也有成功的经验。LEAP-005(NCT03797326)研究是一项仑伐替尼联合帕博利珠单抗在先前治疗过的实体瘤患者中的二期多队列临床试验。结直肠癌队列中32例患者接受了治疗,中位OS为10.6个月(95%CI:5.9~13.1),ORR为22%(95%CI:9~40)[37]。这个组合表现出了良好的抗肿瘤活性和可控的安全性。目前启动了三期LEAP-017研究(NCT04776148),非MSI-H或dMMR患者接受帕博利珠单抗(400 mg,每6周1次)联合仑伐替尼(20 mg,每天1次),或标准的三线治疗即瑞戈非尼(160 mg,每天1次,每4周1次)或TAS-102(35 mg/m2,每4周1次),这项头对头的比较非常令人期待。这也提示,免疫检查点抑制剂联合TKI的组合可能会为晚期MSS结直肠癌带来新的希望。
CCTG CO.26研究是度伐利尤单抗+替西木单抗(Tremelimumab)+最佳支持治疗对比单纯最佳支持治疗用于晚期难治性结直肠癌的二期临床研究,研究人群大多为MSS结直肠癌经治患者(166/180),治疗组使用替西木单抗(每4周75 mg,共4个周期)+度伐利尤单抗(每4周1 500 mg),双免疫联合治疗组和最佳支持治疗组的中位OS分别为6.6个月、4.1个月(HR:0.72,90%CI:0.54~0.97)。MSS亚组的死亡比为0.66(90%CI:0.48~0.89)[38]。虽然这项研究达到了主要终点,但OS的改善并不明显。尽管这是迄今为止报道MSS结直肠癌阳性结果的最大宗研究,但MSS结直癌需要免疫检查点抑制剂联合治疗以获得疗效的结论尚未被广泛接受。双免疫检查点抑制剂的组合仍然需要更多的探索。
临床前研究显示,抗EGFR治疗能引起肿瘤特异性免疫反应和免疫原性细胞凋亡[39]。抗EGFR治疗也会不可避免地发生耐药,且耐药与CTLA-4和PD-L1高表达相关。LCCC1632研究(NCT03442569)是一项多中心、单臂二期临床研究,旨在评估帕尼单抗+伊匹木单抗+纳武利尤单抗治疗KRAS、NRAS、BRAF野生型和MSS转移性结直肠癌患者的疗效和安全性;研究共纳入56例患者,在49例可评估患者中,12周缓解率为35%,中位PFS为5.7个月[40]。LCCC1632研究结果表明,免疫+抗EGFR治疗MSS转移性结直肠癌患者值得进一步探索。
免疫联合放疗的治疗机制是放疗可通过释放肿瘤抗原、诱导Ⅰ型干扰素、改变免疫抑制的肿瘤微环境来促进免疫,从而在非放疗病灶中产生远隔效应[41]。VOLTAGE研究显示,局部进展期直肠癌患者术前放化疗后续贯5周期纳武利尤单抗后再行手术切除,30%(11/37)的MSS患者达到pCR,60%(3/5)的MSI-H患者达到pCR[42]。
许多临床试验将免疫治疗纳入直肠癌新辅助方案,在放化疗期间或之后添加单一药物或联合药物。包括如下研究:(1)澳大利亚二期研究AveRec(NCT03299660);(2)AVANA(NCT03854799)二期研究[43];(3)INNATE(NCT04130854)研究;(4)TARZAN(NCT04017455)研究;(5)CHINOREC(NCT04124601)研究;(6)PANDORA研究(NCT0408 3365)。
综上可以看出,对于MSS或pMMR结直肠癌,临床研究的重点均在免疫检查点抑制剂的联合用药方面,免疫联合化疗似乎有一定疗效,免疫联合MEK抑制剂并未带来获益,免疫联合TKI的疗效差异较大仍需更多数据支持,其他的免疫联合治疗方案仍在探索中。
结直肠癌免疫治疗的时代已经到来,KEYNOTE-177三期临床试验已经确立了免疫治疗对于MSI-H或dMMR患者一线治疗的地位。免疫治疗对于MSI-H或dMMR患者的适用范围也在逐渐地扩大,从后线到二线、一线,再到辅助和新辅助的研究,不断推进。但免疫治疗单药对于MSI-H人群的有效率有待提高,寻找新的标记物如肿瘤突变负荷(tumor mutational burden,TMB)、CpG岛甲基化等将有助于筛选出更精准的获益人群;同时为进一步提高疗效,双免疫检查点抑制剂联合治疗,免疫联合化疗、靶向、抗血管以及局部治疗等方式的组合探索,将有可能发现更优的免疫治疗策略。
绝大多数MSS人群的免疫治疗疗效远不如MSI-H患者,部分MSS患者可能从免疫联合治疗中获益。如何寻找在MSS群体中的潜在获益人群,是目前亟需解决的问题,当然也包括单免疫与双免疫联合的优劣,以及是否联合化疗或靶向药物。免疫治疗的重点仍然是了解耐药机制和优化策略,以提高这些"冷"肿瘤的免疫反应性。除了dMMR和TMB之外,还需要进一步找到合适的生物标志物,从而实现个体化抗肿瘤治疗,降低潜在的毒性,使患者获益更多。新的治疗手段包括肿瘤疫苗、CAR-T等也在积极向临床推进,相信未来,免疫治疗会更加深远地影响我们的治疗理念,为临床带来更积极的获益。
所有作者均声明不存在利益冲突



























