
通过总结分析国内多中心、真实世界的大样本数据,为联合免疫治疗的新辅助治疗对结直肠癌患者的临床应用提供借鉴和依据。
本研究为回顾性、多中心、病例系列研究。回顾性收集2017年1月至2021年10月期间,北京大学肿瘤医院(55例)、华中科技大学同济医学院附属协和医院(19例)、中山大学肿瘤防治中心(13例)和海军军医大学附属长海医院(7例)共计94例患者联合新辅助免疫治疗的结直肠癌患者资料,其中男性48例,女性46例;中位年龄58岁。直肠癌81例,结肠癌13例(2例为结肠双原发癌);肿瘤TNM分期:Ⅱ期12例,Ⅲ期82例;肿瘤高分化46例,中分化37例,低分化11例。26例(27.7%)为错配修复缺陷(dMMR)和微卫星高度不稳定(MSI-H),行单纯免疫治疗,主要为程序性死亡蛋白-1(PD-1);68例(72.3%)为错配修复正常(pMMR)和微卫星稳定(MSS),行免疫联合新辅助治疗,主要为CapeOx(卡培他滨+奥沙利铂)联合PD-1+长程或短程放疗,或PD-1联合细胞毒T淋巴细胞相关抗原4(CTLA-4)。按美国国立癌症研究所通用毒性标准3.0版分析评价新辅助联合免疫治疗期间的不良反应;了解手术情况并按照Clavien-Dindo分级标准评价手术并发症;联合新辅助免疫治疗的疗效评估包括以下指标:主要病理学缓解(MPR),定义为新辅助治疗诱导的肿瘤消退在病理上残留肿瘤≤10%;病理完全缓解(pCR)定义为新辅助治疗诱导的肿瘤消退患者在病理上未见残留肿瘤;肿瘤评效为疾病控制率(DCR),即完全缓解(CR)、部分缓解(PR)和疾病稳定(SD)患者在全组中所占的比例;客观缓解率(ORR),为CR+PR。
全组94例患者接受新辅助联合免疫治疗的中位周期数为4(1~10)个,免疫相关不良反应发生率为37.2%(35/94),包括皮肤相关不良反应35例(37.2%)、甲状腺功能异常21例(22.3%)和免疫性肠炎8例(8.5%),其中Ⅲ级不良反应占1.1%。末次新辅助联合免疫治疗至手术的中位时间为30(21~55) d,直肠癌根治术81例,结肠癌根治术11例,结肠癌联合其他脏器切除2例;全部患者原发灶切除均达到R0。手术相关并发症发生率为22.3%(21/94),主要为吻合口漏(4例)、盆腔感染(4例)、腹腔积液(3例)、吻合口狭窄(3例)和腹盆腔出血(2例);Ⅰ~Ⅱ级并发症13例(13.8%),Ⅲ级并发症8例(8.5%),无Ⅳ级及以上并发症。全组患者中位随访32(1~46)个月,DCR为98.9%(93/94),ORR为88.3%(83/94),pCR率41.5%(39/94),MPR率60.6%(57/94)。行单纯免疫治疗的26例dMMR和MSI-H患者pCR率为57.7%(15/26),MPR率为65.4%(17/26)。行联合免疫治疗的68例pMMR和MSS患者pCR率为35.3%(24/68),MPR率为58.8%(40/68)。
对于初始可切除的结直肠癌患者,新辅助联合免疫治疗具有很好的肿瘤控制率和病理缓解率;围手术期不良反应及手术并发症发生率可以接受。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)在多种肿瘤中的研究正如火如荼地开展,并显示了良好的治疗效果[1,2]。KEYNOTE-177等研究显示,免疫治疗可显著改善错配修复缺陷(mismatch repair deficient,dMMR)或微卫星高度不稳定(microsatellite instability high,MSI-H)转移性结直肠癌患者的预后[3]。ICI因此而被推荐为dMMR或MSI-H晚期肠癌的一线选择[4]。同期的NICHE研究提示,ICI在初始可切除结直肠癌新辅助治疗中显示了良好的效果,即便对错配修复正常(mismatch repair proficient,pMMR)或微卫星稳定(microsatellite stability,MSS)的结直肠癌患者,仍然有效[5]。提示,ICI药物在局部进展期和早期结直肠癌的综合治疗决策中有很大的应用空间。
对不同MMR或MSI状态的结直肠癌可采用不同的治疗策略。因此,对错配修复(mismatch repair,MMR)或微卫星状态进行常规检测被现有指南所推荐[6,7,8,9]。dMMR或MSI-H型结直肠癌占全部结直肠癌的10%~15%,以结肠居多,直肠癌仅占5%,治疗可采用单纯ICI治疗[10]。对pMMR或MSS结直肠癌,尤其是直肠癌,多采用传统的治疗策略[11]。新辅助放化疗联合全直肠系膜切除术(total mesorectal excision,TME)及辅助化疗是局部进展期中低位直肠癌的经典治疗模式。在这种治疗模式下,直肠癌的局部复发率可控制在5%以下,5年总体生存率为65%~75%[12]。控制直肠癌的远处转移、提高生存率及生活质量,是更为重要的治疗目标。近年来,将辅助化疗前置的全程新辅助治疗、在放化疗基础上增加ICI治疗均成为研究的热点[11,13]。
有关免疫治疗的药物不良反应数据,多来自转移性肿瘤的临床研究,其不良反应与使用的药物类型或剂量有关[14,15]。CTLA-4抑制剂如伊匹木单抗最常见的不良反应包括皮疹、肠炎和甲状腺功能减退等,发生率高达60%,3度及以上不良反应发生率可达10%~27%[14]。针对dMMR或MSI-H结直肠癌新辅助ICI治疗的NICHE研究中,13%出现Ⅲ~Ⅳ级的不良反应,包括皮疹、肠炎和无症状的实验室检查异常[5]。
对于可切除结直肠癌,新辅助治疗后的手术操作及术后并发症的影响是临床关注的问题。在NICHE研究中,40例早期结肠癌接受新辅助ICI治疗,20%在术后出现3级及以上外科并发症,其中吻合口漏发生率高达10%,其他还有5例腹腔或切口感染、1例肠梗阻、1例肺炎和1例小肠损伤[5]。传统新辅助放化疗除带来放化疗相关不良反应外,也会造成组织水肿、纤维化、吻合口并发症增加等问题。对于直肠癌,尤其是pMMR或MSS直肠癌,ICI治疗需联合放疗和化疗等方法。笔者曾报道24例长程放疗联合化疗及ICI治疗的结果,术后并发症发生率为25.0%(5/20),包括2例Clavien-DindoⅡ级(吻合口出血和伪膜性肠炎各1例),Ⅰ级吻合口狭窄3例[16]。
免疫治疗在结直肠癌新辅助治疗中的应用有赖于治疗的安全性及疗效。从目前国内外数据资料看,多为单中心、小样本的二期研究[5,16,17,18,19]。基于此,笔者联合国内开展新辅助免疫治疗较早的4家中心,进行回顾性、多中心、病例系列研究,以期提供较大样本的安全性及疗效的数据。
本研究为回顾性、多中心、病例系列研究。经北京大学肿瘤医院伦理委员会审核批准通过(伦理批号:2021YJZ56)。
共收集2017年1月至2021年10月期间,北京大学肿瘤医院、华中科技大学同济医学院附属协和医院、中山大学肿瘤防治中心和海军军医大学附属长海医院共计176例患者的临床资料。其中62例因术前治疗方案中无免疫药物或资料不全被剔除;有20例经术前新辅助免疫治疗后达到临床完全缓解,未行手术治疗而进行等待观察(本组病例另行文分析);最终纳入94例接受手术治疗、并行手术并发症和疗效分析的患者资料入组。其中男性48例,女性46例;中位年龄58岁。美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)[21]评分均≤1分。原发肿瘤部位:直肠81例,结肠13例(升结肠9例,乙状结肠2例,降结肠和横结肠各1例),其中2例为双原发(均为结肠双原发)。临床T分期:cT3期76例,cT4期18例;临床N分期:N0期12例,N+期82例;肿瘤TNM分期:Ⅱ期12例,Ⅲ期82例。肿瘤高分化46例,中分化37例,低分化11例。26例(27.7%)为dMMR或MSI-H,68例(72.3%)为pMMR或MSS。
4家中心患者的基本情况和新辅助免疫治疗方案见表1。

4家中心94例结直肠癌患者的肿瘤基线特征和新辅助联合免疫治疗模式
4家中心94例结直肠癌患者的肿瘤基线特征和新辅助联合免疫治疗模式
| 中心名称(研究注册号或伦理号) | 例数 | 肿瘤基线特征 | 错配修复功能及其联合免疫新辅助治疗方案 | |
|---|---|---|---|---|
| 直肠癌 | 结肠癌 | |||
| 北京大学肿瘤医院(NCT04340401) | 55 | 均为Ⅲ期肿瘤其中54例为高危局部进展期直肠癌(T3c、T3d或T4,EMVI+,MRF+):12例为dMMR和MSI-H,其余42例为pMMR和MSS1例为局部进展期结肠癌,dMMR | 42例pMMR和MSS者采用CapeOx联合PD-1×2,长程放疗±CapeOx×2 ,dMMR或MSI-H者采用PD-1×2 ±长程放疗;联合免疫治疗另12例单纯免疫治疗 | PD-1单药 |
| 华中科技大学同济医学院附属协和医院(NCT04231552) | 19 | 均为pMMR或MSS局部进展期直肠癌;其中5例为Ⅱ期,14例为Ⅲ期 | 短程放疗+CapeOx×2,同步PD-1×2 | - |
| 中山大学肿瘤防治中心(B2020-064-01) | 13 | 均为Ⅲ期肿瘤结肠癌12例,均为T4b和(或)N+及均为dMMR或MSI-H直肠癌(局部进展期)1例,为dMMR和MSI-H | PD-1联合长程放疗 | 11例PD-1单药;1例PD-1联合CTLA-4 |
| 海军军医大学附属长海医院(ChiCTR2100042785) | 7 | 均为Ⅱ期直肠癌(T3N0);均为pMMR或MSS | 长程放疗±CapeOx或PD-1×2±CapeOx ×2 | - |
注:pMMR:错配修复正常;dMMR:错配修复缺陷;MSS:微卫星稳定;MSI-H:微卫星高度不稳定;CapeOx方案:卡培他滨+奥沙利铂;PD-1:程序性细胞死亡蛋白-1;CTLA-4:细胞毒T淋巴细胞相关抗原4;EMVI:壁外血管侵犯;MRF:直肠系膜筋膜;"-"示无数据
纳入标准:(1)年龄18~75岁;(2)病理学确诊结直肠腺癌,无远隔转移证据,初次评估为可切除结直肠癌;(3)接受新辅助ICI治疗,治疗方案可单独使用ICI(厂家不限,使用剂量按照主诊医师意见)或联合其他治疗包括化疗、放疗、靶向治疗等,联合使用的顺序、剂量、时限均依据实际使用情况;(4)体力状况ECOG评分[20]0~1分;(5)既往无盆腔放疗病史,无免疫治疗或化疗病史;(6)不伴有需抗生素治疗的全身性感染;(7)不伴有免疫系统疾病。
排除标准:(1)过去5年内罹患过其他恶性肿瘤者;(2)过去6个月内发生过动脉栓塞性疾病,如心绞痛、心肌梗死、短暂缺血性发作等;(3)接受过其他类型的抗肿瘤或试验性治疗;(4)孕期或哺乳期女性;(5)合并有其他疾病或精神状态异常,可能影响到患者治疗;(6)既往接受过ICI治疗、抗血管生成药物或小分子酪氨酸激酶抑制剂等治疗的患者。
由研究发起方负责数据库构建,将统一制作的含有录入数据条目的表格分别发放至各分中心负责人进行填写。包括完整的病历记录和体格检查、血清癌胚抗原(carcinoembryonic antigen,CEA)和糖类蛋白19-9检测结果、肠镜病理活检、胸部CT、腹盆腔增强CT和(或)直肠高分辨MRI;MMR基因状态包括依据免疫组织化学法检测MLH1、MSH2、MSH6和PSM2蛋白表达状态,如任何一个蛋白表达缺失,即为dMMR,否则为pMMR;MSI检测结果需标注为MSI-H或MSS;新辅助治疗后进行评估的结果以及后续接受手术切除或其他治疗的情况也予以记录。入组数据的清洗与核对由北京大学肿瘤医院完成。
系指从新辅助治疗开始到随访结束期间发生的与新辅助治疗手段(如放疗、化疗、靶向治疗、ICI治疗等)相关的不良反应。治疗期间的相关不良事件评价按美国国立癌症研究所通用毒性标准3.0版[21];其中免疫相关不良反应按照文献标准评价[22]。
新辅助治疗结束到手术的时间定义为从给药-放疗结束至外科手术的时间。围手术期并发症系指手术日至术后30日发生的与手术直接或间接相关的并发症。手术并发症的分级按照Clavien-Dindo分级评价标准[23]。
按照美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)肿瘤退缩分级(tumor regression grade,TRG)进行[24]。主要病理学缓解(major pathological response,MPR)定义为新辅助治疗诱导的肿瘤消退在病理上残留肿瘤≤10%,病理完全缓解(pathological complete reponse,pCR)定义为新辅助治疗诱导的肿瘤消退在病理上未见残留肿瘤[24]。
肿瘤评效为完全缓解(complete response,CR)、部分缓解(partial response,PR)和疾病稳定(stable disease,SD)在全部患者中所占的比例。
肿瘤体积缩小达到预先规定值并能维持最低时限要求的患者比例,为CR和PR比例之和,即ORR=CR+PR。
术后2年内每3个月进行1次随访,之后每半年进行1次。通过患者的住院病历系统、门诊就诊记录及电话随访,获取围术期并发症、术后病理资料及生存资料。末次随访时间为2021年11月30日。
采用SPSS 19.0统计学软件进行统计分析,计量资料用M(范围)表示。分类变量采用频数和百分比表示,分类变量比较采用χ2检验或Fisher精确概率法。以P<0.05表示差异有统计学意义。
入组的94例患者接受新辅助联合免疫治疗的中位周期数为4(1~10)个。免疫相关不良反应发生率为37.2%(35/94),治疗相关不良反应发生情况见表2。
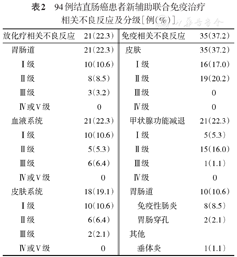
94例结直肠癌患者新辅助联合免疫治疗相关不良反应及分级[例(%)]
94例结直肠癌患者新辅助联合免疫治疗相关不良反应及分级[例(%)]
| 放化疗相关不良反应 | 21(22.3) | 免疫相关不良反应 | 35(37.2) | ||
|---|---|---|---|---|---|
| 胃肠道 | 21(22.3) | 皮肤 | 35(37.2) | ||
| Ⅰ级 | 10(10.6) | Ⅰ级 | 16(17.0) | ||
| Ⅱ级 | 8(8.5) | Ⅱ级 | 19(20.2) | ||
| Ⅲ级 | 3(3.2) | Ⅲ级 | 0 | ||
| Ⅳ或V级 | 0 | Ⅳ级 | 0 | ||
| 血液系统 | 21(22.3) | 甲状腺功能减退 | 21(22.3) | ||
| Ⅰ级 | 10(10.6) | Ⅰ级 | 5(5.3) | ||
| Ⅱ级 | 5(5.3) | Ⅱ级 | 15(16.0) | ||
| Ⅲ级 | 6(6.4) | Ⅲ级 | 1(1.1) | ||
| Ⅳ或V级 | 0 | Ⅳ级 | 0 | ||
| 皮肤系统 | 18(19.1) | 胃肠道 | 10(10.6) | ||
| Ⅰ级 | 10(10.6) | 免疫性肠炎 | 8(8.5) | ||
| Ⅱ级 | 6(6.4) | 胃肠穿孔 | 2(2.1) | ||
| Ⅲ级 | 2(2.1) | 其他 | |||
| Ⅳ或V级 | 0 | 垂体炎 | 1(1.1) | ||
94例患者末次新辅助联合免疫治疗至手术的中位时间为30(21~55) d。直肠癌根治术81例(低位前切除、腹会阴联合切除或Hartmann术),结肠癌根治术11例(乙状结肠切除、左半结肠切除或右半结肠切除),结肠癌联合其他脏器切除2例。全部患者原发灶切除均达到R0。中位手术时间130(90~240) min;中位出血量50(30~200) ml,术后中位住院时间为9(6~30) d。手术相关并发症发生率为22.3%(21/94),主要为吻合口漏、腹盆腔出血、腹腔积液、吻合口狭窄和吻合口出血,见图1。Ⅰ~Ⅱ级并发症13例(13.8%),Ⅲ级并发症8例(8.5%),其中Ⅲa级并发症5例(5.3%),Ⅲb级并发症3例(3.2%),无Ⅳ级及以上并发症。并发症发生情况见图1和表3。
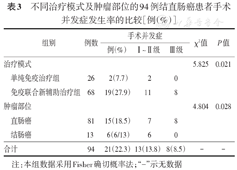
不同治疗模式及肿瘤部位的94例结直肠癌患者手术并发症发生率的比较[例(%)]
不同治疗模式及肿瘤部位的94例结直肠癌患者手术并发症发生率的比较[例(%)]
| 组别 | 例数 | 手术并发症 | χ2值 | P值 | |||
|---|---|---|---|---|---|---|---|
| 例(%) | Ⅰ~Ⅱ级 | Ⅲ级 | |||||
| 治疗模式 | 5.825 | 0.021 | |||||
| 单纯免疫治疗组 | 26 | 2(7.7) | 2 | 0 | |||
| 免疫联合新辅助治疗组 | 68 | 19(27.9) | 11 | 8 | |||
| 肿瘤部位 | 4.804 | 0.028 | |||||
| 直肠癌 | 81 | 15(18.5) | 7 | 8 | |||
| 结肠癌 | 13 | 6(6/13) | 6 | 0 | |||
| 合计 | 94 | 21(22.3) | 13(13.8) | 8(8.5) | - | - | |
注:本组数据采用Fisher确切概率法;"-"示无数据

免疫联合新辅助治疗组手术并发症发生率高于单纯免疫治疗组,差异有统计学意义(P<0.05)。结肠癌组手术并发症发生率高于直肠癌组,差异有统计学意义(P<0.05)。但是结肠癌手术组均为Ⅰ~Ⅱ级并发症。见表3。
本组患者中位随访32(1~46)个月。1例患者出现疾病进展。该患者基线胸部CT显示肺部小结节,初始经多学科讨论不考虑肺转移,按照计划完成治疗后,再次评估考虑为肺转移,后行原发灶切除。全组DCR率为98.9%(93/94)。根据RECIST 1.1评估标准,治疗后ORR为88.3%(83/94),pCR率达到41.5%(39/94),MPR者占60.6%(57/94)。
单纯免疫治疗的26例dMMR和MSI-H患者pCR为57.7%(15/26),MPR为65.4%(17/26)。行联合免疫治疗的68例pMMR和MSS患者pCR率为35.3%(24/68),MPR率为58.8%(40/68)。不同中心治疗模式不同,pCR比例也在14.3%到61.5%不等。见表4。
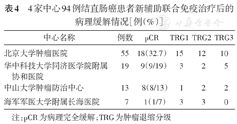
4家中心94例结直肠癌患者新辅助联合免疫治疗后的病理缓解情况[例(%)]
4家中心94例结直肠癌患者新辅助联合免疫治疗后的病理缓解情况[例(%)]
| 中心名称 | 例数 | pCR | TRG1 | TRG2 | TRG3 |
|---|---|---|---|---|---|
| 北京大学肿瘤医院 | 55 | 18(32.7) | 15 | 12 | 10 |
| 华中科技大学同济医学院附属协和医院 | 19 | 9(9/19) | 3 | 2 | 5 |
| 中山大学肿瘤防治中心 | 13 | 8(8/13) | 1 | 2 | 2 |
| 海军军医大学附属长海医院 | 7 | 1(1/7) | 3 | 3 | 0 |
注:pCR为病理完全缓解;TRG为肿瘤退缩分级
本项研究是目前国内外开展并不多见的多中心、较大样本的有关结直肠癌新辅助免疫治疗的真实世界研究。研究发现,无论单独使用ICI,还是联合放化疗,结直肠癌新辅助ICI治疗均具有可接受的药物不良反应和手术并发症,同时可获得理想的肿瘤退缩。
本研究纳入了国内4家中心的数据,涵盖可切除的结肠癌和直肠癌,治疗模式因原发肿瘤部位、诊治中心及MMR和MSI状态等存在较多不同,包括ICI治疗的种类(PD-1抑制剂单药、PD1抑制剂联合CTLA-4抑制剂)及疗程、放疗的类型(长程或短程)、化疗的使用时机(诱导或巩固)等。从纳入的94例患者的药物不良反应看,1例出现3度甲状腺功能减低,8例免疫性肠炎,2例胃肠穿孔;未出现治疗相关性死亡和严重不良反应。文献报道,ICI治疗相关Ⅲ~Ⅳ级不良反应可能在治疗开始后5.6~28.6周出现,最迟达57周[25]。本研究随访截至2021年11月30日,中位随访时间32个月,理论上可避免对Ⅲ~Ⅳ级不良反应的低估。全组免疫相关不良反应发生率37.2%,Ⅰ~Ⅱ级不良反应主要为骨髓抑制、胃肠道反应和皮肤不良反应,Ⅲ级及以上免疫相关不良反应发生率1.1%。在针对dMMR和MSI-H转移性结直肠癌的KEYNOTE-177研究中,帕博利珠单抗组有31%发生免疫及输注相关的不良反应,9%为Ⅲ或Ⅳ级以上,最为常见的是结肠炎和肝炎[3]。本研究相对KEYNOTE-177研究,免疫治疗周期数更少,而且KEYNOTE-177研究中纳入的患者人群均为晚期肠癌,ECOG评分更高。由此可见,结直肠癌新辅助ICI治疗是安全的。
既往研究发现,ICI治疗后肠壁胃肠道组织学改变包括固有层增厚、绒毛短缩、上皮层中性粒细胞浸润和隐窝腺体凋亡,上皮层内罕有淋巴细胞[26]。文献报道,50%存在炎性细胞浸润,1/3有隐窝炎性改变伴或不伴隐窝脓肿,表现为局灶性急性结肠损伤、片状隐窝脓肿形成到弥漫性结肠炎性病变不等[27]。NICHE研究中,40例结肠切除术后有20%出现Ⅲ级外科并发症,吻合口漏发生率高达10%,其他包括5例腹腔(或切口)感染、1例肠梗阻、1例肺炎和1例小肠损伤;其吻合口漏的高发生率可能与PD-1及CTLA-4的联合使用有关[5]。本研究中,结肠癌术后吻合口漏发生率并未显著增高,联合ICI新辅助治疗结直肠癌患者的围手术期并发症发生率为22.3%(21/94),Ⅲb级及以上并发症发生率为3.2%(3/94),无围术期死亡病例。即使不同中心免疫治疗及术前放化疗治疗强度及模式不一致,各中心的围手术期并发症指标仍在可接受范围。可以认为,免疫治疗的提前介入,并没有给手术增加额外的风险。需要注意的是,ICI治疗在结直肠癌新辅助治疗中应用较少,本组纳入病例多为探索性的研究性病例,故伴随疾病较少,体力状况较好,耐受性可能较好。
此外,需要关注本研究中结直肠癌的治疗模式存在一定的差别。总体看,可能与原发肿瘤部位、MMR和MSI状态以及各中心既往临床经验有关。既往研究表明,单纯免疫治疗对pMMR和MSS结直肠癌效果不佳[28,29]。本研究中,多数中心对dMMR和MSI-H结肠癌和直肠癌均采用单药治疗,联合CTLA-4抑制剂的病例来自中山大学肿瘤防治中心,但仅有1例。早期文献报道,联合PD1和CTLA-4抑制剂治疗的不良反应发生率可高达95%,55%为Ⅱ级及以上不良反应[27]。从本组患者药物治疗不良反应看,未出现严重不良反应,可能与病例数较少、进行了病情监测及不良反应处理有关。
Roxburgh等[30]报道了2009—2015年间607例接受新辅助治疗的直肠癌病例,依据放疗结束到手术间隔时间,将其分为<8周、8~12周和12~16周3组,多因素分析未发现手术间隔期是手术并发症的独立因素,但12~16周组并发症发生率显著高于前两组(56%比44%比37%)。本研究中,治疗方案多为放疗后联合2~4周期的化疗联合免疫治疗,而末次治疗到手术的中位间隔时间为30(21~55)d,手术并发症发生率为22.3%(21/94),Ⅲb级以上占3.2%。RAPIDO研究采用的方案是短程放疗后联合6周期CapeOx或9周期FOLFOX方案化疗,手术间隔为20周以上,Ⅲ级以上手术并发症发生率为8.8%,吻合口漏发生率5.7%[31]。本研究并发症数据与RAPIDO研究相似,提示全程新辅助基础上增加免疫治疗并未增加手术并发症的发生率。
此外,联合放疗和免疫治疗提高肿瘤退缩也是研究的热点。术前诱导的系统性免疫反应可使机体产生长期免疫记忆,而术后患者因肿瘤的切除无法产生免疫介导的持续的抗肿瘤效应。因此,新辅助免疫治疗有一定合理性。近年,有几项小样本的研究均提示其临床应用前景。VOLTAGE-A研究是首个探索放化疗序贯免疫治疗在MSS直肠癌新辅助治疗中价值的研究[32]。队列A1中,37例MSS患者有11例(30%)达到了pCR,另有3例达到TRG 1级,1例达到临床完全缓解进行等待观察。Lin等[33]报道,接受手术的26例pMMR患者中,有12例(46%)达到pCR。AVANA研究是一项多中心二期研究,探索术前放化疗联合阿维鲁单抗治疗,在美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)2021年会议报告的96例可评估病理反应的患者中,22例(22.9%)达到了pCR,59例(61.5%)达到了MPR[34]。本研究中,pMMR和MSS结直肠癌患者通过联合免疫的新辅助治疗后,pCR率高达32.4%,MPR率达58.8%。如何进一步提高联合免疫治疗后的病理缓解率,依然是未来研究的热点和难点。
综上所述,本研究为多中心回顾性研究,虽然各中心在治疗模式上存在异质性,但是,初步结果显示,联合免疫治疗的新辅助治疗模式对于可手术的结直肠癌患者近期疗效显著,具有较好的安全性和有效性。联合免疫治疗的新辅助治疗模式对可手术结直肠癌的远期疗效、最佳周期数及预测免疫疗效的标记物,仍需进一步的研究证实。
所有作者均声明不存在利益冲突



























