
探讨肠道菌群移植(FMT)治疗孤独症谱系障碍(ASD)的有效性和安全性。
采用纵向观察性研究方法,回顾性收集2012年5月至2021年5月在同济大学附属第十人民医院和东部战区总医院接受FMT治疗的合并有胃肠道症状的ASD患者资料。统计和分析患者在接受治疗前及首次治疗后第1、3、6、12、24、36、48和60个月的孤独症行为量表(ABC)、儿童孤独症评定量表(CARS)、Bristol粪便性状量表(BSFS)和胃肠症状等级量表(GSRS)等量表信息,以及不良反应发生情况。治疗前后各时间点量表数据的比较采用广义估计方程分析。
共纳入328例患者,年龄为(6.1±3.4)岁;其中男271例,女57例。首次治疗后第1、3、6、12、24、36、48和60个月的治疗后随访人数分别为303例(92.4%)、284例(86.7%)、213例(64.9%)、190例(57.9%)、143例(43.6%)、79例(24.1%)、46例(14.0%)和31例(9.5%)。经FMT治疗后,全组ABC评分在36个月内均有显著改善,48个月内仍有改善,但60个月时与初期接近(1、3、6、12、24、36个月,均P<0.001;48个月,P=0.008;60个月,P=0.108)。与治疗前比较,CARS在48个月内均明显改善,60个月内仍有改善(1、3、6、12、24、36、48个月,均P<0.001;60个月,P=0.010)。与治疗前比较,BSFS在36个月内均有明显改善,粪便形态接近4型,48个月内仍能维持,60个月之后与初期相似(1、3、6、12、24、36个月,均P<0.001;48个月,P=0.008;60个月,P=0.109)。与治疗前比较,GSRS在24个月内有明显改善,但之后无明显好转(1、3、6、12、24个月,均P<0.001;36个月,P=0.209;48个月,P=0.996;60个月,P=0.668)。328例患者在治疗期间出现的不良事件有:腹胀21例(6.4%)、恶心14例(4.3%)、呕吐9例(2.7%)、腹痛15例(4.6%)、腹泻18例(5.5%)、发热13例(4.0%)和兴奋24例(7.3%)。这些不良反应均为轻中度,经暂停FMT或对症治疗后即好转,无一例严重不良反应发生。
FMT对合并有胃肠道症状的ASD具有较满意的长期疗效和安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
孤独症谱系障碍(autism spectrum disorder,ASD)目前愈发受到国内外重视,其患病率近年来在全世界显著增长,部分国家近两年甚至增加了23%,达到了1/44[1, 2]。这些患者受复杂的弥漫性中枢神经系统发育障碍影响,存在社交障碍、语言障碍、兴趣狭窄和行为方式刻板重复等问题[3]。约90%的患者同时合并有胃肠道症状,包括腹胀、腹痛、腹泻和便秘等,且这些症状与ASD严重程度相关[4]。动物及临床研究均证实,ASD与肠道菌群紊乱密切相关,且干预肠道菌群可能会影响ASD症状改变[5, 6, 7]。肠道菌群干预方法中最具代表性的就是菌群移植(fecal microbiota transplantation,FMT)。FMT是一种将健康人体粪便中的菌群移植到患者肠道内,来重建肠道菌群结构的治疗技术[8]。FMT被指南推荐治疗复发性艰难梭状芽胞杆菌感染等肠道相关疾病[9];并逐渐推广运用于难治性具有肠道症状的肠道外疾病,如ASD[10]、帕金森病[11]和肌萎缩侧索硬化症[12]等。FMT为这些疾病提供了潜在治疗价值,尤其是对ASD这类病因未明且缺乏特效治疗方式的疾病意义重大[13]。目前,国内外均已开展FMT治疗ASD的临床研究,FMT能纠正肠道菌群紊乱,改善ASD胃肠道和核心症状,甚至部分效果可维持长达2年以上[10,13, 14]。但受FMT资质及技术的限制,目前总体的临床研究样本量均较少。本中心自2014年开始运用FMT治疗ASD,在临床积累了一定治疗经验,并建立起长期随访机制[15]。本研究通过回顾性研究方法,系统性分析本中心FMT治疗ASD结果,评估相关安全性及长期疗效,为临床诊疗提供参考。
采用纵向观察性研究的方法,回顾性收集2014年5月至2021年5月间同济大学附属第十人民医院的328例接受FMT治疗的合并有胃肠道症状的ASD患者资料。本研究共纳入328例ASD患者,年龄为(6.1±3.4)岁;其中男271例,年龄为(6.3±3.5)岁;女57例,年龄为(5.1±2.7)岁。本研究经单位伦理委员会审批(审批号:SHSY-IEC-4.1/20-116/01)。
纳入标准:(1)符合美国精神病学会《精神障碍诊断和统计手册》第五版(DSM-5)关于ASD的诊断标准[3];(2)伴有便秘症状,症状出现至少6个月,且就诊前3个月内有以上症状发作;(3)患者和(或)监护人签署知情同意书。
排除标准:(1)既往有脑外伤、脑瘫、脑炎等脑部器质性疾病史;(2)既往有其他精神疾病史;(3)既往存在肠道器质性病变如先天性巨结肠、肠梗阻和肠套叠等;(4)既往存在病理性肠道炎性改变,如炎性肠病等;(5)重度肥胖或重度营养不良病史;(6)就诊前3个月内或在治疗期间6个月内有使用益生菌和抗生素等明确影响肠道菌群的药物;(7)就诊前12个月内曾接受过FMT治疗;(8)不能口服FMT小儿胶囊(fecal microbiota-filled capsule,cFM)。
1.供体筛选标准、菌液制备标准操作流程:参照《菌群移植标准化方法学的建立与临床应用专家共识》[16]。
2.cFM制备标准操作流程:参照《菌群移植治疗肠道疾病406例疗效分析》[17],胶囊规格采用儿童3号胶囊。
3.FMT治疗:ASD患者治疗前不进行肠道准备。疗法:口服cFM 2粒/次,2次/d,每月连用12 d为一疗程。
1.ASD核心症状量表:孤独症行为量表(autism behavior checklist,ABC)[18]及儿童孤独症评定量表(childhood autism rating scale,CARS)[19]变化情况。ABC通过评估感觉、交往、躯体和物体使用、语言以及社会生活自理等5个方面,共57项ASD患者行为特征,来筛查和诊断ASD。总分158分;筛查界限分为53分,诊断分为67分。CARS可通过15个项目帮助诊断ASD和评估整体严重程度。总分<30分时不考虑为ASD;总分≥36分并且有5项以上≥3分时为重度ASD;介于中间者为轻至中度ASD。
2.胃肠症状量表:Bristol粪便性状量表(bristol stool form scale,BSFS)[20]、胃肠症状等级量表(gastrointestinal symptom rating scale,GSRS)[21]变化情况。BSFS通过简单评估肉眼观察下的粪便性状,可反映便秘或腹泻的情况;1~7型,分别代表粪便从干硬到水样的性状程度;越接近4型,表示粪便形态越健康。GSRS通过评估腹痛、反流、消化不良、腹泻和便秘等5个项目评估胃肠道症状。每个症状的严重程度采用Likert 4级评分法,0分表示无症状,3分表示非常严重。
随访并分别记录治疗前及首次治疗后1、3、6、12、24、36、48和60个月的各ABC、CARS、BSFS和GSRS量表。采用电话、门诊及网络等方式进行随访。
使用SPSS 22.0软件进行统计学分析。符合正态分布的计量数据用x±s表示,治疗前后各时间点比较采用广义估计方程分析。计数资料用例(%)表示。P<0.05表示差异有统计学意义。
治疗后1个月随访303例(92.4%)、3个月284例(86.7%)、6个月213例(64.9%)、12个月190例(57.9%)、24个月143例(43.6%)、36个月79例(24.1%)、48个月46例(14.0%)、60个月31例(9.5%)。
经FMT治疗后,ASD患者的ABC量表评分在36个月内均有显著改善,48个月内仍有改善,但60个月时与初期接近(P<0.001;其中1、3、6、12、24、36个月,均P<0.001;48个月,P=0.008;60个月,P=0.108)。CARS在48个月内均明显改善,60个月内仍有改善(P<0.001;其中1、3、6、12、24、36、48个月,均P<0.001;60个月,P=0.010)。BSFS在36个月内显著改善,粪便形态接近4型,48个月内仍能维持,60个月之后与初期相似(P<0.001;其中1、3、6、12、24、36个月,均P<0.001;48个月,P=0.008;60个月,P=0.109)。GSRS在24个月内有明显改善,但之后无明显好转(P<0.001,其中1、3、6、12、24个月,均P<0.001;36个月,P=0.209;48个月,P=0.996;60个月,P=0.668),见表1。
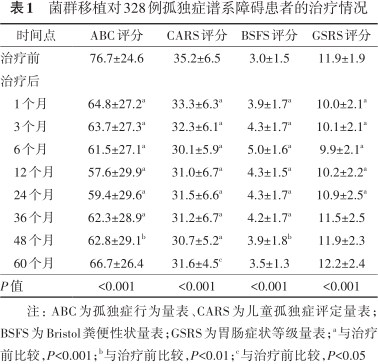
菌群移植对328例孤独症谱系障碍患者的治疗情况
菌群移植对328例孤独症谱系障碍患者的治疗情况
| 时间点 | ABC评分 | CARS评分 | BSFS评分 | GSRS评分 |
|---|---|---|---|---|
| 治疗前 | 76.7±24.6 | 35.2±6.5 | 3.0±1.5 | 11.9±1.9 |
| 治疗后 | ||||
| 1个月 | 64.8±27.2a | 33.3±6.3a | 3.9±1.7a | 10.0±2.1a |
| 3个月 | 63.7±27.3a | 32.3±6.1a | 4.3±1.7a | 10.1±2.1a |
| 6个月 | 61.5±27.1a | 30.1±5.9a | 5.0±1.6a | 9.9±2.1a |
| 12个月 | 57.6±29.9a | 31.0±6.7a | 4.3±1.5a | 10.2±2.2a |
| 24个月 | 59.4±29.6a | 31.5±6.6a | 4.3±1.7a | 10.9±2.5a |
| 36个月 | 62.3±28.9a | 31.2±6.7a | 4.2±1.7a | 11.5±2.5 |
| 48个月 | 62.8±29.1b | 30.7±5.2a | 3.9±1.8b | 11.9±2.3 |
| 60个月 | 66.7±26.4 | 31.6±4.5c | 3.5±1.3 | 12.2±2.4 |
| P值 | <0.001 | <0.001 | <0.001 | <0.001 |
注:ABC为孤独症行为量表、CARS为儿童孤独症评定量表;BSFS为Bristol粪便性状量表;GSRS为胃肠症状等级量表;a与治疗前比较,P<0.001;b与治疗前比较,P<0.01;c与治疗前比较,P<0.05
328例患者在FMT治疗期间及治疗后1周内出现消化道症状有:腹胀21例(6.4%)、恶心14例(4.3%)、呕吐9例(2.7%)、腹痛15例(4.6%)和腹泻18例(5.5%),以及非消化道症状:发热13例(4.0%)和兴奋24例(7.3%)。以上均为轻中度不良反应,经暂停FMT或对症治疗后即好转。无消化道穿孔、多重耐药菌感染、多脏器功能衰竭和死亡等严重不良反应发生。
目前,肠道菌群和FMT在ASD中的作用愈发得到重视。大量研究探讨肠道菌群与ASD的因果机制,虽然肠道菌群不一定是ASD的病因,但其与ASD的发生发展密切相关[5,22]。近期研究则认为,母体免疫激活机制等可能诱使肠道菌群产生机体免疫异常,并引起中枢神经系统炎性反应,从而影响ASD[23, 24]。因果关系虽尚有争议,但不可否认,ASD患者多伴有胃肠道症状,有严重肠道菌群紊乱,如梭菌属、普雷沃菌属、脱硫弧菌属等均有失衡[25]。FMT对ASD胃肠道症状本身就具有一定治疗价值,干预肠道菌群可能可改善患者胃肠道症状,ASD核心症状也有一定好转,这在近5年临床研究也取得相应进展[6,13, 14]。Kang等[6]于2017年报道了FMT对16例ASD儿童的治疗,结果显示,FMT具有一定的安全性、耐受性和有效性。Li等[13]近期报道了对40例ASD儿童开展为期12周FMT临床研究,同期观察对比16名正常儿童,结果也显示,FMT可同时改善胃肠道和ASD核心症状。但各项研究总体在样本量、治疗时间及随访时间上均有限。
本中心在前期已经积累大量临床经验,部分样本随访时间长达5年整,结果也显示:FMT可显著改善ASD,并持续较长时间。其中,对核心症状的改善,尤其是CARS量表的降低,可长期有效,这与文献报道的FMT治疗后CARS评分降低能延长2年以上相符[14]。胃肠道症状改善主要维持在3年左右,这可能与患者回归原生活环境有关,肠道菌群易受环境影响,可能需要患者长期或间断维持治疗[26]。考虑到ASD核心症状与胃肠道症状改善后维持时间不一,这可能与各症状受重视程度情况有关。多数患者长期接受以教育干预为主的治疗模式,这对改善核心症状可能有一定效果,但对胃肠道症状往往采取对症治疗为主的策略,收效欠佳[27]。对于同时合并有胃肠道症状的神经或精神类疾病,应当重视对胃肠道症状的治疗,以提高总体疗效。
此外,部分结果的差异还可能与本中心目前采取的治疗策略与文献报道的相关研究有所不同。考虑到ASD研究对象主要为儿童,与成人所不同,本中心暂未采用选择性肠道祛污和肠道准备序贯策略做治疗前预处理[6]。尽管口服万古霉素对部分ASD患儿有治疗作用[7],但肠道相对无菌化有可能会影响治疗肠道菌群定殖率[28],且儿童肠道菌群相对脆弱,低龄儿童肠道菌群结构还不成熟[26,29]。选择性祛污是否会造成抗生素滥用和增加耐药菌产生风险尚不明确,需要进一步研究明确其必要性[30]。本中心通过冻干粉技术,将菌液制成菌粉并灌装于耐酸型的羟丙甲纤维素胶囊中,制成cFM,方便患儿重复接受治疗,总体依从性较好[17]。本研究无一例严重不良事件发生,FMT治疗时所产生的均为轻中度不良事件,包括了如腹痛、腹胀、腹泻和兴奋等表现。这些表现可能与Jarisch-Herxheimer反应有关[31];部分原有的菌群经治疗后出现凋亡并裂解产生有毒物质,引起消化道甚至精神异常症状。也因为这些物质大部分可迅速排出体外,其所产生的症状持续时间短且多为自限性。
本研究通过5年328例病例的长期随访,显示出FMT对合并有胃肠道症状的ASD具有较满意的长期疗效及安全性,这也是目前已知的国内外样本量最大和随访时间最长的研究。FMT对ASD治疗具有重要的治疗价值,本中心目前已经开展相关全国多中心随机、对照、双盲研究,以期为临床工作提供更高质量的参考依据。
所有作者均声明不存在利益冲突



























