
近年来由于美国结直肠癌流行病学的变化,筛查循证医学证据的更新以及各种新兴筛查方式的出现,美国各相关行业协会,如:胃肠病学会、预防服务工作组等陆续对一般风险人群的结直肠癌筛查指南进行了更新。这些指南在结直肠癌筛查的起止年龄、筛查方式及筛查频率等方面的推荐等级不尽相同,全面了解这些指南更新的要点以及不同指南推荐的异同,对于我国结直肠癌筛查工作的开展有重要的参考价值和借鉴意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是我国发病率居第3位,死亡率居第5位的恶性肿瘤[1]。由于经济发展、生活方式改变及人口老龄化等原因,我国结直肠癌发病率以每年约4%的速度递增,超出全球年平均增长速度约2个百分点[2]。在美国,尽管结直肠癌仍为发病率、死亡率排名第3的恶性肿瘤[3]。然而得益于较早开展人群层面的结直肠癌筛查项目和危险因素控制,近年来美国的结直肠癌发病率和死亡率均呈持续下降趋势[4]。因此,推动结直肠癌筛查和早期诊断,是降低我国结直肠癌发病率和死亡率迫在眉睫的一环,也是减轻人群疾病负担的关键所在[5, 6]。
近年来,由于美国结直肠癌流行病学的变化,筛查循证医学证据的更新以及各种新兴筛查方式的出现,美国各相关行业协会陆续对一般风险人群的结直肠癌筛查指南进行了更新。全面了解这些指南更新的要点以及不同指南推荐的异同,对于我国结直肠癌筛查工作的开展有重要的参考价值和借鉴意义。本文着重阐述美国各行业协会对一般风险人群结直肠癌筛查的起止年龄、筛查方式与频率的指南建议的更新,并概述近年来各种筛查方式的循证医学证据。
本文将主要介绍以下5个美国行业协会针对一般风险人群结直肠癌筛查的最新指南建议,包括美国结直肠癌多学会工作组(U.S. Multi-Society Task Force,USMSTF)、美国放射学学会(American College of Radiology,ACR)、美国癌症协会(American Cancer Society,ACS)、美国胃肠病学会(American College of Gastroenterology,ACG)和美国预防服务工作组(US Preventive Services Task Force,USPSTF)。一般风险人群的定义在各指南中有细微不同,但总体一致,以最新更新的USPSTF指南为例,一般风险人群定义为“无结直肠癌病史、腺瘤性息肉病史、炎性肠病史;无提高结直肠癌罹患风险的已知疾病史或家族遗传疾病史(如林奇综合征或家族性腺瘤样息肉病)”。
2017年USMSTF指南[7]更新,建议非非洲裔美国人的一般风险人群从50岁开始筛查(强烈推荐,中等质量证据)。根据筛查方式性能、成本和接受度等,新版指南首次提出将不同结直肠癌筛查方式分为三线:一线包括结肠镜和粪便免疫化学测试(fecal immunochemical test,FIT);二线为CT结肠造影(CT colonography,CTC)、粪便DNA-FIT(stool DNA test with fecal immunochemical test,sDNA-FIT)和乙状结肠镜;三线为胶囊结肠镜(colon capsule,CC);不建议使用SEPT9甲基化来筛查结直肠癌。各线推荐和证据等级均有所差异,见表1。

美国各行业协会结直肠癌筛查指南更新时间及更新要点
美国各行业协会结直肠癌筛查指南更新时间及更新要点
| 协会 | 近两版指南更新年份 | 起止年龄新增推荐 | 筛查技术更新要点 |
|---|---|---|---|
| 美国结直肠癌多学会工作组 | 2008→2017 | 非裔美国人从45岁开始结直肠癌筛查(弱推荐,极低质量证据)a。 | 1.一线:每10年一次结肠镜检查或每年一次粪便免疫化学测试(强烈推荐,中等质量证据)a; 2.二线:每5年一次的CT结肠造影或每3年一次的粪便DNA-免疫化学测试(强烈推荐,低质量证据),或每5~10年一次的乙状结肠镜检查(强烈推荐,高质量证据)a; 3. 三线:每5年一次胶囊结肠镜检查(弱推荐,低质量证据)a; 4.不建议使用SEPT9来筛查结直肠癌(弱推荐,低质量证据)a。 |
| 美国放射学学会 | 2008→2018 | 无 | CT结肠造影适用于一般风险人群的结直肠癌筛查与息肉检测。 |
| 美国癌症协会 | 2008→2018 | 1、建议所有一般风险的成年人从45岁开始结直肠癌筛查(合格建议)b。 2、筛查停止时间:建议预期寿命超过10年的健康一般风险人群进行结直肠癌筛查,直至75岁(合格建议);建议76~85岁老年人根据偏好、预期寿命、健康状况和既往筛查史制定个体化的筛查策略(合格建议);不建议85岁以上人群继续筛查(合格建议)。 | 双重对比剂钡灌肠不再作为可接受的筛查方式。 |
| 美国胃肠病学会 | 2009→2021 | 建议45~49岁的一般风险人群进行结直肠癌筛查(条件性推荐,极低质量证据) c。 | 1.针对不能或不愿意进行结肠镜或粪便免疫化学测试检查的人群,新增推荐筛查方式:多靶点粪便DNA检测和胶囊结肠镜检查(条件性推荐,极低质量证据)c; 2.不建议SEPT9用于结直肠癌筛查(条件性推荐,极低质量证据)。 |
| 美国预防服务工作组 | 2016→2021 | 建议在45~49岁的成年人中筛查结直肠癌(B类建议)d。 | 无 |
a强烈推荐:被最知情患者选择的建议;弱推荐:在该推荐中,患者的价值观和偏好可能比证据质量发挥更大作用。b强烈建议:坚持干预的好处大于不良影响,大多数患者会选择干预;合格建议:有明确的获益(危害)证据,但获益和危害的平衡或患者的价值观和偏好的不确定性,可能导致不同的个人决定。c强烈推荐:明确显示干预措施利大于弊或弊大于利;条件性推荐:利弊不确定或无论质量高低的证据均显示利弊相当。dA类建议:推荐,高度肯定具有可观净收益;B类建议:推荐,高度肯定具有适度净效益或中度肯定具有适度到可观的净效益;C类建议:建议根据专业判断和患者偏好,有选择地向患者提供个性化建议,至少中度肯定具有很少的净收益;D类建议:建议不要使用,中度或高度肯定该策略没有净收益或危害大于收益
2018年ACR指南更新,根据受检人群的年龄、筛查史、是否有HNPCC或炎性息肉病史以及家族史等特征,将受检人群细分为五类风险情况。指南认为,CTC适用于一般风险的结直肠癌筛查与息肉检测,对一般风险人群除影像学外的筛查方式以及筛查年龄等未作建议[8]。
2018年ACS最新指南,对筛查起止时间做出了详细建议,首次提出将一般风险人群的结直肠癌筛查起始时间提前至45岁(合格建议),50岁及以上者仍为强烈建议[9]。筛查停止时间则根据受试者年龄、健康状况和既往筛查史制定了具体的指导原则。可选筛查方式中,ACS最新指南认为双重对比剂钡灌肠不再作为可接受的筛查方式。
2021年,ACG指南在一般风险人群结直肠癌筛查起止年龄和推荐等级上与ACS指南基本类似[10]:50~75岁为强烈推荐(中等质量证据),45~49岁为条件性推荐(极低质量证据),75岁以上人群的筛查则需要个体化决策(条件性推荐,极低质量证据)。
2021年,USPSTF指南在筛查起止年龄推荐中也新增了在45~49岁人群中进行筛查的B类建议,保留了原有的筛查推荐[11]:建议在50~75岁成年人进行筛查(A类建议),76~85岁的人群是否进行筛查需综合考量个人健康状况、筛查史和偏好(C类建议)。
各指南的更新时间及相对上一版的主要更新点见表1,对不同筛查方式的建议频率和推荐程度见表2。

各指南对一般风险人群结直肠癌的筛查方式及频率推荐
各指南对一般风险人群结直肠癌的筛查方式及频率推荐
| 筛查方式 | 美国预防服务工作组 (2021) | 美国胃肠病学会 (2021) | 美国癌症协会(2018) | 美国结直肠癌多学会工作组(2017) |
|---|---|---|---|---|
| 粪便隐血试验 | 每年 | - | 每年 | - |
| 粪便免疫化学测试 | 每年 | 每年(强烈推荐)a | 每年 | 每年(强烈推荐)b |
| 粪便 DNA-免疫化学测试测试 | 每1~3年 | 每3年(条件性推荐)a | 每3年 | 每3年(强烈推荐)b |
| 乙状结肠镜 | 每5年 | 每5~10年(条件性推荐)a | 每5年 | 每5~10年(强烈推荐)b |
乙状结肠镜+粪便免疫 化学测试 | 每10年乙状结肠镜+每年粪便 免疫化学测试 | - | - | - |
| 结肠镜 | 每10年 | 每10年(强烈推荐)a | 每10年 | 每10年(强烈推荐)b |
| 结肠CT造影 | 每5年 | 每5年(条件性推荐)a | 每5年 | 每5年(强烈推荐)b |
| 胶囊结肠镜 | - | 每5年(条件性推荐)a | - | 每5年(弱推荐)c |
| SEPT9 | - | 不建议(强烈推荐)b | - | 不建议(弱推荐)c |
a强烈推荐:明确显示干预措施利大于弊或弊大于利;条件性推荐:利弊不确定或无论质量高低的证据均显示利弊相当;b强烈推荐:被最知情患者选择的建议;c弱推荐:在该推荐中,患者的价值观和偏好可能比证据质量发挥更大作用。“-”表示指南未提及
关于筛查年龄,各指南在50岁及以上的人群中基本达成了共识,即建议50~75岁的一般风险人群进行筛查;建议76~85岁的老年人根据偏好、预期寿命、健康状况和既往筛查史制定个体化筛查策略;超过85岁的人群,不建议继续进行筛查。目前具有争议的是筛查起始年龄:是否要将筛查起始年龄由50岁提前至45岁。
2008年,ACS与USMSTF和ACR联合发布指南,建议一般风险人群从50岁开始筛查结直肠癌[12]。这一建议一直是各协会共识,直到2016年USPSTF在指南中首次讨论将筛查起始时间提前到45岁的筛查效益。
2016年的USPSTF结直肠癌筛查指南,建议一般风险人群从50岁开始筛查(A类建议)。USPSTF主要参考的证据是癌症干预和监测建模网络(Cancer Intervention and Surveillance Modeling Network,CISNET)提供的数据。CISNET基于1975年至1979年的肠癌发病率数据,建模分析结直肠癌最优筛查起始时间。结果显示:相对于从50岁开始的筛查模式,从45岁开始筛查并保持相同的筛查间隔,无论采用哪种筛查方式都会增加额外结肠镜检查次数;然而,如果从45岁开始结肠镜检查并将筛查间隔从10年延长至15年,3个模型中2个模型认为能够提供相同或略多的挽救寿命年(life-years gained,LYG),并不增加额外结肠镜检查次数,另1个模型则认为会使LYG略微受损。由于获得的LYG有限、3个数据模型结果不一致,以及缺少年轻人群筛查的经验性证据,USPSTF决定不建议45岁作为筛查起始时间,而仍以50岁为一般人群结直肠癌筛查起始时间[13]。
2017年,USMSTF的结直肠癌筛查指南建议非洲裔美国人从45岁开始筛查(弱推荐,极低质量证据)[7]。从流行病学来看,相对其他种族,非洲裔美国人的结直肠癌发病率高、发病年龄早、生存率差,50岁之前癌症比例较高[14, 15]。从建模分析来看,MISCAN-Colon微模拟模型和Joinpoint回归分析都支持非洲裔美国人比白人提早5年开始筛查[16, 17]。但USMSTF认为,非洲裔美国人提前筛查的效益尚缺乏相应筛查研究数据支持。
2018年,ACS指南首次提出,将一般风险人群的结直肠癌筛查起始年龄提前至45岁[9],并从疾病负担和建模分析两个角度解释原因。从疾病负担角度来看,由于筛查和暴露风险等多因素影响,1994—2014年美国50岁以下人群的肠癌发病率上升了约51%;2005—2015年死亡率增加11%,而55岁以上人群的肠癌发病率和死亡率稳步下降[18]。在2010—2014年间所有结直肠癌死亡事件中,45~49岁人群的死亡率与50~54岁人群相似(5.1% 比7.6%),两者带来的寿命损失也相似(10%比13%)。从建模角度来看,ACS认为,2016年CISNET的建模是基于过去的发病率数据,没有反映发病率的变化趋势。2018年,ACS和CISNET中的两个小组(MISCAN和SimCRC)合作,重新评估肠癌最佳筛查起始年龄,根据发病趋势对模型进行调整后,两个模型都建议一般风险的人群从45岁开始筛查。ACS在审查疾病负担与模型结果后,认为更早的筛查起始时间具有良好的效益负担平衡,能够降低结直肠癌发病率和死亡率,但由于缺乏50岁以下人群筛查效益的经验性证据,ACS以45岁为肠癌筛查起始时间的建议为合格建议,而非强烈建议[9]。
2021年,ACG指南建议对45~49岁的一般风险人群进行筛查(条件性推荐)[10]。ACG认为,从45岁开始筛查并切除息肉可以降低50岁以上人群的结直肠癌发病率,但需要额外的筛查资源。关于从45岁开始筛查需要的额外资源的评估,2021年ACG的指南提到了Ladabaum等[19]在2019年提出的一个Markov模型。该模型比较了一般风险人群从45岁和50岁开始筛查的成本效益,结果显示,从45岁开始筛查确实具有筛查效益,但在50~75岁人群中筛查的成本效益要更高。如果将50~75岁人群的筛查率提高到80%,将以1/3的成本避免3倍的结直肠癌死亡风险[19]。另外,ACG也认为,目前缺少从45岁开始筛查的有效性的经验性数据,以及审查45岁人群筛查策略的研究。基于同样的考量,2021年USPSTF指南作出了类似的建议:50~75岁的人群筛查为A类建议,45~49岁的人群筛查为B类建议。各指南对筛查起始年龄的推荐汇总见表3。

近5年美国各相关行业协会指南结直肠癌筛查起始年龄推荐
近5年美国各相关行业协会指南结直肠癌筛查起始年龄推荐
| 时间 | 行业协会 | 筛查起始年龄(推荐等级) |
|---|---|---|
| 2016年 | 美国预防服务工作组 | 建议一般风险人群从50岁开始结直肠癌筛查(A类建议)a。 |
| 2017年 | 美国结直肠癌多学会工作组 | 建议非洲裔美国人从45岁开始结直肠癌筛查(弱推荐,极低质量证据)b; 建议非非洲裔美国人50岁开始结直肠癌筛查(强烈推荐,中等质量证据)b。 |
| 2018年 | 美国癌症协会 | 建议一般风险人群的结直肠癌筛查起始年龄提前至45岁(合格建议)c; 建议50岁及以上的一般风险人群进行结直肠癌筛查(强烈建议)c。 |
| 2021年 | 美国胃肠病学会 | 建议对45~49岁的一般风险人群进行结直肠癌筛查(条件性推荐,极低质量证据)d; 推荐50~75岁的一般风险人群进行结直肠癌筛查(强烈推荐,中等质量证据)d。 |
| 2021年 | 美国预防服务工作组 | 建议在45~49岁的一般风险人群中筛查结直肠癌(B类建议)a; 建议所有50~75岁的成年人进行结直肠癌筛查(A类建议)a。 |
aA类建议:推荐,高度肯定具有可观净收益;B类建议:推荐,高度肯定具有适度净效益或中度肯定具有适度到可观的净效益;C类建议:建议根据专业判断和患者偏好,有选择地向患者提供个性化建议。至少中度肯定具有很少的净收益;D类建议:建议不要使用,中度或高度肯定该策略没有净收益或危害大于收益。b强烈推荐:被最知情患者选择的建议;弱推荐:在该推荐中,患者的价值观和偏好可能比证据质量发挥更大作用。c强烈建议:坚持干预的好处大于不良影响,大多数患者会选择干预;合格建议:有明确的获益(危害)证据,但获益和危害的平衡或患者的价值观和偏好的不确定性,可能导致不同的个人决定。d强烈推荐:明确显示干预措施利大于弊或弊大于利;条件性推荐:利弊不确定或无论质量高低的证据均显示利弊相当
结直肠癌的筛查方式可分为粪便检测、直接可视化检测、血液检测和尿液检测。目前USPSTF、ACS和美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)等组织最新发布的结直肠癌筛查指南,都不推荐将血液检测和尿液检测作为常规筛查的方式。各种筛查方式对结直肠癌发病率和死亡率的影响、准确性及成本收益各有不同。本文以2021年5月USPSTF指南最新证据为基础进行简述,并以表4总结各筛查方式特点[20]。
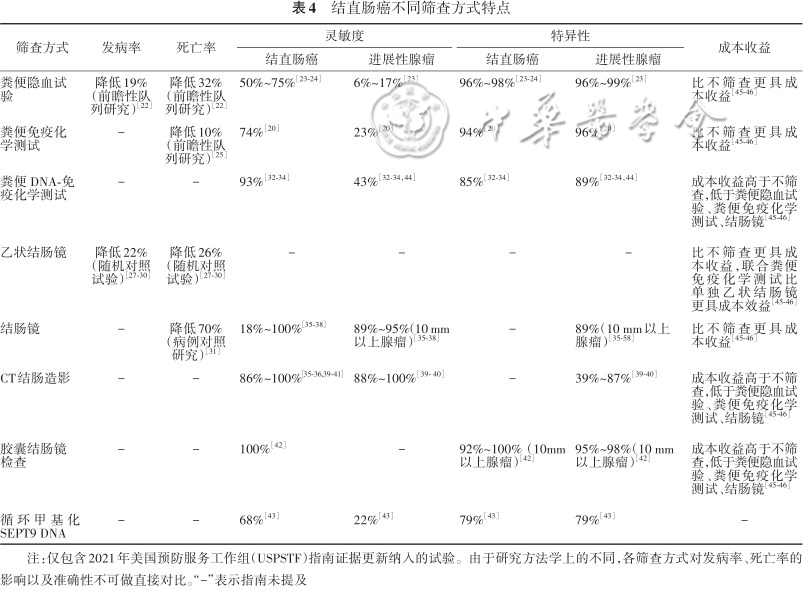
结直肠癌不同筛查方式特点
结直肠癌不同筛查方式特点
| 筛查方式 | 发病率 | 死亡率 | 灵敏度 | 特异性 | 成本收益 | ||
|---|---|---|---|---|---|---|---|
| 结直肠癌 | 进展性腺瘤 | 结直肠癌 | 进展性腺瘤 | ||||
粪便隐血试 验 | 降低19% (前瞻性队列研究)[22] | 降低32% (前瞻性队列研究)[22] | 50%~75%[23, 24] | 6%~17%[23] | 96%~98%[23, 24] | 96%~99%[23] | 比不筛查更具成本收益[45, 46] |
粪便免疫化 学测试 | - | 降低10% (前瞻性队列研究)[25] | 74%[20] | 23%[20] | 94%[20] | 96%[20] | 比不筛查更具成本收益[45, 46] |
粪便 DNA-免 疫化学测试 | - | - | 93%[32, 33, 34] | 43%[32, 33, 34,44] | 85%[32, 33, 34] | 89%[32, 33, 34,44] | 成本收益高于不筛查,低于粪便隐血试验、粪便免疫化学测试、结肠镜[45, 46] |
| 乙状结肠镜 | 降低22% | 降低26% | - | - | - | - | 比不筛查更具成本收益,联合粪便免疫化学测试比单独乙状结肠镜更具成本效益[45, 46] |
| 结肠镜 | - | 降低70% (病例对照研究)[31] | 18%~100%[35, 36, 37, 38] | 89%~95%(10 mm以上腺瘤)[35, 36, 37, 38] | - | 89%(10 mm以上 腺瘤)[35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58] | 比不筛查更具成本收益[45, 46] |
| CT结肠造影 | - | - | 86%~100%[35, 36,39, 40, 41] | 88%~100%[39- 40] | - | 39%~87%[39, 40] | 成本收益高于不筛查,低于粪便隐血试验、粪便免疫化学测试、结肠镜[45, 46] |
胶囊结肠镜 检查 | - | - | 100%[42] | - | 92%~100%(10mm以上腺瘤)[42] | 95%~98%(10 mm 以上腺瘤)[42] | 成本收益高于不筛查,低于粪便隐血试验、粪便免疫化学测试、结肠镜[45, 46] |
| 循环甲基化SEPT9 DNA | - | - | 68%[43] | 22%[43] | 79%[43] | 79%[43] | - |
注:仅包含2021年美国预防服务工作组(USPSTF)指南证据更新纳入的试验。由于研究方法学上的不同,各筛查方式对发病率、死亡率的影响以及准确性不可做直接对比。“-”表示指南未提及
粪便隐血试验(fecal occult-blood test,gFOBT)是基于粪便隐血最早的结直肠癌筛查方式,主要检测粪便中的血红蛋白[21]。明尼苏达州的一项随访时间长达30年的前瞻性队列研究结果显示,每年1次的gFOBT筛查可降低结直肠癌发病率19%(RR=0.81,95%CI:0.71~0.93),降低结直肠癌死亡率32%(RR=0.68,95%CI:0.56~0.82)[22]。gFOBT的单次检测灵敏度较低,临床中通过从3个粪便样本中各取2个样本检测来提高灵敏度,检测肠癌的灵敏度为50%~75%,特异性为96%~98%[23, 24]。
FIT使用针对血红蛋白中珠蛋白的抗体,检测粪便中的血红蛋白。2004—2009年,Chiu等[25]以中国台湾50~69岁约500万居民为研究对象,展开了随访时间6年的大型前瞻性队列研究,比较FIT筛查组人群和未筛查人群的结直肠癌死亡率,经过1~3轮两年一次的FIT筛查,在对选择偏差进行调整后,发现筛查组结直肠癌死亡率显著降低10%(RR=0.90,95%CI:0.84~0.95)[25]。FIT在临床实践中没有gFOBT的局限性,不受饮食和药物的限制,受检者参与度较高,成本较低,灵敏度和特异性相当,见表4[26]。因此FIT在临床工作中很大程度上已取代gFOBT成为主要的粪便隐血检测方式[10];USMSTF推荐用FIT替代gFOBT[7]。但FIT也具有其局限性,FIT的准确性受阳性阈值、性别及年龄的影响,在进展性腺瘤的检测上灵敏度较低,同时无法检测锯齿状病灶。
sDNA-FIT是目前美国食品和药物管理局唯一批准的粪便DNA检测[11],通过检测粪便脱落细胞中的DNA突变(kras突变,BMP甲基化,NDRG4甲基化和β-actin)联合FIT,对受检者进行综合风险评分。综合风险评分超过阈值的受检者需要进行结直肠筛查。目前尚无关于sDNA-FIT降低结直肠癌发病率和死亡率的长期研究[10]。sDNA-FIT可以检测进展性腺瘤与无柄锯齿状病灶,检测结直肠癌和进展性腺瘤的灵敏度都高于gFOBT和FIT,分别为93%与43%,但特异性相对较低,分别为85%与89%,价格较高,见表4。
需要注意的是,不管是哪种基于粪便检测方式,阳性的结果都需要进一步的结肠镜检查来验证,才能具有筛查效益。
2021年,USPSTF推荐用于结直肠癌筛查的直接可视化检查包括结肠镜检查、乙状结肠镜检查和CTC[11]。2021年ACG推荐用于结肠癌筛查的直接可视化检查还包括了CC[10]。直接可视化检查能够同时检测息肉和肿瘤,但同时一般都需要在医院完成,需要肠道准备和麻醉。结肠镜是结直肠癌筛查普遍应用的金标准[47];乙状结肠镜和CTC筛查的异常结果需结肠镜的进一步验证。
1.结肠镜:结肠镜是结直肠癌筛查的金标准,可以检测早期肠癌并切除腺瘤和无蒂锯齿状息肉,从而提供长期保护,达到筛查效益。Nishihara等[48]以美国卫生专业人员队列的88 902名参与者为研究对象,对其进行22年随访,结果显示,结肠镜筛查后结直肠癌死亡风险降低(中位风险比=0.32,95%CI:0.24~0.45),近端结肠癌死亡风险降低(中位风险比=0.47,95%CI:0.29~0.76)[48]。以美国退伍军人队列中52岁及以上的退伍军人为研究对象展开的一项大型病例对照研究报告称,结肠镜检查使退伍军人的结直肠癌死亡率降低了70%(OR=0.30,95%CI:0.24~0.38),且在左侧肿瘤的检测中有更大的筛查效益(OR=0.28,95%CI:0.24~0.32)[31]。目前有4项研究报告了结肠镜检查的准确性,由于其中肠癌的数量有限,检测肠癌的灵敏度跨度较大,为0.18~1.0(95%CI:0.01~1.00);其中对于10 mm以上腺瘤,结肠镜的灵敏度为0.89~0.95(95%CI:0.70~0.99),特异性为0.89(95%CI:0.86~0.91)[35, 36, 37, 38]。
2.乙状结肠镜:乙状结肠镜可以检查降结肠、乙状结肠和直肠,对肠道准备要求较低。4项使用意向性分析(intention-to-treat,ITT)的随机对照试验汇总结果显示,经过11~17年的随访,与未筛查组相比,1次或2次的乙状结肠镜筛查使结直肠癌发病率下降(IRR=0.78;95%CI:0.74~0.83),结直肠癌特异性死亡率下降(IRR=0.74;95%CI:0.68~0.80)[27, 28, 29, 30]。然而,乙状结肠镜在女性人群筛查中的有效性目前存在争议。挪威NORCCAP试验通过对98 678人的15年随访,发现女性筛查组和对照组的结直肠癌绝对风险分别为1.86%和2.05%,男性则相应为1.72%和2.50%,女性筛查组和对照组的结直肠癌死亡绝对风险分别为0.60%和0.59%,而男性则相应为0.49%和0.81%,总体来说,乙状结肠镜检查对女性结直肠癌发病率和死亡率几乎没有影响[27]。USPSTF目前尚未发现有研究以结肠镜为参考标准,评估一般风险人群使用乙状结肠镜筛查肠癌的准确性[20]。
3.CTC和CC:ACG推荐拒绝接受结肠镜检查、FIT或不适合结肠镜检查的人群采用CTC或CC作为替代影像检测,如果结果阳性,仍需结肠镜的进一步检查[10]。2021年USPSTF对肠癌筛查指南的证据更新中,纳入了多项高质量的研究分析CTC和CC筛查结直肠癌与进展性腺瘤的准确性,但缺乏CTC或CC筛查对结直肠癌发病率和死亡率影响的前瞻性研究[20]。
CTC检测结直肠癌的灵敏度为0.86~1.0(95%CI:0.21~1.0)[35, 36,39, 40, 41],检测进展性腺瘤的灵敏度和特异性为0.88~1.0(95%CI:0.66~1.0),0.39~0.87(95%CI:0.34~0.90)[39, 40]。CTC检测无蒂锯齿状息肉(sessile serrated polyp,SSP)的准确率低于结肠镜(0.4%比3.1%),且对特别平坦、位于近端结肠的以及发育不良的SSP检测率显著降低[49]。
CC检测结直肠癌的灵敏度和特异性分别为1.00(95%CI:0.34~1.0)和1.0(95%CI:0.98~1.0);检测10 mm及以上的腺瘤的灵敏度和特异性分别为0.92~1.0(95%CI:0.7~1.0)和0.95~0.98(95%CI:0.93~0.99)[42]。2014年,美国食品和药物管理局批准CC仅供肠道准备充分、结肠镜检查不完整的患者使用,但由于从技术上CC不可能对结肠进行完整的评估,并未批准CC作为结直肠癌的筛查方式。2018年ACS肠癌筛查指南将CC列为“不推荐用作常规筛查的新兴技术”[9]。2021年ACG指南将CC列为“不能或不愿意进行结肠镜或FIT检查的人群的可选筛查方式”[9]。
USPSTF证据更新尚未发现前瞻性研究评估基于血液的筛查方式对结直肠癌发病率或死亡率的影响[20]。SEPT9甲基化是一种新的基于血液的结直肠癌生物标志物。美国食品和药物管理局 2016年批准其用于拒绝其他肠癌筛查方式的50岁及以上一般风险人群的肠癌筛查。一项回顾性病例对照研究对比了二代SEPT9和FIT在肠癌筛查中的准确性,结果显示,SEPT9检测结直肠癌的灵敏度和特异性优于FIT(灵敏度:74.8%比58.0%;特异性:87.4%比82.4%),但两者在进展性腺瘤中灵敏度和特异性相似[50]。目前缺少SEPT9在肠癌筛查方面的相关前瞻性研究。SEPT9并未被纳入各肠癌筛查指南推荐的筛查方式,ACG和USMSTF更明确不建议使用SEPT9进行结直肠癌筛查。长远来看,血液检测作为一种无创、方便且风险小的筛查方式,相对粪便检测更容易被受检者接受和坚持,具有广阔的研究前景和应用潜力。
Lin等[20]还确定了一项新的代谢组学尿液检测方式,其中只有一个小型研究具有检测的准确性数据,且仅限于检测腺瘤。目前并无前瞻性研究评估基于尿液的筛查方式对结直肠癌发病率或死亡率的影响。
国内外的实践经验都证明,结直肠癌筛查对发病率和死亡率的降低起关键性作用。21世纪美国结直肠癌发病率以每年3%的速度下降,2016年死亡率较1970年下降53%[51];ACS认为,这主要归因于结直肠癌早诊早治水平的进步和肠镜筛查率的提升:2000年至2015年,美国50岁以上人群的肠镜检查率由21%提升至60%。国内也有大规模筛查的优秀案例:郑树教授团队在浙江嘉善采用数量化高危因素序贯筛查方案,开展60 cm肠镜筛查,筛查区的人群结肠癌和直肠癌累计死亡率较对照区下降7.7%和31.7%[52]。
我国目前结直肠癌发病率和死亡率不断攀升,发病趋势年轻化,发病率和死亡率在40岁后上升[53]。而筛查现状尚有很大提升空间:首先,筛查人群依从性较差,FOBT、肠镜依从率仅分别为50%、44%[54];其次,内镜医生与肠镜资源相对缺乏[55, 56],肠镜检查率低,2017年我国50岁以上人群的肠镜检查率仅15%[57]。由于我国筛查人群依从性差、筛查资源相对缺乏的国情,我国关于结直肠癌筛查的指南与专家共识建议通过问卷风险评估、FIT、多靶点粪便DNA检测等方式筛选浓缩高危人群,进行结肠镜检查,但相对缺少循证依据,仍需要未来更多的实践与经验性证据的支持。因此,加强结直肠癌筛查的科普宣传,遵循USPSTF指南提出“能让患者依从而不间断的筛查就是最好的筛查”这一理念,对于提高筛查依从性、提高适宜人群的筛查比例均有重要价值。此外,我国结直肠癌筛查专家共识参考美国等发达国家将筛查年龄提前这一趋势,关注发病率上升的年轻人群,推荐将筛查起始年龄定为40岁[58]。目前该推荐尚缺乏充分的循证医学证据,现阶段是否仍需将有限的医疗资源集中于50岁以上人群的筛查,以获得更好的筛查收益和卫生经济学价值,值得进一步的研究。
毋庸置疑,为减轻我国结直肠癌的疾病负担,在借鉴发达国家的筛查经验和指南的同时,我国应结合医疗资源尤其是肠镜资源短缺这一国情,制定具有循证医学依据、适合我国结直肠癌流行病学特点的筛查策略,同时提高适宜人群筛查率、筛查依从性以及筛查质量,方能在“健康中国”策略中稳步前进。
所有作者均声明无利益冲突



























