
应用荟萃分析方法比较补充性肠外营养(SPN)和肠内营养对重症监护病房(ICU)重症患者预后的影响。
以"supplemental parenteral nutrition、parenteral nutrition、enteral nutrition、critically ill"为检索词检索《PubMed》《Embase》《Cochrane Library》《Cochrane Central Register of Controlled Trials》外文数据库,以"补充性肠外营养、肠外营养、肠内营养、重症"为检索词检索《中国生物医学文献服务系统》中文数据库,检索时限为建库至2018年12月,另检索谷歌学术作为补充,检索SPN和肠内营养支持治疗对ICU重症患者预后影响的随机对照研究文献。结局指标包括:感染率、抗感染时间、无抗生素时间、住ICU期间全因病死率、住院期间全因病死率、机械通气时间、住ICU时间、总住院时间。采用RevMan 5.3和Stata 14.0统计软件对符合标准的研究进行荟萃分析。
最终纳入8篇文献共794例患者,包括接受SPN联合肠内营养治疗的SPN组患者387例和仅接受肠内营养的肠内营养组患者407例。纳入的8项研究存在的偏倚风险不确定。与肠内营养组比较,SPN组患者的感染率明显降低(相对危险度=0.79,95%置信区间=0.66~0.94,P<0.01)。2组患者住ICU期间全因病死率、住院期间全因病死率、机械通气时间、住ICU时间、总住院时间相近。亚组分析显示,研究的偏倚风险和随访时间可能是机械通气时间异质性的来源。除住ICU期间全因病死率存在发表偏倚(P<0.05)外,其他结局指标均不存在发表偏倚(P>0.05)。
SPN支持治疗虽然可降低ICU重症患者感染率,但对全因病死率、机械通气时间和住院时间无明显影响。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
当前重症患者营养支持策略首选肠内营养,而危重状态常伴胃肠道功能障碍或喂养不耐受,导致喂养不足,继而影响营养状况、增加感染和ICU住院时间,甚至增加死亡风险[1,2]。补充性肠外营养(SPN)是指肠内营养不足时,部分能量和蛋白质由肠外营养来补充的混合营养支持方法[3]。研究显示,合理的SPN能满足重症患者对能量和蛋白质的需求,促进蛋白质合成、调整氮平衡、改善营养状况,甚至减少并发症、改善预后[4]。而SPN也存在过度喂养风险,可能导致高血糖、肝功能障碍、机械通气延长、感染等不良结局[5]。目前,SPN相关的国内外研究结果尚未形成定论,不同国家或学会对于SPN的推荐意见也不同[6,7,8,9]。本研究通过对SPN和肠内营养治疗重症患者的研究进行荟萃分析,旨在评估SPN和肠内营养支持治疗对重症患者预后的影响。
纳入标准:(1)研究类型为国内外公开发表的SPN和肠内营养治疗重症患者的随机对照研究,语种类别限中文和英文。(2)研究对象为年龄≥18岁的ICU重症患者。(3)干预措施为试验组给予SPN联合肠内营养治疗,对照组仅给予肠内营养治疗。(4)研究中至少包含1项以下结局指标。①感染情况(感染率、抗感染时间、无抗生素时间)。②全因病死率(住ICU期间全因病死率、住院期间全因病死率)。③机械通气时间和住院时间(住ICU时间、总住院时间)。排除标准:(1)文献中患者收治单位为非成人ICU,包括所有儿科和新生儿ICU、急诊室、术后恢复病房、普通内科病房和长期护理机构。(2)重复发表的文献。(3)文献综述、病例报告、意见报告、指南方案、评论、社论、摘要、会议纪要以及资料不全的文献。(4)未提供结局指标的文献。
以"supplemental parenteral nutrition、parenteral nutrition、enteral nutrition、critically ill"为检索词检索《PubMed》《Embase》《Cochrane Library》《Cochrane Central Register of Controlled Trial》外文数据库,以"补充性肠外营养、肠外营养、肠内营养、重症"为检索词检索《中国生物医学文献服务系统》中文数据库,检索时限为建库至2018年12月。同时使用相同中英文检索词通过检索谷歌学术作为补充。按照系统综述和荟萃分析优先报告的条目声明筛选文献[10]。由本文第1作者和第3作者分别独立对检索到的文献剔重后,根据入选标准依次通过阅读文献题目、摘要和全文进行筛选。交叉核对,意见不同时讨论解决,如仍有争议则由第2作者判定。
由本文第1作者和第3作者分别独立对纳入的研究进行资料提取并汇总,交叉核对,意见不同时讨论解决,如仍有争议则由第2作者判定,缺乏的资料尽量与原文作者联系并予以补充。提取的资料:纳入研究的基本信息,包括文献第1作者、发表年份、患者例数、年龄、性别、治疗时间病情严重程度评分、营养支持启动时间、能量摄入、随访时间;预后结局指标,包括感染率、抗感染时间、无抗生素时间、住ICU期间全因病死率、住院期间全因病死率、机械通气时间和住ICU时间、总住院时间。
由本文的第1作者和第3作者分别独立应用Cochrane系统评价员手册5.2的风险偏倚评估工具,交叉核对,意见不同时讨论解决,如仍有争议则由第2作者判定。评价标准包括:(1)随机序列产生的方法是否正确。(2)是否做到了分配隐藏。(3)是否对参与者和实施者实施盲法。(4)结果测量过程中是否使用盲法。(5)资料是否完整。(6)是否完整报告所有结局指标,有无选择性报道。(7)是否存在其他偏倚风险。对纳入研究的文献,按照上述7条进行"低风险"、"高风险"和"风险未知"判断。用RevMan 5.3软件绘制纳入研究偏倚风险评估图。
采用Stata 14.0统计软件进行分析。荟萃分析中,计数资料采用相对危险度(RR)、计量资料采用标准化均数差(SMD)作为效应统计分析指标,分别计算其95%置信区间,P<0.05为差异有统计学意义。采用随机效应模型(逆方差法)和固定效应模型(计数资料使用Mantel-Haenszel法,计量资料使用逆方差法)估计合并效应量。应用I2和χ2检验进行异质性检验,I2≥ 50%、P≤ 0.1为异质性明显,采用随机效应模型进行统计分析;I2<50%、P>0.1判定为无明显异质性,采用固定效应模型进行分析。采用敏感性分析评估去除任何一项研究对整体效应量的影响[11],如去除单项研究后合并效应量无明显改变,表示纳入研究总体合并效应量稳定性好;如去除单项研究后合并效应量有明显改变,说明排除的该项研究可能是异质性来源。进一步对可能导致异质性的因素进行亚组分析,采用D-L随机效应模型估计合并效应量[12],若分组后纳入的研究间异质性与总体异质性相比无明显改变则说明该分组因素可能不是异质性来源;反之,有明显改变则说明该因素为异质性来源。应用Egger检验分析发表偏倚[13],P<0.05为存在发表偏倚,P≥ 0.05表示不存在发表偏倚。
初步检索到1 381篇相关文献,经逐层筛选,最终8篇文献[14,15,16,17,18,19,20,21]纳入本荟萃分析。见图1。
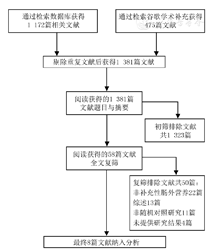

纳入的8篇文献中共有794例患者,包括接受SPN联合肠内营养治疗的SPN组患者387例和仅接受肠内营养的肠内营养组患者407例,年龄40.1~67.5岁,营养支持启动时间均为入住ICU 7 d内,营养支持治疗时间多为7 d,急性生理学和慢性健康状况评价Ⅱ(APACHEⅡ)评分为17.00~25分。8篇文献的基本信息、结局指标分别见表1、表2。
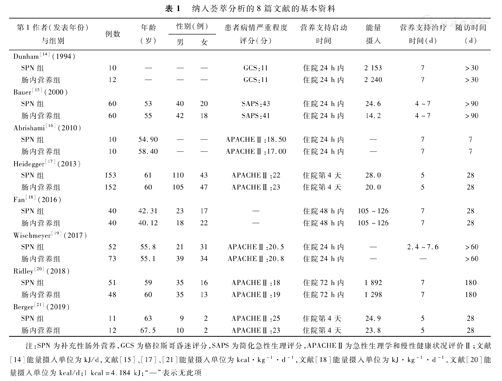
纳入荟萃分析的8篇文献的基本资料
纳入荟萃分析的8篇文献的基本资料
| 第1作者(发表年份)与组别 | 例数 | 年龄(岁) | 性别(例) | 患者病情严重程度评分(分) | 营养支持启动时间 | 能量摄入 | 营养支持治疗时间(d) | 随访时间(d) | ||
|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | |||||||||
| Dunham[14](1994) | ||||||||||
| SPN组 | 10 | — | — | — | GCS:11 | 住院24 h内 | 2 153 | 7 | >30 | |
| 肠内营养组 | 12 | — | — | — | GCS:11 | 住院24 h内 | 2 240 | 7 | >30 | |
| Bauer[15](2000) | ||||||||||
| SPN组 | 60 | 53 | 40 | 20 | SAPS:43 | 住院24 h内 | 24.6 | 4~7 | >90 | |
| 肠内营养组 | 60 | 55 | 42 | 18 | SAPS:41 | 住院24 h内 | 14.2 | 4~7 | >90 | |
| Abrishami[16](2010) | ||||||||||
| SPN组 | 10 | 54.90 | — | — | APACHEⅡ:18.50 | 住院24 h内 | — | 7 | 7 | |
| 肠内营养组 | 10 | 58.40 | — | — | APACHEⅡ:17.00 | 住院24 h内 | — | 7 | 7 | |
| Heidegger[17](2013) | ||||||||||
| SPN组 | 153 | 61 | 110 | 43 | APACHEⅡ:22 | 住院第4天 | 28.0 | 5 | 28 | |
| 肠内营养组 | 152 | 60 | 105 | 47 | APACHEⅡ:23 | 住院第4天 | 20.0 | 5 | 28 | |
| Fan[18](2016) | ||||||||||
| SPN组 | 40 | 42.31 | 23 | 17 | — | 住院48 h内 | 105~126 | 7 | 28 | |
| 肠内营养组 | 40 | 40.12 | 18 | 22 | — | 住院48 h内 | 105~126 | 7 | 28 | |
| Wischmeyer[19](2017) | ||||||||||
| SPN组 | 52 | 55.8 | 21 | 31 | APACHEⅡ:20.5 | 住院24 h内 | — | 2.4~7.6 | >60 | |
| 肠内营养组 | 73 | 55.1 | 39 | 34 | APACHEⅡ:20.8 | 住院24 h内 | — | — | >60 | |
| Ridley[20](2018) | ||||||||||
| SPN组 | 51 | 59 | 35 | 16 | APACHEⅡ:18 | 住院72 h内 | 1 892 | 7 | 180 | |
| 肠内营养组 | 48 | 60 | 35 | 13 | APACHEⅡ:19 | 住院72 h内 | 1 298 | 7 | 180 | |
| Berger[21](2019) | ||||||||||
| SPN组 | 11 | 63 | 9 | 2 | APACHEⅡ:25 | 住院第4天 | 24.9 | 5 | 28 | |
| 肠内营养组 | 12 | 67.5 | 10 | 2 | APACHEⅡ:23 | 住院第4天 | 23.8 | 5 | 28 | |
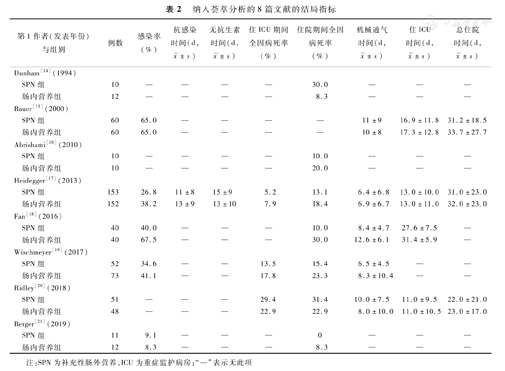
纳入荟萃分析的8篇文献的结局指标
纳入荟萃分析的8篇文献的结局指标
| 第1作者(发表年份)与组别 | 例数 | 感染率(%) | 抗感染时间(d, ±s) ±s) | 无抗生素时间(d, ±s) ±s) | 住ICU期间全因病死率(%) | 住院期间全因病死率(%) | 机械通气时间(d, ±s) ±s) | 住ICU时间(d, ±s) ±s) | 总住院时间(d, ±s) ±s) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Dunham[14](1994) | ||||||||||
| SPN组 | 10 | — | — | — | — | 30.0 | — | — | — | |
| 肠内营养组 | 12 | — | — | — | — | 8.3 | — | — | — | |
| Bauer[15](2000) | ||||||||||
| SPN组 | 60 | 65.0 | — | — | — | — | 11±9 | 16.9±11.8 | 31.2±18.5 | |
| 肠内营养组 | 60 | 65.0 | — | — | — | — | 10±8 | 17.3±12.8 | 33.7±27.7 | |
| Abrishami[16](2010) | ||||||||||
| SPN组 | 10 | — | — | — | — | 10.0 | — | — | — | |
| 肠内营养组 | 10 | — | — | — | — | 20.0 | — | — | — | |
| Heidegger[17](2013) | ||||||||||
| SPN组 | 153 | 26.8 | 11±8 | 15±9 | 5.2 | 13.1 | 6.4±6.8 | 13.0±10.0 | 31.0±23.0 | |
| 肠内营养组 | 152 | 38.2 | 13±9 | 13±10 | 7.9 | 18.4 | 6.9±6.7 | 13.0±11.0 | 32.0±23.0 | |
| Fan[18](2016) | ||||||||||
| SPN组 | 40 | 40.0 | — | — | — | 10.0 | 8.4±4.7 | 27.6±7.5 | — | |
| 肠内营养组 | 40 | 67.5 | — | — | — | 30.0 | 12.6±6.1 | 31.4±5.9 | — | |
| Wischmeyer[19](2017) | ||||||||||
| SPN组 | 52 | 34.6 | — | — | 13.5 | 15.4 | 6.5±4.5 | — | — | |
| 肠内营养组 | 73 | 41.1 | — | — | 17.8 | 23.3 | 8.3±10.4 | — | — | |
| Ridley[20](2018) | ||||||||||
| SPN组 | 51 | — | — | — | 29.4 | 31.4 | 10.0±7.5 | 11.0±9.5 | 22.0±21.0 | |
| 肠内营养组 | 48 | — | — | — | 22.9 | 22.9 | 8.0±10.0 | 11.0±10.5 | 23.0±17.0 | |
| Berger[21](2019) | ||||||||||
| SPN组 | 11 | 9.1 | — | — | — | 0 | — | — | — | |
| 肠内营养组 | 12 | 8.3 | — | — | — | 8.3 | — | — | — | |
注:SPN为补充性肠外营养,ICU为重症监护病房;"—"表示无此项
在随机序列生成方面,6项研究[15,17,18,19,20,21]描述了随机序列产生方式且随机化方法正确,2项研究[14,16]不清楚;在是否分配隐藏方面,2项研究[18,19]表示未分配隐藏,3项研究[15,17,21]做出分配隐藏,3项研究[14,16,20]未说明是否分配隐藏;2项研究[16,20]未进行盲法评估,2项研究[17,19]不清楚是否进行盲法评估,4项研究[14,15,18,21]盲法评估清楚;5项研究[14,17,18,19,21]结果测量过程中使用了盲法,3项研究[15,16,20]未说明结果测量过程中使用了盲法;7项研究[14,15,16,17,19,20,21]资料完整,1项研究[18]不清楚;7项研究[15,16,17,18,19,20,21]无选择性报道,1项研究[14]不清楚;所有研究[14,15,16,17,18,19,20,21]均无其他偏倚风险,所有研究失访比例均<5%。综上,本研究中纳入的8项研究存在的偏倚风险不确定。见图2。
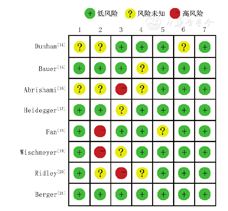

注:1.随机序列产生的方法是否正确,2.是否做到了分配隐藏,3.是否对参与者和实施者实施盲法,4.结果测量过程中是否使用盲法,5.资料是否完整,6.是否完整报告所有结局指标,7.是否存在其他偏倚风险
感染率纳入5项研究[15,17,18,19,21]间无明显异质性(I2=26.4%,P=0.246),固定效应模型荟萃分析结果显示,SPN组患者的感染率明显低于肠内营养组(RR=0.79,95%置信区间=0.66~0.94,P=0.008)。
住ICU期间全因病死率纳入3项研究[17,19,20]间无明显异质性(I2=0,P=0.423),固定效应模型荟萃分析结果显示,SPN组和肠内营养组患者的住ICU期间全因病死率相近(RR=0.90,95%置信区间=0.57~1.40,P=0.636)。住院期间全因病死率纳入7项研究[14,16,17,18,19,20,21]间无明显异质性(I2=20.1%,P=0.276),固定效应模型荟萃分析结果显示,SPN组和肠内营养组患者的住院期间全因病死率相近(RR=0.78,95%置信区间=0.57~1.07,P=0.126)。
机械通气时间纳入5项研究[15,17,18,19,20]间有明显异质性(I2=68.9%,P=0.012),随机效应模型荟萃分析结果显示,SPN组和肠内营养组患者的机械通气时间相近(SMD=-0.12,95%置信区间=-0.40~0.15,P=0.385)。住ICU时间纳入4项研究[15,17,18,20]间无明显异质性(I2=42.3%,P=0.158),固定效应模型荟萃分析结果显示,SPN组和肠内营养组患者的住ICU时间相近(SMD=-0.08,95%置信区间=-0.24~0.08,P=0.336)。总住院时间纳入3项研究[15,17,20]间无明显异质性(I2=0,P=0.958),固定效应模型荟萃分析结果显示,SPN组和肠内营养组患者的总住院时间相近(SMD=-0.06,95%置信区间=-0.23~0.11,P=0.496)。
机械通气时间的荟萃分析显示有明显异质性,任意除去单项研究后合并效应量无明显改变,表示纳入研究总体在机械通气时间上合并效应量稳定性好。笔者认为异质性可能来源于盲法应用、偏倚风险、随访时间和基础APACHEⅡ评分差异。亚组分析显示,按研究是否采用盲法分组后,非盲法组研究间存在高度异质性(I2>50%),但稍高于原I2值68.9%,可见盲法选择可能不是异质性来源。按照病例选择偏倚风险分组后,偏倚风险未知组研究间不存在异质性(I2=0),高偏倚风险组研究间存在高度异质性(I2>50%),可见选择研究的偏倚风险可能是异质性来源。按照随访时间分组后,随访时间<30 d组存在高度异质性(I2>50%),随访时间≥30 d组异质性较低(I2=32.5%),可见随访时间选择可能是异质性来源。根据APACHEⅡ评分高低分组后,APACHEⅡ评分<22分组存在高度异质性(I2>50%),但稍低于原I2值68.9%,可见APACHE Ⅱ评分可能不是研究异质性来源,需要进一步扩充样本容量。见表3。
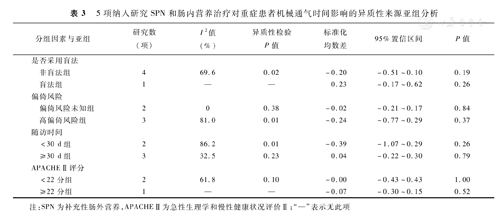
5项纳入研究SPN和肠内营养治疗对重症患者机械通气时间影响的异质性来源亚组分析
5项纳入研究SPN和肠内营养治疗对重症患者机械通气时间影响的异质性来源亚组分析
| 分组因素与亚组 | 研究数(项) | I2值(%) | 异质性检验P值 | 标准化均数差 | 95%置信区间 | P值 | |
|---|---|---|---|---|---|---|---|
| 是否采用盲法 | |||||||
| 非盲法组 | 4 | 69.6 | 0.02 | -0.20 | -0.51~0.10 | 0.19 | |
| 盲法组 | 1 | — | — | 0.23 | -0.17~0.62 | 0.26 | |
| 偏倚风险 | |||||||
| 偏倚风险未知组 | 2 | 0 | 0.38 | -0.02 | -0.21~0.17 | 0.84 | |
| 高偏倚风险组 | 3 | 81.0 | 0.01 | -0.24 | -0.77~0.29 | 0.37 | |
| 随访时间 | |||||||
| <30 d组 | 2 | 86.2 | 0.01 | -0.39 | -1.07~0.29 | 0.26 | |
| ≥30 d组 | 3 | 32.5 | 0.23 | 0.04 | -0.22~0.30 | 0.79 | |
| APACHEⅡ评分 | |||||||
| <22分组 | 2 | 61.8 | 0.10 | -0.00 | -0.43~0.43 | 1.00 | |
| ≥22分组 | 1 | — | — | -0.07 | -0.30~0.15 | 0.52 | |
注:SPN为补充性肠外营养,APACHEⅡ为急性生理学和慢性健康状况评价Ⅱ;"—"表示无此项
感染率、住院期间全因病死率、机械通气时间、住ICU时间、总住院时间均不存在发表偏倚(P=0.714、0.628、0.645、0.366、0.573)。抗感染时间和无抗生素时间由于仅有1项不做检验。住ICU期间全因病死率存在发表偏倚(P=0.029)。
当前对重症患者添加肠外营养有诸多争议。早年美国肠外肠内营养协会(ASPEN)和欧洲肠外肠内营养协会对此曾持有2种观点,前者认为入ICU 7~10 d以内不需添加肠外营养[22],而后者则强调当入ICU 2 d内如肠内营养不足则增加肠外营养[23]。最近ASPEN指南仍然认为,无论低还是高营养风险患者,开始肠内营养的7 d内给予SPN,不仅不能改善预后,甚至可能有害[7]。而《成人SPN中国共识》则建议针对高营养风险者,如果在入ICU 48~72 h内无法达到60%目标能量及蛋白质需要量时,推荐早期实施SPN[9]。
有研究显示,早期肠外营养可缩短ICU重症患者的机械通气时间[22];Singer等[24]对重症患者采用间接能量测定法调整肠外营养治疗量,结果显示SPN能明显降低院内感染风险、缩短机械通气时间和住ICU时间,甚至降低病死率。然而也有研究显示,相比于肠内营养,肠外营养是中心静脉导管感染的独立危险因素并会提升血糖水平[25,26]。在本荟萃分析纳入的随机对照研究中,Heidegger等[17]研究纳入305例入院后第3天肠内营养仍未达到60%目标量的ICU患者,且预期生存时间>7 d、预期ICU滞留时间>5 d,SPN组患者在入院后第4天开始给予肠外营养支持,并根据胃肠道功能恢复情况逐步提高肠内营养支持治疗量,在第9天达到完全肠内营养治疗。研究结果显示,SPN组患者的院内感染率较肠内营养组患者有所降低,同时抗生素使用时间明显缩短。同样,Fan等[18]的研究中各有40例神经重症患者被纳入肠内营养组与SPN组,在入ICU 48 h内启动营养支持,结果显示,相比于肠内营养组,SPN组患者住ICU时间缩短,接受机械通气患者数减少、持续时间缩短,住院期间全因病死率也显著降低。Berger等[21]在Heidegger等[17]试验基础上从代谢和免疫角度研究显示,SPN可抑制炎症因子IL-6和TNF-α分泌,明显改善患者免疫功能,而不损害葡萄糖和蛋白质代谢;同时研究显示虽然SPN组患者胰岛素分泌量、总蛋白质合成与降解量较肠内营养组更高,但2组内源性葡萄糖生成、糖异生与净蛋白分解率相近。在6项研究[14,15,16,19,20,21]的主要研究指标(感染率、住ICU期间全因病死率、住院期间全因病死率、机械通气时间、住ICU时间、总住院时间)中,与肠内营养组比较,SPN组患者并无优势。合并后结果显示,SPN可明显降低感染率;但SPN并没有降低患者的住院期间全因病死率和住ICU期间全因病死率,也没有缩短机械通气时间、住ICU时间和总住院时间。抗感染时间纳入1项研究[17],SPN组患者抗感染时间明显短于肠内营养组(P=0.03)。无抗生素时间纳入1项研究[17], SPN组患者无抗生素时间明显长于肠内营养组(P=0.01)。值得注意的是,由于本文在抗感染时间、无抗生素时间上仅纳入了1项研究,所以无法通过荟萃分析得出相应结论。未来的研究应更多关注SPN在此2项指标上与肠内营养的差异。另外,由于本荟萃分析内多数研究仅使用单一的能量需求预测公式或以25~30 kcal·kg-1·d-1简易计算患者能量需求,准确性较低,不能特异性反映患者代谢需求,多数研究肠内营养组患者摄入能量不足目标的60%,而SPN组患者可能存在过量喂养,导致了两者负面影响因素相互混杂。
研究显示SPN启动时机不同对预后也有一定影响[27]。一项纳入的研究提示,早期应用SPN(入院后第4天)支持治疗能明显降低重症患者的感染率,缩短抗生素使用时间[17]。而另有研究显示,晚期SPN(入院后第8天)较早期SPN(入院后48 h内)能减少并发症发生、住院费用和缩短机械通气时间[28]。Heyland[29]研究甚至显示,早期SPN反而会增加院内感染风险,明显延长住ICU时间。2016年针对儿科ICU患者的研究显示,早期启动肠外营养治疗明显增加院内感染率,延长机械通气时间和住ICU时间[30]。本研究中纳入的随机对照试验,均应用早期SPN支持治疗。同既往研究结果相似,虽然早期SPN并不能改善生存情况,但可降低院内感染率。添加肠外营养的时机仍有争议,在临床工作中需根据患者实际情况进行个体化选择,平衡营养风险和获益。
本研究存在如下局限性:(1)入选的文献仅8篇且均为英文,未纳入重症烧伤、卒中、儿童患者的营养支持的研究,检索的中文数据库仅包含《中国生物医学文献数据库》,可能存在潜在的发表偏倚。(2)如果存在部分阴性结果的文献未公开发表,可能会有选择性偏倚。(3)在方法学质量评价中部分入选文献研究设计中未明确陈述完整研究设计,个别试验设计不尽合理。8项研究样本量不大、随访时间短、SPN添加时间不同等原因不可避免地造成单一研究的偏倚,从而影响荟萃分析结果。(4)本研究为荟萃分析,缺少患者的个体数据,需要后续研究评估肠外营养配制比例、热量和能量摄取途径等对预后的影响。
综上所述,本研究结果显示,虽然SPN治疗可降低重症患者的感染率,但对病死率和住院时间无明显影响。临床应客观评估SPN的应用指征,SPN的治疗效果需要更多大样本、长期随访的高质量临床研究证实。
所有患者均声明不存在利益冲突



























