
探讨负载银和重组人碱性成纤维细胞生长因子(rh-bFGF)的甲基丙烯酸酐化明胶(GelMA)水凝胶对兔深Ⅱ度烧伤创面的影响。
采用实验研究方法。制备含不同浓度甲基丙烯酸酐(MA)的低浓度MA明胶(GelMA)材料、中浓度GelMA材料和高浓度GelMA材料,加入光引发剂后分别制得低浓度GelMA水凝胶、中浓度GelMA水凝胶和高浓度GelMA水凝胶。采用核磁共振波谱仪检测前述3种浓度GelMA材料的氢核磁共振谱并根据波谱图计算其取代度,采用场发射扫描电子显微镜(FESEM)检测前述3种浓度GelMA水凝胶的三维微观结构及孔径,样本数均为9。根据前述筛选出的MA浓度合成含10种浓度银的GelMA(含银GelMA)溶液,将每种浓度的含银GelMA溶液均分为3份,加入光引发剂后分别暴露于紫外光下持续20、25、35 s,制得相应的含银GelMA水凝胶。采用胶原酶降解法测定不同光交联时间含银GelMA水凝胶降解12、24、36、48 h的降解剩余率及彻底降解所需时长,样本数为5。测定前述筛选出光交联时间下含10种浓度银GelMA水凝胶对金黄色葡萄球菌的抑菌圈直径反映其抑菌能力,样本数均为5。以与含最低浓度银(即不含银)GelMA水凝胶抑菌圈直径相比有统计学意义的含银GelMA水凝胶为有抑菌活性。选取具有抑菌活性的且载药浓度最低的含银GelMA水凝胶,采用FESEM检测其三维微观结构及孔径,采用能谱仪检测其内部银元素的存在情况,样本数均为9。将冻干单纯GelMA水凝胶和冻干含银GelMA水凝胶分别浸没于磷酸盐缓冲液中24 h,通过称重法计算并比较2种水凝胶的溶胀率,样本数为5。根据预实验及前述实验结果,制备含银和rh-bFGF的GelMA水凝胶(简称复合水凝胶)。大体观察复合水凝胶的外观,并采用FESEM检测其三维微观结构与孔径。取30只4~6个月龄、雌雄各半日本大耳兔,在其背部制作深Ⅱ度烧伤创面。以兔头侧为基准,将脊柱左侧创面作为复合水凝胶治疗组,右侧作为纱布对照组,2组创面分别作相应处理。观察伤后3、7、14、21、28 d创面愈合情况;记录伤后7、14、21、28 d创面愈合面积并计算其愈合率,样本数为30。对数据行重复测量方差分析、单因素方差分析、独立样本t检验。
低浓度GelMA材料、中浓度GelMA材料及高浓度GelMA材料的取代度,差异明显(F=1 628.00,P<0.01)。低浓度GelMA水凝胶存在疏松、不规则三维空间网状结构,孔径为(60±17)μm;中浓度GelMA水凝胶的三维空间网络、孔径大小均较均匀规则,孔径为(45±13)μm;高浓度GelMA水凝胶的三维空间网状结构致密、层次混乱,孔径为(25±15)μm。3种GelMA水凝胶孔径大小差异有统计学意义(F=12.20,P<0.01),选取(MA)中浓度为后续材料制作浓度。相同光交联时间下的含不同浓度银GelMA水凝胶的降解性基本一致;20、25、35 s光交联时间下含银GelMA水凝胶降解12 h的降解剩余率分别为(74.2±1.7)%、(85.3±0.9)%、(93.2±1.2)%,降解24 h的降解剩余率分别为(58.3±2.1)%、(65.2±1.8)%、(81.4±2.6)%,降解36 h的降解剩余率分别为(22.4±1.9)%、(45.2±1.7)%、(68.1±1.4)%,降解48 h的降解剩余率分别为(8.2±1.7)%、(32.4±1.3)%、(54.3±2.2)%;20、25、30 s光交联时间下含银GelMA水凝胶彻底降解所需时间分别为(50.2±2.4)、(62.4±1.4)、(72.2±3.2)h,差异有统计学意义(F=182.40,P<0.01),选取25 s作为后续光交联时间。低浓度至高浓度的10种含银GelMA水凝胶对金黄色葡萄球菌的抑菌圈直径依次为(2.6±0.4)、(2.5±0.4)、(3.2±0.4)、(12.1±0.7)、(14.8±0.7)、(15.1±0.5)、(16.2±0.6)、(16.7±0.5)、(16.7±0.4)、(16.7±0.6)mm,基本呈浓度依赖性升高趋势,总体比较差异有统计学意义(F=428.70,P<0.01),与含最低浓度银GelMA水凝胶相比,其他有抑菌活性的含低浓度至高浓度银GelMA水凝胶的抑菌圈直径均明显增大(t值分别为26.35、33.84、43.65、42.17、49.24、55.74、43.72,P<0.01)。对金黄色葡萄球菌抑菌圈直径为(12.1±0.7)mm的含银GelMA水凝胶具有抑菌活性且载药浓度最低,选取该含银浓度为后续材料制作浓度。含银GelMA水凝胶的微观形貌为规律的趋于平行线性的条索状结构,孔径为(45±13)μm,且含有银元素。浸没24 h,含银GelMA水凝胶的溶胀率与单纯GelMA水凝胶相近(P>0.05)。复合水凝胶呈无色清亮透明状;其三维结构为规则、均匀的网格状,内部存在细丝网状结构,孔径为(40±21)μm。伤后3 d,复合水凝胶组兔创面可见大量坏死组织及渗出物;纱布对照组兔创面可见散在结痂,亦可见少量坏死组织及渗出物。伤后7 d,复合水凝胶组兔创面已明显缩小,纱布对照组兔出现创面存在与纱布粘连情况。伤后14 d,复合水凝胶组兔创面红润、可见肉芽组织生长;纱布对照组兔创面基底呈苍白色、血运差。伤后21 d,复合水凝胶组兔创面完全愈合,纱布对照组兔创面出现愈合趋势。伤后28 d,复合水凝胶组兔创面部位可见新生毛发,纱布对照组兔仍残存椭圆形创面。伤后7、14、21、28 d,复合水凝胶组兔创面愈合率均明显大于纱布对照组(t值分别为2.24、4.43、7.67、7.69,P<0.05或P<0.01)。
中浓度GelMA水凝胶在溶胀性、可降解性方面具有良好的理化特性,筛选出的含银GelMA水凝胶具有抑菌活性且载药浓度最低,制得的复合水凝胶可明显缩短兔深Ⅱ度烧伤创面愈合时间。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
日常的医疗诊治中会遇到各种类型的创面,其中大面积深度烧伤创面及慢性难愈性创面的治疗较为棘手。应用敷料覆盖创面是一种常规治疗手段,因此创面敷料的选择及优化显得尤为重要。目前,对医用敷料的要求为不仅要能覆盖创面,还要能提供有利于创面愈合的微环境。早期的医用敷料主要以纱布、棉垫和绷带等为主,只能起到覆盖创面的作用[1];而现代医用敷料应具有止血、抗菌、抗炎、促血管化及调控创面微环境等方面的特点[2]。本文以Van Den Bulcke等[3]提出的敷料制作方法为基础,首先合成了一种具有胶原特性的载药三维支架材料——甲基丙酸烯酐(MA)化明胶(GelMA),然后基于GelMA自身具有光敏性、高溶解性、可载药性、可降解性、低抗原性等特点,通过将GelMA负载银离子及重组人碱性FGF(rh-bFGF)制备成含银+rh-bFGF的GelMA水凝胶(简称复合水凝胶),最后应用该复合水凝胶对兔深Ⅱ度烧伤创面的再生修复进行实验研究,以期为临床修复皮肤及皮下软组织缺损提供一种新思路。
本实验研究遵循国家和解放军联勤保障部队第969医院有关实验动物管理和使用的规定。
30只健康无特殊病原体级4~6个月龄、体重2.5~3.0 kg、雌雄各半日本大耳兔购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
金黄色葡萄球菌标准菌株(ATCC 25923)购自上海艾研生物科技有限公司。氧化氘溶液购自上海子期实验设备有限公司,MA(常温下为液态)、明胶和碳酸钠以及碳酸氢钠粉末、氯化氢和氢氧化钠溶液以及纳米银(常温下为液态)购自美国Sigma公司,Irgacure2959型光引发剂{主要成分为2-羟基-1-[4-(羟基乙氧基)苯基]-2-甲基-1-丙酮}购自德国BASF公司,Mueller Hinton型琼脂、rh-bFGF购自美国Gibco公司,Ⅱ型胶原酶购自美国HyClone公司,HE染色试剂购自伊莱博生物科技(上海)有限公司。
直径为90 mm的灭菌培养皿购自迈博瑞生物膜技术有限公司,12-14KD型透析袋、不同尺寸及形状的光掩膜购自广州清溢生物科技服务有限公司,S4800型场发射扫描电子显微镜(FESEM)购自日本Olympus公司,AV-400型核磁共振波谱仪、QUANTAX200型能谱仪购自德国Bruker公司,Omnicure S2000型紫外光源购自加拿大Lumen Dynamics Group有限责任公司,Alpha 2-4 LD plus型冷冻干燥机购于德国Christ公司。
取碳酸氢钠14.65 g、碳酸钠7.95 g溶于1 L蒸馏水中,加入适量氯化氢调整pH值为9.0,再加入终质量浓度3 g/mL的明胶后于50 ℃恒温水浴条件下用磁力棒搅拌1 h,直至明胶完全溶解。将前述溶液均分为3等份,分别逐滴加入0.125、0.250、0.500 mL MA于50 ℃恒温水浴、避光条件下用磁力棒搅拌3 h。将前述混合液分别移入3个独立的透析袋中于50 ℃恒温超纯水中透析,每6小时更换超纯水1次。1周后将透析袋中剩余的产物(即GelMA)移入培养皿中,于-80 ℃冰箱中冷冻24 h至完全冻干,然后移至冻干机内,冷冻干燥3 d制得冻干低浓度GelMA材料、中浓度GelMA材料、高浓度GelMA材料。取3种浓度冻干材料各10 g,常温下分别溶于100 mL双蒸水中,再分别加入终质量浓度0.5 g/L光引发剂,磁力搅拌10 min后移至光掩膜中,暴露于350 nm的紫外光源下20 s制得低浓度GelMA水凝胶、中浓度GelMA水凝胶、高浓度GelMA水凝胶。
取1.2.1制备好的冻干GelMA材料,常温下溶于氧化氘,然后采用核磁共振波谱仪检测GelMA的氢核磁共振波谱并采用CAD软件(美国Autodesk公司)计算波谱图的取代度。样本数为9。
将1.2.1制备好的GelMA水凝胶材料置于-80 ℃冰箱冷冻48 h,然后移至冻干机冻干3 d制得冻干GelMA水凝胶,采用FESEM检测其600倍镜下三维微观结构及孔径。样本数为9。
根据1.2筛选后的MA浓度,将0.2 mL纳米银于常温下溶于1 L PBS中,然后用移液器分别吸取0(不吸取)、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09 mL前述混合液,分别加至3 mL PBS中,再分别加入0.3 g 冻干GelMA,制得含10种浓度纳米银的GelMA(含银GelMA)溶液。取含银GelMA溶液,同1.2.1制备含银冻干GelMA材料备用;另取含银GelMA溶液,将每种浓度的含银GelMA溶液均分为3份(每份均含10种不同浓度银,共30份样品),每份加入终质量浓度为0.5 g/L的光引发剂,然后将其置于光掩膜中暴露于350 nm的紫外光源下,3份样品的暴露时间分别为20、25、35 s,制得3种不同光交联时间的含银GelMA水凝胶,规格均为直径7 mm、厚度2 mm的圆形。
取不同光交联时间水凝胶样品,称重并记录初始质量并记为W1。然后将其浸入37 ℃降解液(含0.25 mg/mLⅡ型胶原酶的PBS)中,测定降解12、24、36、48 h的降解剩余率及水凝胶彻底降解所需时长。每次取出的样品,均用PBS冲洗后再用纸巾吸干表面水分并称重,称重并记录降解后材料的重量并记为Wx,样品降解剩余率=Wx÷W1×100%。本实验重复5次。
将含10种浓度银的GelMA水凝胶移至含金黄色葡萄球菌的琼脂培养皿表面,然后置于37 ℃培养箱内孵育18 h,通过观察并测量培养皿内部抑菌圈直径评价含银GelMA水凝胶的抗菌能力,本实验重复5次。
以与含最低浓度银(即不含银)GelMA水凝胶抑菌圈直径相比有统计学意义的含银GelMA水凝胶为有抑菌活性。根据1.3.2的抗菌测试结果,选取有抑菌活性的且载药浓度最低的含银GelMA水凝胶。取该含银GelMA水凝胶同1.2.3制得冻干含银GelMA水凝胶。将前述每种样品再均分为2份,1份同1.2.3采用FESEM检测样品的三维微观结构及孔径;1份置于铝台上固定并喷金,应用能谱仪检测样品内部银元素的存在情况。样本数均为9。
取1.2.3和1.3.3中制得的冻干单纯GelMA水凝胶和冻干含银GelMA水凝胶,分别称重并记为Wd1、Wd2,将前述2种冻干材料置于37 ℃的PBS中浸泡24 h,用纸巾吸干样品表面水分,分别称重并记为WW1、WW2。溶胀率=(WW1/2-Wd1/2)÷Wd1/2×100%,根据2种水凝胶的溶胀率计算结果,分析银离子的加入对材料溶胀性的影响,本实验重复5次。
根据本研究团队预实验探讨的rh-bFGF在GelMA水凝胶含量的预实验结果(另文发表)及前述实验结果,取冻干GelMA 0.12 g,于常温下溶解于1.2 mL PBS中,然后依次加入0.000 06 g光引发剂、0.125 mL rh-bFGF溶液、0.03 mL纳米银溶液混合均匀,然后将其置于光掩膜中暴露于350 nm的紫外光源下25 s,即可制得负载银和rh-bFGF的GelMA水凝胶,即为复合水凝胶。大体观察复合水凝胶的外观,并将其置于预先裁剪的与水凝胶尺寸相当的单层纱布上,再置于无纺布敷料上,在复合水凝胶的表面覆盖隔离纸后独立包装于无菌袋内低温(4 ℃)保存备用。
同1.2.3将复合水凝胶制作成冻干材料,采用FESEM于200倍下观察其三维微观结构及其与含银GelMA的三维观结构(另文发表)差异(确认rh-bFGF是否成功引入)与孔径。样本数为9。
取30 只兔,按照30 mg/kg的剂量,于兔耳缘静脉注射10 mg/mL戊巴比妥钠进行麻醉。以脊柱为中心在背部剃除10 cm×10 cm面积的毛发。将直径20 mm、重100 g的圆柱体铁块置于沸水中预热10 min使其温度上升至98~100 ℃,先后置于兔背两侧间隔3 cm的剃毛皮肤区停留15 s造成深Ⅱ度烧伤创面(经病理切片证实)。采用Meeh-Rubner公式[4]计算兔深Ⅱ度烧伤面积为0.95%~1.30%TBSA,远小于补液指标(30%TBSA),因此直接采用碘伏消毒+生理盐水冲洗创面。以兔头侧为基准,脊柱左侧创面纳入复合水凝胶组,右侧创面纳入纱布对照组,复合水凝胶组创面应用复合水凝胶覆盖,纱布对照组创面应用4 cm×3 cm的单层纱布覆盖;然后2组创面均用无纺布包扎。后续每48小时对创面进行消毒处理及敷料更换。
伤后3、7、14、21、28 d观察2组兔创面愈合情况;通过标准坐标纸拓模精确计算伤后7、14、21、28 d创面愈合面积并计算其愈合率,创面愈合率=(伤后即刻创面面积-未愈合创面面积)÷伤后即刻创面面积×100%。样本数为30。
采用SPSS 22.0统计软件进行数据处理。符合正态分布的计量资料数据以表示,多个样本间总体比较采用重复测量方差分析或单因素方差分析,组间两两比较采用独立样本t检验。P<0.05为差异有统计学意义。
低浓度GelMA材料、中浓度GelMA、高浓度GelMA材料均在5.63、5.68 ppm处存在连续的波峰Ⅰ,同时在4.14 ppm处存在波峰Ⅱ。低浓度GelMA材料、中浓度GelMA材料及高浓度GelMA材料的取代度分别为(22.3±1.7)%、(36.2±1.8)%和(66.3±1.5)%,总体比较差异有统计学意义(F=1 628.00,P<0.001),即3种材料具有不同的取代度。见图1。
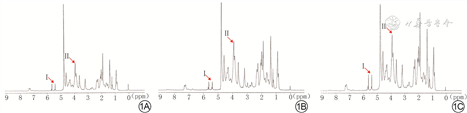

注:红色箭头指示波峰
低浓度GelMA水凝胶存在疏松、不规则三维空间网状结构,孔隙层次不均匀,孔径为(60±17)μm;中浓度GelMA水凝胶三维空间网络、孔径大小均较均匀规则,孔径为(45±13)μm;高浓度GelMA水凝胶支架三维空间网状结构致密、层次混乱,局部区域可见不规则圆孔平铺结构,孔径为(25±15)μm。3种浓度GelMA水凝胶的孔径大小差异明显(F=12.20,P<0.001)。见图2。选取(MA)中浓度作为后续材料制作浓度。


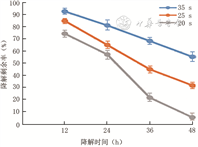
相同光交联时间下含不同浓度银GelMA水凝胶的降解性基本一致。20、25、35 s光交联时间的含银GelMA水凝胶降解12、24、36、48 h的降解剩余率见图3;20、25、35 s交联时间的含银GelMA水凝胶彻底降解所需时间依次为(50.2±2.4)、(62.4±1.4)、(72.2±3.2)h,总体比较,差异有统计学意义(F=182.40,P<0.001)。选取25 s作为后续光交联时间。

低浓度至高浓度的10种含银GelMA水凝胶对金黄色葡萄球菌的抑菌圈直径基本呈浓度依赖性升高趋势,总体比较差异明显(F=428.70,P<0.001)。与含最低浓度银GelMA水凝胶相比,其他有抑菌活性的含低浓度至高浓度银GelMA水凝胶的抑菌圈直径均明显增大(t值分别为26.35、33.84、43.65、42.17、49.24、55.74、43.72,P<0.001)。对金黄色葡萄球菌抑菌圈直径为(12.1±0.7)mm的含银GelMA水凝胶具有抑菌活性且载药浓度最低,选取该含银浓度为后续材料制作的浓度。见图4。
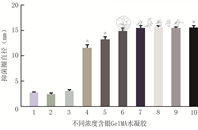

注:GelMA为甲基丙烯酸酐化明胶;横坐标轴下方的1、2、3、4、5、6、7、8、9、10依次代表从低至高的10种含不同浓度银GelMA水凝胶;与最低浓度含银GelMA水凝胶相比,aP<0.01
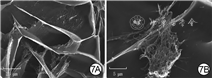
含银GelMA水凝胶的微观形貌为规律的趋于平行线性的条索状结构,孔径为(45±13)μm,且含有银元素,见图5。


浸润24 h,含银GelMA水凝胶的溶胀率为(16.9±0.7)%,与GelMA水凝胶的(16.4±0.5)%相近(t=1.74,P=0.100),即银离子溶液的加入不会改变GelMA水凝胶的溶胀性。
复合水凝胶呈无色清亮透明状且具有一定的黏弹性,见图6。复合水凝胶的三维微观结构为规则、均匀的网格状,其内部存在细丝网状结构,为rh-bFGF材料负载于含银GelMA所致;孔径为(40±21)μm,见图7。



伤后3 d,复合水凝胶组兔创面可见大量坏死组织及渗出物;纱布对照组兔创面可见散在结痂,可见少量坏死组织及渗出物。伤后7 d,复合水凝胶组兔创面已明显缩小,局部仍可见少量渗出及坏死组织;纱布对照组兔创面出现与纱布粘连情况。伤后14 d,复合水凝胶组兔创面坏死组织减少、痂皮逐渐脱落,创面红润可见肉芽组织生长;纱布对照组兔创面中粘连的纱布自行脱落,创面基底呈苍白色、血运差,仍有少量渗出物。伤后21 d,复合水凝胶组兔创面完全愈合;纱布对照组兔创面也出现愈合趋势,创面基底红润,创缘上皮向中央爬行生长。伤后28 d,复合水凝胶组兔创面部位可见新生毛发,纱布对照组兔仍残存椭圆形创面。见图8。伤后7、14、21、28 d,复合水凝胶组兔创面愈合率均明显大于纱布对照组(P<0.05或P<0.01),见表1。
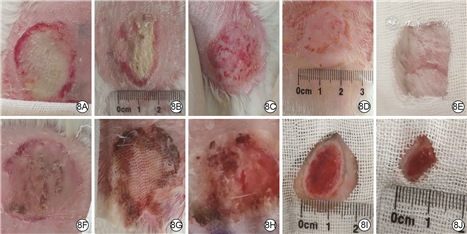

注:复合水凝胶指负载银和重组人碱性成纤维细胞生长因子的甲基丙烯酸酐化明胶水凝胶
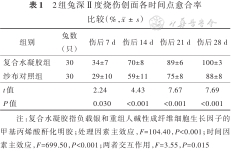
2组兔深Ⅱ度烧伤创面各时间点愈合率比较(%,)
2组兔深Ⅱ度烧伤创面各时间点愈合率比较(%,)
| 组别 | 兔数(只) | 伤后7 d | 伤后14 d | 伤后21 d | 伤后28 d |
|---|---|---|---|---|---|
| 复合水凝胶组 | 30 | 34±7 | 70±8 | 89±6 | 100±3 |
| 纱布对照组 | 30 | 29±10 | 59±11 | 75±8 | 88±8 |
| t值 | 2.24 | 4.43 | 7.67 | 7.69 | |
| P值 | 0.030 | <0.001 | <0.001 | <0.001 |
注:复合水凝胶指负载银和重组人碱性成纤维细胞生长因子的甲基丙烯酸酐化明胶;处理因素主效应,F=104.40,P<0.001;时间因素主效应,F=699.50,P<0.001;两者交互作用,F=3.55,P=0.015
ECM可为细胞的增殖、迁移、分化等生物学活动提供良好微环境,仿生ECM结构的功能材料可以增强细胞生物活性进而促进创面愈合。GelMA水凝胶已被证实具有良好的ECM特性[5],但GelMA材料自身的硬度及活性均由其取代度来决定,即筛选合适取代度的GelMA材料是本实验的基础,本研究选取了三维结构规则均匀的中浓度GelMA材料作为研究参数。目前GelMA水凝胶及其三维支架在与临床相关工程中的应用已经得到了广泛报道,如骨组织工程、心脏工程和血管组织工程等[6, 7]。创面若存在感染易导致愈合延迟[8],而含银离子的非抗生素化合物具有抗菌作用,且可以降低微生物耐药性[9, 10]。GelMA水凝胶自身携带负电荷[11],银离子带正电荷,因此含银GelMA水凝胶具有良好的稳定性,将其应用于创面有利于银离子发挥持续抑菌作用。本研究合成的含银GelMA水凝胶应用临床常见的金黄色葡萄球菌作为测试菌,并筛选出了具有抑菌活性且载药浓度最低的含银GelMA水凝胶。此外,水凝胶的降解性也会影响其促创面愈合作用,而紫外光的交联时间会影响GelMA材料的降解性,本研究筛选出的紫外光最佳交联时间为25 s。
慢性难愈性创面是目前医疗工作中面临的难题,患者常伴严重的基础疾病或自身营养状况差,创面易感染且创周多存在微循环障碍[12, 13, 14, 15]。慢性难愈性创面修复方案主要为常规换药和应用人工敷料、生长因子、富血小板血浆、负压治疗及皮片、皮瓣、肌瓣、肌皮瓣移植等[16, 17, 18, 19]。本研究通过组织工程技术,在GelMA水凝胶支架中负载银+rh-bFGF,使复合水凝胶不但可以作为良好的创面敷料而且具备抗感染和促进创面上皮化的能力。同时,该复合水凝胶具有光敏性便于塑形,可根据创面形状进行个性化治疗。本研究中的复合水凝胶经FESEM观察,可见其微观结构的内部还存在细丝网状结构,这与陈秋东[20]观察到的结果一致。相较于Subraveti和Raghavan等[21]提出的明胶“皮肤”保持方式,本研究中的复合水凝胶采用无菌密封后置于-4 ℃冰箱保存较简单、便捷。
GelMA水凝胶促进创面愈合的作用,可能与其三维支架可加速血管形成有关。具有递送生物活性成分的水凝胶敷料,已经被证实较常规水凝胶敷料或单纯在创面部位注射简单肽溶液更为有效[22, 23, 24, 25, 26]。本研究中的复合水凝胶是一种负载非细胞型水凝胶敷料,其具有如下优点:(1)有一定的黏弹性,可温和黏附在周围皮肤和创面软组织,更换敷料时不破坏创面及其中的新生组织和血管。(2)外层无纺布可防水且密封创面,避免水凝胶敷料干燥,为创面提供良好的愈合环境,且无纺布可吸收创面渗出的组织液和血液。(3)敷料在换药周期内可部分或完全降解,释放的活化银离子可对抗创面内致病原;敷料降解产物可补充创面胶原含量,减轻炎症反应。(4)相关研究显示类似的自制复合水凝胶敷料内部富含精氨酸-甘氨酸-天门冬氨酸基序[27]、基质金属蛋白酶序列[28]和rh-bFGF等成分,提供了创面修复的生长因素,促进了创面愈合,降低了创面感染[29, 30, 31, 32]。(5)具有紫外光诱导交联变性的特性,可通过设计光掩膜的形状来制备各种形状的敷料,如圆形、方形、梭形等,用于创缘不规则的创面,从而实现创面的个体化精准医疗。
本实验为阶段性探索实验,受实验条件及课题经费等限制,有些科学问题没有进行深入研究,如本研究只设了纱布对照组,没有设标准治疗对照组等影响了数据结果的完整性;也未对银离子或rh-bFGF导入GelMA溶液后药物的释放问题[33]进行深入研究,以上均有待后续研究完善。
所有作者均声明不存在利益冲突




























(1)首次将具有ECM特性的甲基丙烯酸酐化明胶(GelMA)同时负载银离子和重组人碱性FGF(rh-bFGF)制得含银+rh-bFGF-GelMA水凝胶(以下简称复合水凝胶)。
(2)该复合水凝胶不仅具有良好的抗菌性能,而且还可以促进创面组织上皮化,从而明显缩短兔深Ⅱ度烧伤创面愈合时间。