
探讨载P311微球的温敏壳聚糖水凝胶对大鼠全层皮肤缺损创面愈合的影响。
采用实验研究方法。通过油包水乳化法制备聚乙烯醇/海藻酸钠微球(单纯微球)、P311微球及异硫氰酸荧光素标记的牛血清白蛋白(FITC-BSA)微球,于光学显微镜/倒置荧光显微镜下观察形貌。制备壳聚糖溶液,将壳聚糖溶液和β-磷酸甘油二钠水合物混合制备单纯温敏水凝胶,在单纯温敏水凝胶中加入相应物质制备载单纯微球和载P311微球的温敏水凝胶,观察4种液体在37 ℃时倾斜状态下的形态变化,冷冻干燥后于扫描电子显微镜下观察微观形貌。取18只3~4周龄雄性SD大鼠,分为不进行任何处理的正常组及于背部脊柱两侧分别制作1个全层皮肤缺损创面并进行相应处理的敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组、载P311微球水凝胶组,每组3只。取5组全层皮肤缺损大鼠,于伤后0(即刻)、5、10、15 d 观察创面愈合情况,计算伤后5、10、15 d创面愈合率;取5组全层皮肤缺损大鼠伤后15 d创面和创缘组织及正常组大鼠相同部位正常皮肤组织,行苏木精-伊红染色观察组织学变化,行免疫组织化学染色观测CD31及血管内皮生长因子(VEGF)的表达,采用蛋白质印迹法检测CD31及VEGF的蛋白表达。样本数均为3。对数据行单因素方差分析、重复测量方差分析及Bonferroni校正。
单纯微球呈球形,表面疏松多孔;P311微球及FITC-BSA微球表面光滑无孔隙,且FITC-BSA微球散发出均匀的绿色荧光;3种微球直径基本一致,为33.1~37.7 μm。在37 ℃时倾斜状态下,与壳聚糖溶液及单纯温敏水凝胶相比,载微球的2种水凝胶结构更稳定。载微球的2种水凝胶网状结构较壳聚糖溶液、单纯温敏水凝胶更致密,且其横断面可见直径约30 μm的微球。伤后15 d内,5组大鼠创面均不同程度愈合,其中载P311微球水凝胶组大鼠创面愈合情况最好。敷贴组、壳聚糖组大鼠伤后5、10、15 d创面愈合率分别为(26.6±2.4)%、(38.5±3.1)%、(50.9±1.5)%,(47.6±2.0)%、(58.5±3.6)%、(66.7±4.1)%,均明显低于载P311微球水凝胶组的(59.3±4.8)%、(87.6±3.2)%、(97.2±1.0)%,P<0.05或P<0.01;单纯水凝胶组大鼠伤后10、15 d及载单纯微球水凝胶组大鼠伤后15 d创面愈合率分别为(76.0±3.3)%、(84.5±3.6)%、(88.0±2.6)%,均明显低于载P311微球水凝胶组(P<0.05)。正常组大鼠正常皮肤中可见表皮、毛囊及皮脂腺,未见CD31和VEGF阳性表达;载P311微球水凝胶组大鼠伤后15 d创面已几乎完全上皮化,创面血管、毛囊、皮脂腺生成及CD31和VEGF阳性表达较其他4组全层皮肤缺损大鼠明显增加,CD31和VEGF蛋白表达均较其余5组大鼠明显增加(P<0.01)。
载P311微球的温敏壳聚糖水凝胶,可以缓释包载的药物,延长药物作用时间,并通过促进创面血管生成及再上皮化,促进全层皮肤缺损大鼠创面愈合。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
皮肤能抵御外界有害刺激,维持人体稳态,但也易受到损伤。当皮肤受到大面积创伤时,临床通常采用功能性修复材料辅助治疗。因此,具有修复效果的创面修复材料一直是研究热点[1, 2]。
P311最初于晚期胚胎小鼠脑组织中被发现,是一种高度保守的多功能蛋白,在促进神经修复、胚胎发育、肿瘤血管形成、维持血压等方面发挥着重要作用[3, 4, 5]。P311近期也被观察到在创面修复中起到重要作用,它可以通过促进小鼠创面新生血管生成和再上皮化,来加速创面愈合[3, 4, 5]。但由于P311的N末端存在含脯氨酸-谷氨酸-丝氨酸-苏氨酸(PEST)结构域,易被降解,在细胞内的半衰期仅为5 min[6],直接使用P311无法持续发挥其效能。因此,开发一种能缓慢释放P311的递送系统,持续发挥其促创面修复效能具有重要的意义。可注射壳聚糖温敏水凝胶能根据体温变化通过物理交联在原位形成凝胶[7],可紧密填充各种不规则创面[8],还有持续递送药物等优点。然而,该体系机械强度不足限制了其在创面修复中的应用。因此,将该温敏水凝胶体系与其他生物材料混合,可能是开发合适的创面修复材料的有效策略[9]。微球是一种新型药物缓释系统,最近在医学领域也备受关注[10]。将微球与凝胶混合,有助于形成更为致密的结构,从而提升复合材料的强度。本研究联合温敏水凝胶及微球设计了一种载P311的复合材料体系,并将其应用于大鼠全层皮肤缺损创面,探讨其对创面修复的影响。
本实验研究遵循陆军军医大学(第三军医大学)动物实验伦理委员会以及国家有关实验动物管理和使用的相关规定。
18只3~4周龄健康无特殊病原体级、体重200 g的雄性SD大鼠购自陆军军医大学(第三军医大学)实验动物中心,许可证号:SYXK(渝)2017-0002。
壳聚糖、聚乙烯醇(1799型)、海藻酸钠均购自上海阿拉丁生化科技股份有限公司,无水氯化钙、矿物油、β-磷酸甘油二钠水合物(β-GP)、环己烷均购自上海麦克林科技有限公司,冰醋酸购自重庆川东化工(集团)有限公司,司盘80购自北京鼎国昌盛生物技术有限责任公司,P311购自合肥科生景肽生物科技有限公司,异硫氰酸荧光素标记的牛血清白蛋白(FITC-BSA)、HE试剂盒均购自北京索莱宝科技有限公司,二氨基联苯胺(DAB)显色试剂盒购自北京中杉金桥生物技术有限公司,辣根过氧化物酶(HRP)标记的山羊抗兔IgG多克隆抗体、多聚甲醛溶液均购自上海碧云天生物技术有限公司,兔源性GAPDH单克隆抗体购自德国CST公司,兔源性CD31多克隆抗体、兔源性VEGF多克隆抗体均购自英国Abcam公司,无菌透明手术敷贴购自美国3M公司。
CX23型光学显微镜、倒置荧光显微镜购自日本Olympus公司,尼康D5600型相机购自日本尼康株式会社,Invitrogen iBright型成像系统购自赛默飞世尔科技有限公司,Gemini 300型扫描电子显微镜(SEM)购自德国蔡司公司。
聚乙烯醇/海藻酸钠微球(单纯微球)的制备:将20 g/L聚乙烯醇500 µL与10 g/L海藻酸钠500 µL混合均匀后备用。将20 μL司盘80滴入4 mL矿物油中,用磁力搅拌器以400 r/min连续搅拌(搅拌的工具和速度下同)15 min,随后将聚乙烯醇/海藻酸钠混合液逐滴加入矿物油中,搅拌15 min后,加入4 mL物质的量浓度0.1 mol/L的氯化钙溶液,继续搅拌15 min。将该体系转移至15 mL离心管内,离心后弃上层油相,保留下层沉淀及中间层乳化相,加入3 mL环己烷,离心后弃上层含油液体,重复3~5次。最后将所得沉淀转移至1.5 mL离心管内,通风橱内过夜,使环己烷完全挥发。
P311/聚乙烯醇/海藻酸钠微球(P311微球)的制备:将40 g/L聚乙烯醇250 µL、20 g/L海藻酸钠250 µL、2 g/L P311 500 µL混合均匀后备用,后续操作同单纯微球的制备。
FITC-BSA/聚乙烯醇/海藻酸钠微球(FITC-BSA微球)的制备:将40 g/L聚乙烯醇250 µL、20 g/L海藻酸钠250 µL、2 g/L FITC-BSA 500 µL混合均匀,后续操作同单纯微球的制备。
将制备的3种微球沉淀重新悬浮后,取适量悬液于玻片上,在200倍光学显微镜下观察单纯微球及P311微球形貌,在200倍倒置荧光显微镜下观察FITC-BSA微球形貌,测量每种微球3个样本直径。
壳聚糖溶液的制备:将15 mg壳聚糖粉末加入提前预冷的500 µL纯水中混匀,于4 ℃配制成30 g/L的溶液并保存。
单纯温敏水凝胶的制备:用β-GP和提前预冷的PBS(pH=7.4)配制600 g/L的β-GP溶液500 µL。同前制备500 µL壳聚糖溶液,在搅拌过程中逐滴加入体积分数1%的乙酸,使壳聚糖完全溶解。上述2种溶液在配制过程中均在冰上进行。将β-GP溶液和壳聚糖溶液混合均匀,于4 ℃保存,置于37 ℃水浴锅中3 min观察其形态变化。
载单纯微球的温敏水凝胶的制备:用500 µL提前预冷的PBS溶液(pH=7.4)重新悬浮1.2.1中制备的全部单纯微球沉淀,随后加入300 mg β-GP粉末并使其溶解。后续操作同单纯温敏水凝胶的制备,即将含有单纯微球和β-GP的PBS溶液与壳聚糖溶液等体积混合,于4 ℃保存。
载P311微球的温敏水凝胶的制备:用500 µL提前预冷的PBS溶液(pH=7.4)重新悬浮1.2.1中制备的全部P311微球沉淀,加入300 mg β-GP粉末并使其溶解。后续操作同单纯温敏水凝胶的制备,即将含有P311微球和β-GP的PBS溶液与壳聚糖溶液等体积混合,于4 ℃保存。
取壳聚糖溶液及3种温敏水凝胶,置于37 ℃水浴锅中,观察其倾斜状态下的形态变化。
将壳聚糖溶液及3种温敏水凝胶于-80 ℃冰箱中冷冻过夜,然后用冷冻干燥机干燥24 h。取4种材料,真空下在材料纵切面喷金后,于200倍SEM下观察微观形貌。
将18只大鼠按随机数字表法分为正常组、敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组、载P311微球水凝胶组,每组3只。每只大鼠按30 mg/kg腹腔注射20 g/L戊巴比妥钠麻醉,背部脱毛、碘伏消毒。正常组大鼠不构建创面,其余5组大鼠用打孔器在大鼠背部脊柱两侧对称处分别制作1个直径10 mm的全层皮肤缺损创面。将敷贴组大鼠创面用无菌手术敷贴覆盖。于其余4组全层皮肤缺损大鼠每个创面表面注射0.2 mL相应的壳聚糖溶液、单纯温敏水凝胶、载单纯微球的温敏水凝胶、载P311微球的温敏水凝胶并使各制剂覆盖创面,待成胶后,用无菌手术敷贴覆盖创面。6组大鼠均单笼饲养。
取5组全层皮肤缺损创面大鼠,每组3只,观察伤后0(即刻)、5、10、15 d所有创面愈合情况,用 ImageJ 图像分析软件(美国国立卫生研究院)量化创面面积并计算伤后5、10、15 d创面愈合率。创面愈合率=(伤后0 d创面面积-伤后其他时间点创面面积)÷伤后0 d创面面积×100%。
伤后15 d,取1.3.2中行创面愈合情况观察后的所有大鼠,同前麻醉,颈椎脱臼处死,分别取左、右侧背部距创缘0.5 cm内的皮肤组织;另取正常组3只大鼠,同前处死后取相同部位正常皮肤组织。取各组大鼠左侧组织(每组3个样本),常规制作石蜡切片(4 µm),取部分切片,行HE染色,于40倍光学显微镜下观察创面组织学变化情况。
取1.3.3制作的切片,行免疫组织化学法检测,于400倍光学显微镜下观察CD31、VEGF的阳性表达(均为棕色)。一抗为兔源性CD31多克隆抗体(稀释比为1∶1 000)、兔源性VEGF多克隆抗体(稀释比为1∶200),二抗为HRP标记的山羊抗兔IgG多克隆抗体。
取1.3.3中切取的各组大鼠右侧组织(每组3个样本),采用蛋白质印迹法检测CD31、VEGF蛋白表达水平。加入的一抗为兔源性CD31多克隆抗体、兔源性VEGF多克隆抗体、兔源性GAPDH单克隆抗体(稀释比均为1∶2 000),二抗为HRP标记的山羊抗兔IgG多克隆抗体(稀释比为1∶5 000)。以GAPDH为内参照,计算目的蛋白与内参照蛋白灰度值比值;以正常组结果为1,计算其他组与正常组的蛋白相对表达量。
采用SPSS 20.0统计软件进行数据分析。计量资料数据均符合正态分布,以表示,多个时间点多组间总体比较行重复测量方差分析,单一时间点多组间总体比较行单因素方差分析,组间两两比较行Bonferroni校正(软件自动略去该统计量值)。P<0.05为差异有统计学意义。
单纯微球呈球形,表面疏松多孔;P311微球及FITC-BSA微球表面光滑无孔隙,且FITC-BSA微球散发出均匀的绿色荧光;制备的3种微球直径基本一致,为33.1~37.7(35.4±2.3)μm。见图1。


壳聚糖溶液在37 ℃仍保持液态;3种水凝胶在37 ℃水浴3 min左右变为凝胶,在瓶体倾斜时仍保持稳定凝胶状态,且含有微球的2种水凝胶结构更加稳定。见图2。冻干后壳聚糖支架呈多孔网状结构;单纯温敏水凝胶支架网状结构更加致密;载单纯微球的温敏水凝胶及载P311微球的温敏水凝胶支架网状结构较前面2种材料致密,且横断面均可见微球,微球直径约30 μm。见图3。


注:微球为聚乙烯醇/海藻酸钠微球,温敏水凝胶由β-磷酸甘油二钠水合物与壳聚糖制成


注:微球为聚乙烯醇/海藻酸钠微球,温敏水凝胶由β-磷酸甘油二钠水合物与壳聚糖制成;图中箭头指示微球
伤后0 d,5组全层皮肤缺损大鼠创面大小基本一致;伤后5、10、15 d,5组大鼠创面均不同程度愈合,其中载P311微球水凝胶组大鼠创面愈合情况最好。见图4。敷贴组、壳聚糖组大鼠伤后5、10、15 d与单纯水凝胶组大鼠伤后10、15 d及载单纯微球水凝胶组大鼠伤后15 d创面愈合率均明显低于载P311微球水凝胶组(P<0.05或P<0.01)。见表1。


注:右侧圆形物为参照物;创面均贴手术敷贴,微球为聚乙烯醇/海藻酸钠微球,水凝胶指由β-磷酸甘油二钠水合物与壳聚糖制成的温敏水凝胶
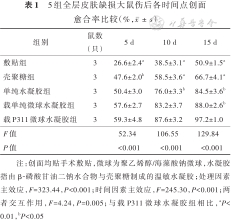
5组全层皮肤缺损大鼠伤后各时间点创面愈合率比较(%,)
5组全层皮肤缺损大鼠伤后各时间点创面愈合率比较(%,)
| 组别 | 鼠数(只) | 5 d | 10 d | 15 d |
|---|---|---|---|---|
| 敷贴组 | 3 | 26.6±2.4a | 38.5±3.1a | 50.9±1.5a |
| 壳聚糖组 | 3 | 47.6±2.0b | 58.5±3.6a | 66.7±4.1a |
| 单纯水凝胶组 | 3 | 50.4±3.0 | 76.0±3.3b | 84.5±3.6b |
| 载单纯微球水凝胶组 | 3 | 57.6±2.7 | 83.2±3.7 | 88.0±2.6b |
| 载P311微球水凝胶组 | 3 | 59.3±4.8 | 87.6±3.2 | 97.2±1.0 |
| F值 | 52.34 | 106.55 | 129.84 | |
| P值 | <0.001 | <0.001 | <0.001 |
注:创面均贴手术敷贴,微球为聚乙烯醇/海藻酸钠微球,水凝胶指由β-磷酸甘油二钠水合物与壳聚糖制成的温敏水凝胶;处理因素主效应,F=323.44,P<0.001;时间因素主效应,F=245.30,P<0.001;两者交互作用,F=4.24,P=0.005;与载P311微球水凝胶组相比,aP<0.01,bP<0.05
正常组大鼠正常皮肤中可见表皮、毛囊及皮脂腺。伤后15 d,敷贴组大鼠创面仅有少许血管生成,壳聚糖组及单纯水凝胶组大鼠创面均有部分血管生成且2组大鼠创面上皮化程度略优于敷贴组,但这3组大鼠创面均未见毛囊或皮脂腺生成。载单纯微球水凝胶组大鼠创面新生血管生成明显增多,创面周围有少许毛囊和皮脂腺生成,并且创面上皮化程度高。载P311微球水凝胶组大鼠创面较敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组有更多的血管、毛囊、皮脂腺生成,且创面已几乎完全上皮化。见图5。
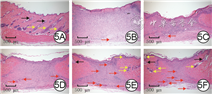

注:黑色箭头指示皮脂腺,黄色箭头指示毛囊,红色箭头指示新生血管;正常组大鼠取与其他5组大鼠相同部位正常皮肤组织;创面均贴手术敷贴,微球为聚乙烯醇/海藻酸钠微球,水凝胶指由β-磷酸甘油二钠水合物与壳聚糖制成的温敏水凝胶
正常组大鼠正常皮肤组织中未见CD31和VEGF阳性表达。伤后15 d,载P311微球水凝胶组大鼠创面中CD31和VEGF阳性表达明显多于敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组。见图6。
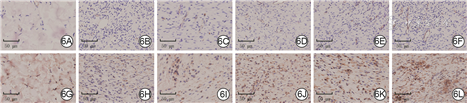

注:正常组大鼠取与其他5组大鼠相同部位正常皮肤组织;创面均贴手术敷贴,微球为聚乙烯醇/海藻酸钠微球,水凝胶指由β-磷酸甘油二钠水合物与壳聚糖制成的温敏水凝胶;VEGF为血管内皮生长因子
正常组大鼠正常皮肤组织及敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组以及载P311微球水凝胶组大鼠伤后15 d创面组织中的CD31蛋白表达量分别为1.000±0.020、1.558±0.026、2.791±0.113、5.879±0.209、6.158±0.053、8.220±0.352,VEGF蛋白表达量分别为1.000±0.027、2.697±0.013、2.877±0.078、4.398±0.193、4.842±0.110、5.749±0.247,组间总体比较,差异均有统计学意义(F值分别为547.21、305.34,P<0.001)。与载P311微球水凝胶组相比,正常组大鼠正常皮肤组织及敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组大鼠创面组织CD31和VEGF蛋白表达量均明显降低(P<0.01)。见图7。
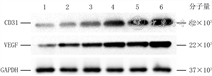

注:创面均贴手术敷贴,微球为聚乙烯醇/海藻酸钠微球,水凝胶指由β-磷酸甘油二钠水合物与壳聚糖制成的温敏水凝胶;VEGF为血管内皮生长因子,GAPDH为3-磷酸甘油醛脱氢酶;条带上方1、2、3、4、5、6分别指示正常组、敷贴组、壳聚糖组、单纯水凝胶组、载单纯微球水凝胶组、载P311微球水凝胶组
皮肤创面是一种常见的临床病症,可由烧创伤、手术等造成,大面积创面往往需要生物活性敷料辅助治疗,因此,学者们长期致力于研发能有效促进创面愈合的敷料。蛋白质和肽类药物能特定地与相应生物靶点作用,并针对创面发挥效能,由于这一特质,活性蛋白质和肽类已被广泛应用于临床[11]。P311在创面愈合中发挥着重要作用[3, 4, 5],但因其含有3个PEST结构域和多个赖氨酸残基,在体内很快会被降解[6],无法持续发挥功效,这限制了P311在临床的应用[12]。
可注射水凝胶通过局部注射方式将载药聚合物注射到靶向部位。溶胶形式的聚合物在给药后会根据体内pH值、温度、离子浓度或酶的变化等形成凝胶[13, 14]。2000年,Chenite等[15]等首次报道了壳聚糖/β-GP体系的温敏性能。壳聚糖是一种天然碱性多糖,有良好的组织相容性和生物可降解性[16],壳聚糖/β-GP体系中的甘油磷酸盐也是公认的无毒生物相容性物质。在常温下,该温敏水凝胶以液态形式包埋药物,用于创面后,因温度升高(约37 ℃)后变为凝胶固定在局部组织中,不仅可被直接注射到创面表面[8],填充不规则形状的创面,还可以随其降解缓慢释放药物,延长药物作用时间。
微球是一种新型药物递送系统,其直径为1~1 000 μm[17],是药物在聚合物基体中吸附或分散形成的一种颗粒分散体系,可通过缓慢、连续释放药物[18]来延长药物疗效,减少用药次数,最近在创面修复领域得到了广泛应用[10]。聚乙烯醇是一种来源丰富的无毒水溶性高分子,有良好的亲水性、化学稳定性和生物相容性[19, 20],且在生物体内能缓慢降解,因而在生物医学领域应用广泛。以往研究中,聚乙烯醇的交联剂通常为醛类,但这些材料都有一定毒性。海藻酸钠是一种天然的聚阴离子多糖,不仅有良好的溶胶性质,还有药物制剂敷料所需的黏性、溶解性、稳定性和安全性[21, 22]。海藻酸钠可以被二价阳离子如钙离子和锌离子交联形成“蛋壳”结构而瞬时凝胶化[23],形成微球。聚乙烯醇与海藻酸钠联合制备的复合载药微球,既对人体无毒害,又可实现药物缓释,减少用药次数,提高药物的稳定性和利用率。
基于此,本研究以聚乙烯醇和海藻酸钠为原料,通过油包水乳化法与氯化钙交联形成微球装载P311,并用可发出荧光的FITC-BSA代替P311蛋白,在倒置荧光显微镜下观察药物(蛋白)在微球中的分布情况。微球的形貌结构观察结果显示,空载微球表面疏松多孔,而载药微球表面光滑无孔隙,且在荧光显微镜下观察到载FITC-BSA的微球发出均匀的绿色荧光,可见药物能够在微球中均匀分布。随后,将壳聚糖和β-GP结合,制备温敏水凝胶,并将载药微球载入水凝胶中,形成微球-水凝胶复合体系。在37 ℃水浴下,聚乙烯醇、海藻酸钠与壳聚糖之间形成的氢键使该凝胶的成形性更好。SEM结果显示,微球散在分布于载单纯微球的温敏水凝胶和载P311微球的温敏水凝胶这2种微球-水凝胶复合体系中,且该复合体系结构与单纯壳聚糖及水凝胶相比,结构更加致密。动物实验结果表明,伤后15 d,载P311微球水凝胶组大鼠创面几乎完全愈合。组织学分析显示,伤后15 d,载P311微球水凝胶组大鼠不仅创面几乎完全上皮化,且创面中新生血管、毛囊、皮脂腺明显更多。创面愈合是一个复杂又高度协调的生物学过程,新生血管的形成是创面愈合过程中关键环节之一,对创面愈合起着十分重要的作用[24, 25]。通过外用创面敷料促进新生血管形成从而促进创面愈合是目前开发新型创面敷料的有效策略[26]。CD31在新生血管中表达阳性,是血管内皮细胞的标志物;VEGF是创面愈合过程中最主要的促血管生成因子[27, 28],在血管内皮细胞的诱导、维持和生长中发挥着积极作用。本研究中免疫组织化学分析及蛋白质印迹法检测结果均显示,载P311微球水凝胶组大鼠创面中CD31和VEGF的表达较其他5组明显增多,可见P311有效促进了创面新生血管生成,这与文献报道的P311敲除小鼠创面新生血管数量、VEGF表达均明显少于P311野生型小鼠[3]一致。
综上,本研究制备了一种联合温敏水凝胶和微球的药物复合体系。该体系可以在37 ℃下实现溶胶-凝胶转变,将溶胶涂抹于创面,溶胶会因体温传导作用,转变为凝胶封闭创面。载微球的温敏水凝胶的致密性及成形性优于单纯温敏水凝胶,制备的复合体系不仅可以缓释包载的药物,实现药物的可控性释放并延长药物作用时间,而且可以在有效促进创面愈合的同时,降低换药频率,从而充分发挥温敏水凝胶和缓释微球的“综合效应”,彰显“1+1>2”的优势。该载药微球-温敏水凝胶复合体系有望成为一种新型创面敷料,为皮肤创面治疗提供新的诊疗理念和治疗方案。需要指出的是,该研究仅是一种初步探索,仅在动物创面愈合水平对药物的缓释行为进行了初步探索。本课题组将在日后对该复合材料的药物加载率及药物控释行为等进行深入研究与探索,以期在创面愈合方面取得成果突破和理想进展。
所有作者均声明不存在利益冲突




























(1)制备了一种包载P311的温敏水凝胶和微球的药物复合体系,该体系可以在体温传导作用下实现溶胶-凝胶转变,从而封闭创面。
(2)该体系可以缓释包载的P311,延长P311作用时间,充分发挥温敏水凝胶和微球的“综合效应”,彰显“1+1>2”的优势。