
探讨人脐静脉内皮细胞(HUVEC)外泌体对糖尿病兔创面愈合的作用及其机制。
采用实验研究方法。取中南大学湘雅三医院2019年6月收治的2例糖尿病溃疡患者(男49岁、女58岁)手术切除溃疡周边皮肤组织,提取原代血管内皮细胞(VEC)和人皮肤成纤维细胞(HSF),通过形态观察和流式细胞术成功鉴定。采用超速离心法提取HUVEC外泌体,通过形态观察、粒径检测和蛋白质印迹法检测成功鉴定。取20只3个月龄雌性新西兰兔,背部两侧分别制作1个2型糖尿病全层皮肤缺损创面,将创面分成外泌体组和磷酸盐缓冲液(PBS)组并进行相应处理,每组20个创面,观察创面组织完全覆盖时间。伤后14 d,行苏木精-伊红染色或Masson染色,观察血管生成或胶原纤维增生情况(样本数为20)。观察VEC和HSF与HUVEC外泌体共培养24 h对HUVEC外泌体的摄取情况。将VEC与HSF均分成采用HUVEC外泌体或PBS处理的外泌体组和PBS组,采用细胞计数试剂盒8检测培养4 d细胞增殖情况,采用划痕试验检测并计算划痕后24、48 h细胞迁移率,采用Transwell实验检测培养24 h细胞迁移数,采用实时荧光定量反转录PCR法检测核因子红细胞系2相关因子2(NRF2)、转录激活因子3(ATF3)的mRNA表达,行成管实验观测VEC培养12 h血管分支点数和成管长度(样本数均为3)。取VEC及HSF,分成同前处理的PBS组、外泌体组和采用相应基因干扰的NRF2干扰组、ATF3干扰组、空载干扰组,同前检测2种细胞增殖、迁移和VEC的血管形成(样本数均为3)。对数据行重复测量方差分析、单因素方差分析、独立样本t检验及LSD检验。
外泌体组创面组织完全覆盖时间为(17.9±1.9)d,明显短于PBS组的(25.2±2.3)d,t=4.54,P<0.05。伤后14 d,PBS组创面血管密度明显低于外泌体组(t=10.12,P<0.01),胶原纤维生成少于外泌体组。培养24 h,HUVEC外泌体成功被VEC和HSF摄取。培养4 d,外泌体组HSF和VEC增殖活力均明显强于PBS组(t值分别为54.73、7.05,P<0.01)。划痕后24、48 h,外泌体组HSF迁移率(t值分别为3.42、11.87,P<0.05或P<0.01)和VEC迁移率(t值分别为21.42、5.49,P<0.05或P<0.01)均明显高于PBS组。培养24 h,外泌体组VEC、HSF迁移数均明显多于PBS组(t值分别为12.31、16.78,P<0.01)。培养12 h,外泌体组HSF和VEC中NRF2的mRNA表达均明显高于PBS组(t值分别为7.52、5.78,P<0.05或P<0.01),ATF3的mRNA表达均明显低于PBS组(t值分别为13.44、8.99,P<0.01)。培养12 h,外泌体组VEC血管分支点数明显多于PBS组(t=17.60,P<0.01),成管长度明显长于PBS组(t=77.30,P<0.01)。培养4 d,NRF2干扰组HSF和VEC增殖活力均较PBS组和外泌体组显著降低(P<0.05或P<0.01);ATF3干扰组HSF和VEC增殖活力均较PBS组显著增加(P<0.05或P<0.01),均较外泌体组显著降低(P<0.05或P<0.01)。划痕后24、48 h,ATF3干扰组HSF和VEC的迁移率均较PBS组显著增加(P<0.05或P<0.01),均较外泌体组显著降低(P<0.05或P<0.01)。划痕后24、48 h,NRF2干扰组HSF和VEC的迁移率均较PBS组和外泌体组显著降低(P<0.05或P<0.01)。培养24 h,ATF3干扰组VEC和HSF的迁移数均明显多于PBS组(P<0.05),均明显少于外泌体组(P<0.05或P<0.01);NRF2干扰组VEC和HSF的迁移数均明显少于PBS组和外泌体组(P<0.01)。培养12 h,NRF2干扰组VEC血管长度、分支点数均较PBS组和外泌体组明显减少(P<0.01);ATF3干扰组VEC血管长度、分支点数均较PBS组明显增加(P<0.01),均较外泌体组明显减少(P<0.01)。
HUVEC外泌体通过促进VEC和HSF的增殖、迁移,从而促进糖尿病兔创面愈合,而NRF2 和 ATF3 在这个过程中明显受到外泌体的影响,是外泌体作用的可能靶点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性难愈合创面在世界范围内的发生率逐年升高,目前其修复仍是待攻克的难题[1, 2],因而十分有必要进一步研究慢性难愈合创面的发生机制及安全有效的修复方法。外泌体是大小为40~150 nm 的膜结合细胞外囊泡,含有复杂的RNA、DNA和蛋白质,参与机体的免疫反应、抗原呈递、细胞迁移、细胞分化和肿瘤侵袭[3]。近年来,外泌体在创伤修复中的作用逐渐被观察到,已证实来自胚胎干细胞[4]、间充质干细胞[5, 6]和脂肪干细胞[7]的外泌体对创面愈合具有积极作用。目前的研究热点集中在寻找新的载体,使这些外泌体可以在体内更好地发挥作用[8, 9]。外泌体已被证明在创面修复中具有改善血供、促进血管生成和凝血因子分泌等重要作用[10]。外泌体还通过直接与血管内皮细胞(VEC)接触,促进创面与机体其他器官组织间的信号交换[11];这些外泌体还可进入VEC,使其胞内基因、转录因子、蛋白表达等发生变化[12]。此外,外泌体还分泌许多在创面愈合中起重要作用的细胞因子[13]。
核转录因子红系2相关因子2(NRF2)是一种诱导型转录因子,可以调节机体氧化防御系统并抵御亲电子剂的侵袭,能够增强细胞对氧化应激的抵抗[14, 15],也参与了其他细胞过程,如自噬、中间代谢、干细胞静止和未折叠蛋白反应[16],在细胞增殖和分化中发挥重要作用[17]。转录激活因子3(ATF3)基因被证实在人和多种实验动物中通过抑制多种细胞因子的表达来减轻创面炎症反应[18, 19]。然而,关于ATF3作用的机制研究非常有限。
研究证实,局部注射人脐带血来源的外泌体可通过促进VEC和人皮肤Fb(HSF)功能,促进慢性创面患者创面愈合[20]。人脐带血是外泌体较好的来源,但人脐带血来源有限,限制了其临床应用。在脐带血中找到能够获取外泌体的来源细胞,可以有效解决脐带血来源不足的难题。脐带血中的外泌体可能来源于很多细胞,其中人脐静脉内皮细胞(HUVEC)是外泌体的重要来源之一,在创伤修复中具有良好的作用。因此本研究以HUVEC外泌体为研究对象,验证NRF2和ATF3在糖尿病创面中的表达是否受到该外泌体的调控及其可能的机制,寻找针对糖尿病创面新的可能治疗靶点。
本实验涉及人体组织的研究经中南大学湘雅三医院伦理委员会审批,批号:2019rtsy0299,且经过患者知情同意;动物实验均通过中南大学湘雅医学院动物实验伦理委员会审批,批号:2019sydw0162。
HUVEC及人胚肾细胞293均购于中南大学湘雅细胞库。10只雄性、10只雌性健康无特殊病原体级3个月龄新西兰兔,体重为1 322~1 664 g(平均1 521 g)购买并寄养于中南大学动物实验中心,许可证号:SYXK(湘)2020-0019。DMEM培养基购自美国Gibco公司,兔源性 CD63多克隆抗体、人肿瘤易感基因101(TSG101)重组单克隆抗体、钙连蛋白重组单克隆抗体及异硫氰酸荧光素(FITC)标记的兔源性CD34、CD133、VEGF受体 2(VEGFR2)多克隆抗体、铁死亡抑制蛋白 1(FSP1)重组单克隆抗体、细胞角蛋白19(CK19)重组单克隆抗体、波形蛋白重组单克隆抗体与辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体均购自杭州华安生物技术有限公司,细胞计数试剂盒8(CCK-8)试剂盒购自日本同仁公司,总RNA抽提试剂TRIzol购自美国Invitrogen公司。INSPECT F50型电子显微镜购自美国FEI公司,Zetasizer Nano ZS型纳米粒度电位分析仪购自英国Malvern公司,CX23型光学显微镜、BX43型倒置荧光显微镜均购自日本Olympus公司。
取中南大学湘雅三医院烧伤整形外科2019年6月收治的2例糖尿病溃疡患者(男性患者49岁、女性患者58岁)手术切除溃疡周边皮肤组织,参照文献[21, 22],使用动态胰蛋白酶消化法提取原代VEC,使用Ⅳ型胶原酶分解法提取原代HSF。取2种细胞,于400倍光学显微镜下观察形状,采用流式细胞仪检测VEC和HSF表面特异性蛋白的表达,加入的抗体分别为FITC标记的兔源性CD34、CD133、VEGFR2多克隆抗体(稀释比均为1∶200)及兔源性FSP1重组单克隆抗体、CK19重组单克隆抗体、波形蛋白重组单克隆抗体(稀释比均为1∶200)。原代细胞经鉴定后进行常规培养,待生长至90%左右融合时传代,取第3代细胞进行后续实验。
取HUVEC,在含体积分数10%胎牛血清的DMEM培养基(以下称完全培养基)中培养,待细胞生长达80%融合时,用不含外泌体的完全培养基培养过夜。收集上清液,用超速离心法提取外泌体,用直径0.22 μm过滤筛过滤后进一步以超速离心法提取外泌体[23]。于100 000倍电子显微镜下观察形态和大小,粒度分析检测其粒径。另采用蛋白质印迹法检测人胚肾细胞293和HUVEC外泌体中CD63、TSG101、钙连蛋白的表达,一抗分别为兔源性CD63多克隆抗体、TSG101重组单克隆抗体、钙连蛋白重组单克隆抗体(稀释比均为1∶300),二抗为HRP标记的羊抗兔IgG抗体(稀释比1∶2 000)。
取20只新西兰兔,用高脂高糖饲料喂养10 d,按40 mg/kg耳缘静脉注射20 mg/mL链脲佐菌素,每天2次,共10 d,建立2型糖尿病兔模型,以连续3次空腹血糖≥11.0 mmol/L为造模成功[24]。通过耳缘静脉注射40 g/L戊巴比妥钠(1 mL/kg)麻醉所有兔,在背部两侧各建立1个直径2 cm的圆形全层皮肤缺损创面[25]。将每只兔的2个创面分别纳入外泌体组和PBS组,每组20个创面。伤后即刻,分别在创面周围皮下注射1 mL质量浓度20 μg/mL HUVEC外泌体和1 mL PBS,观察伤后0(即刻)、3、7、14、30 d创面愈合情况并统计组织完全覆盖时间。
伤后14 d,观察创面愈合情况后,取3只兔,按4 mL/kg耳静脉注射40 g/L戊巴比妥钠麻醉后处死,取创面组织,常规制作切片,行HE染色或 Masson染色,分别在200倍光学显微镜下观察血管生成或胶原纤维增生情况。使用Image-Pro Plus 6.0软件标记血管结构并计数每个视野新生血管数量。
将VEC与HSF按每孔1×105个接种于12孔板中,培养24 h,加入50 μg用细胞膜染色试剂盒PKH67标记的HUVEC外泌体,常规培养过夜。加入5 μg/mL的鬼笔环肽染色液至覆盖所有细胞,室温下孵育1 h。加入4',6-二脒基-2-苯基吲哚(DAPI)染色液,在200倍倒置荧光显微镜下观察2种细胞摄取HUVEC外泌体情况[26]。
分别将VEC与HSF按每孔2×103个接种到96孔板中,分成外泌体组和PBS组,每组3孔。外泌体组细胞加入20 μg溶于100 µL PBS中的HUVEC外泌体,PBS组细胞加入100 µL PBS。培养4 d,采用CCK-8法及酶标仪检测450 nm处的吸光度值,以此表示细胞增殖活力。
分别将VEC与HSF按每孔2×105个接种到12孔板,每组3孔,培养至细胞铺满培养皿80%左右。用规格为1 mL的移液器枪头尖端刮擦单层细胞并用PBS清洗。每孔加入完全培养基1 mL,同1.7进行分组及处理。划痕后0、24、48 h在200倍光学显微镜下观察2种细胞划痕愈合情况并计算划痕后24、48 h细胞迁移率。细胞迁移率=(划痕后0 h划痕面积-划痕后其他时间点划痕面积)÷划痕后0 h划痕面积×100%。
将Transwell小室置于每孔含600 μL完全培养基的24孔板中。用不含胎牛血清的DMEM培养基悬浮VEC与HSF,并接种到Transwell小室中,每孔1×104个细胞,同1.7进行分组及处理。培养24 h后,行结晶紫染色。于200倍光学显微镜下任意选3个视野观察细胞迁移情况,用Image-Pro Plus 6.0软件进行分析。
将基质胶铺在96孔板中,37 ℃下孵育30 min。待基质胶凝固后,将2×104个VEC用200 µL完全培养基悬浮后接种于96孔板中,同1.7分组及处理。常规培养12 h后,于400倍光学显微镜下观察血管形成情况并通过Image-Pro Plus 6.0软件计数3个视野内血管分支点数和成管长度,成管长度以像素点数(px)表示。
将VEC和HSF接种到6孔板中,每孔1×105个细胞,同1.7分组及处理12 h。采用实时荧光定量RT-PCR法检测NRF2及ATF3的mRNA表达,所有引物均由广州锐博生物科技公司合成。NRF2上游引物:5'-AGGTTGCCCACATTCCCAAA-3',下游引物:5'-ACGTAGCCGAAAAAACCTCA-3';ATF3上游引物:5'-CGGAGCCTGGAGCAAAATGA-3',ATF3下游引物:5'-GGAGGGCAAACCTCAGCTCT-3',大小均为20 bp。β肌动蛋白上游引物:5'-TTGTTACAGGAAGTCCCTTGCC-3',下游引物:5'-ATGCTATCACCTCCCCTGTGTG-3',产物大小为120 bp。以β肌动蛋白为内参照,采用Δ循环阈值(Ct)法处理结果,即2-ΔΔCt。
取VEC及HSF,按每孔2×105个接种到12孔板中,用广州锐搏生物科技公司合成的3种NRF2的小干扰RNA(siRNA)敲降 NRF2 mRNA的表达,用3种ATF3 siRNA敲降ATF3 mRNA的表达,同1.10采用实时荧光定量RT-PCR法检测上述siRNA的敲低效率,分别筛选出2种敲低效率较高的ATF3 siRNA和NRF2 siRNA。siNRF2-1:5'-GGTTGAGACTACCATGGTT-3',siNRF2-2:5'-GCCCATTGATGTTTCTGAT-3',siNRF2-3:5'-GCCTGTAAGTCCTGGTCAT-3';siATF3-1:5'-TCAAGGAAGAGCTGAGGTT-3',siATF3-2:5'-GGAAAGTGTGAATGCTGAA-3',siATF3-3:5'-TCATCGGCCCACGTGTATT-3'。另取VEC及HSF,同前接种到12孔板中,均分成PBS组、外泌体组、NRF2干扰组、ATF3干扰组、空载干扰组,每组3孔。PBS组、外泌体组细胞同1.7相应组别处理,NRF2干扰组细胞转染筛选出的siNRF2-1、siNRF2-3,ATF3干扰组细胞转染筛选出的siATF3-1、siATF3-2,空载干扰组细胞转染无序混合siRNA。同1.7~1.9检测2种细胞增殖、迁移和VEC的血管形成。
采用SPSS 25.0统计软件进行分析。计量资料数据均符合正态分布,以表示。多个时间点组间总体比较行重复测量方差分析,多组间单一时间总体比较行单因素方差分析。2组间比较行独立样本t检验,多组间两两比较行LSD检验(软件自动略去该统计量值)。P<0.05为差异有统计学意义。
VEC胞体肥厚、形态单一,呈菱形或多角形,偶有足突,胞核椭圆居中,符合内皮细胞基本形态;可见高表达CD34、CD133、VEGFR2,鉴定为VEC。HSF呈纺锤形或者多角形扁平状,具有突起,细胞体积较大,符合Fb形态;高表达波形蛋白、FSP1、CK19,鉴定为HSF。见图1。

外泌体颗粒的微观形态为囊状或球形;颗粒直径为70~100 nm;相较于人胚肾细胞293来源的外泌体,HUVEC来源的外泌体颗粒高表达CD63和TSG101、低表达钙连蛋白,鉴定为HUVEC外泌体。见图2。
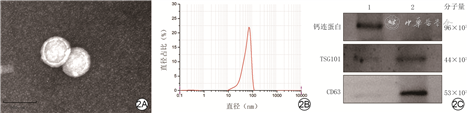

注:图2C为横坐标经过lg处理的数据形成的描记图,该图上方1、2分别为人胚肾细胞293与HUVEC来源外泌体;TSG101为肿瘤易感基因101
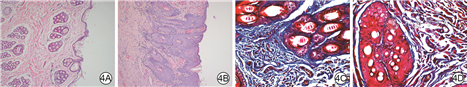
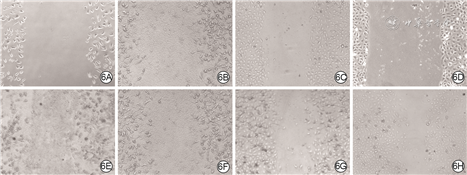
伤后30 d内,外泌体组创面较PBS组愈合快。外泌体组创面完全覆盖时间为(17.9±1.9)d,明显短于PBS组的(25.2±2.3)d,t=4.54,P<0.05。伤后14 d,PBS组创面血管密度为每200倍视野下6.9±1.4,明显低于外泌体组的每200倍视野下11.3±0.8,t=10.12,P<0.01;外泌体组较PBS组创面有更多胶原纤维。见图3、4。



培养24 h,HUVEC外泌体成功被VEC和HSF摄取。见图5。

培养4 d,外泌体组HSF和VEC增殖活力分别为1.204±0.005、1.299±0.003,均明显强于PBS组的0.905±0.006、1.051±0.050(t值分别为54.73、7.05,P<0.01)。
划痕后24、48 h,外泌体组HSF迁移率均明显高于PBS组(t值分别为3.42、11.87,P<0.05或P<0.01),外泌体组VEC迁移率均明显高于PBS组(t值分别为21.42、5.49,P<0.05或P<0.01)。见图6、表1。

2组VEC和HSF划痕后各时间点迁移率比较(%,)
2组VEC和HSF划痕后各时间点迁移率比较(%,)
| 组别 | 样本数 | HSF | VEC | ||
|---|---|---|---|---|---|
| 24 h | 48 h | 24 h | 48 h | ||
| 外泌体组 | 3 | 42.1±1.3a | 72.2±0.9b | 48.2±1.6b | 87.1±2.3b |
| PBS组 | 3 | 26.1±1.3 | 44.2±1.0 | 30.1±1.6 | 63.2±1.5 |
注:人皮肤成纤维细胞(HSF)时间因素主效应,F=33.20,P=0.020;处理因素主效应,F=134.80,P=0.012;两者交互作用,F=95.10,P=0.021;血管内皮细胞(VEC)时间因素主效应,F=37.10,P=0.010;处理因素主效应,F=191.70,P=0.007;两者交互作用,F=45.10,P=0.009;与磷酸盐缓冲液(PBS)组比较,aP<0.05,bP<0.01
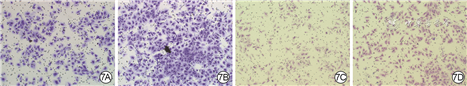
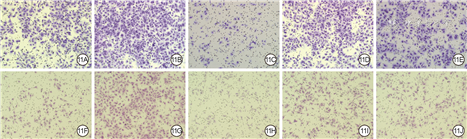
培养24 h,外泌体组VEC、HSF迁移数分别为(323±12)、(241±10)个,均明显多于PBS组的(207±19)、(144±19)个(t值分别为12.31、16.78,P<0.01),见图7。

培养12 h,外泌体组VEC血管分支点数明显多于PBS组(t=17.60,P<0.01),成管长度明显长于PBS组(t=77.30,P<0.01)。见图8。
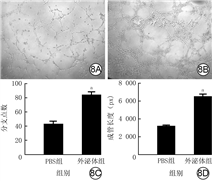

注:与PBS组比较,aP<0.01
培养12 h,外泌体组HSF和VEC中NRF2的mRNA表达均明显高于PBS组(t值分别为7.52、5.78,P<0.05或P<0.01),ATF3的mRNA表达均明显低于PBS组(t值分别为13.44、8.99,P<0.01)。见图9。
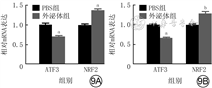

注:与磷酸盐缓冲液(PBS)组比较,aP<0.01,bP<0.05
培养4 d,NRF2干扰组HSF和VEC增殖活力均较PBS组和外泌体组显著降低(P<0.05或P<0.01);ATF3干扰组HSF和VEC增殖活力均较PBS组显著增加(P<0.05或P<0.01),均较外泌体组显著降低(P<0.05或P<0.01)。见表2。
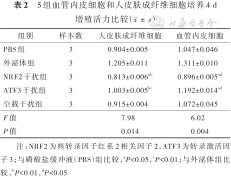
5组血管内皮细胞和人皮肤成纤维细胞培养4 d增殖活力比较()
5组血管内皮细胞和人皮肤成纤维细胞培养4 d增殖活力比较()
| 组别 | 样本数 | 人皮肤成纤维细胞 | 血管内皮细胞 |
|---|---|---|---|
| PBS组 | 3 | 0.904±0.005 | 1.047±0.046 |
| 外泌体组 | 3 | 1.205±0.011 | 1.311±0.010 |
| NRF2干扰组 | 3 | 0.813±0.006ab | 0.896±0.005ad |
| ATF3干扰组 | 3 | 1.003±0.005bc | 1.192±0.014ad |
| 空载干扰组 | 3 | 0.915±0.004 | 1.072±0.045 |
| F值 | 7.98 | 6.02 | |
| P值 | 0.014 | 0.004 |
注:NRF2为核转录因子红系2相关因子2,ATF3为转录激活因子3;与磷酸盐缓冲液(PBS)组比较,aP<0.05,cP<0.01;与外泌体组比较,bP<0.01,dP<0.05
划痕后24、48 h,ATF3干扰组HSF和VEC迁移率均较PBS组显著增加(P<0.05或P<0.01),均较外泌体组显著降低(P<0.05或P<0.01)。划痕后24、48 h,NRF2干扰组HSF和VEC迁移率均较PBS组和外泌体组显著降低(P<0.05或P<0.01)。见表3及图10。培养24 h,ATF3干扰组VEC和HSF迁移数均明显多于PBS组(P<0.05),均明显少于外泌体组(P<0.05或P<0.01)。NRF2干扰组VEC和HSF迁移数均明显少于PBS组和外泌体组(P<0.01)。见图11、12。
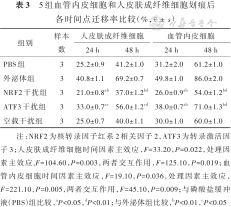
5组血管内皮细胞和人皮肤成纤维细胞划痕后各时间点迁移率比较(%,)
5组血管内皮细胞和人皮肤成纤维细胞划痕后各时间点迁移率比较(%,)
| 组别 | 样本数 | 人皮肤成纤维细胞 | 血管内皮细胞 | ||
|---|---|---|---|---|---|
| 24 h | 48 h | 24 h | 48 h | ||
| PBS组 | 3 | 25.2±0.9 | 41.2±1.0 | 31.2±2.0 | 61.2±1.0 |
| 外泌体组 | 3 | 40.8±1.1 | 69.2±0.7 | 49.8±1.0 | 86.0±2.0 |
| NRF2干扰组 | 3 | 21.0±0.8ab | 37.0±1.2bd | 26.0±0.9ab | 54.0±1.2bd |
| ATF3干扰组 | 3 | 33.0±0.7ac | 56.0±1.2cd | 38.0±0.7ab | 71.0±1.3bd |
| 空载干扰组 | 3 | 25.0±0.7 | 40.0±1.1 | 30.0±1.0 | 60.0±1.0 |
注:NRF2为核转录因子红系2相关因子2,ATF3为转录激活因子3;人皮肤成纤维细胞时间因素主效应,F=33.20,P=0.022,处理因素主效应,F=104.60,P=0.003,两者交互作用,F=125.10,P=0.019;血管内皮细胞时间因素主效应,F=19.10,P=0.036,处理因素主效应,F=221.10,P=0.005,两者交互作用,F=45.10,P=0.009;与磷酸盐缓冲液(PBS)组比较,aP<0.05,dP<0.01;与外泌体组比较,bP<0.01,cP<0.05





注:横坐标下1、2、3、4、5分别代表磷酸盐缓冲液(PBS)组、外泌体组、核转录因子红系2相关因子2(NRF2)干扰组、转录激活因子3(ATF3)干扰组、空载干扰组;5组血管内皮细胞(VEC)和人皮肤成纤维细胞(HSF)总体比较,差异均明显(F值分别为11.43、21.10,P值分别为0.008、<0.001);与PBS组比较,aP<0.01,cP<0.05;与外泌体组比较,bP<0.01,dP<0.05
培养12 h,NRF2干扰组VEC血管长度、分支点数均较PBS组和外泌体组明显减少(P<0.01);ATF3干扰组VEC血管长度、分支点数均较PBS组明显增加(P<0.01),均较外泌体组明显减少(P<0.01)。见图13、14。


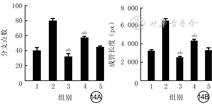

注:横坐标下1、2、3、4、5分别代表磷酸盐缓冲液(PBS)组、外泌体组、核转录因子红系2相关因子2干扰组、转录激活因子3 干扰组、空载干扰组;5组血管分支点数和成管长度总体比较差异均明显(F值分别为7.51、9.12,P值分别为0.011、0.005);与PBS组比较,aP<0.01,与外泌体组比较,bP<0.01
外泌体是许多细胞释放的关键旁分泌介质,在创面修复方面,各种来源的外泌体发挥着重要作用,但是因为来源及价格等因素,将外泌体应用于临床创伤修复受到较多限制。因此,寻找特异性外泌体,对于外泌体成为临床药物具有重要意义。HUVEC 作为廉价易得的外泌体来源,其外泌体也被证实具有较好的促进糖尿病创面修复的功效,在糖尿病创面修复方面具有巨大潜力。
本研究首先通过超速离心法提取HUVEC外泌体并纯化后,通过电子显微镜观察、粒径分析及蛋白验证等步骤进行验证。然后观测HUVEC外泌体对糖尿病兔创面修复所需时间及创面血管生成、纤维增生等的影响,证实该外泌体具有促进糖尿病创面愈合的作用。再通过免疫荧光染色证实HUVEC外泌体可进入VEC和HSF发挥作用。CCK-8实验结果证实HUVEC外泌体可促进HSF与VEC的增殖,划痕试验和Transwell实验结果证实HUVEC外泌体可促进HSF与VEC的迁移。成管实验证实HUVEC外泌体对VEC成管能力有明显促进作用。
以往的实验表明,人羊膜上皮细胞可以通过旁分泌作用促进糖尿病创面愈合,其机制就与外泌体有关[27, 28]。NRF2是一种重要的促癌基因,在多种肿瘤中发挥作用[29],并在创面愈合中表现出多种功能,如调节细胞迁移、血管生成和细胞增殖[30]。ATF3不仅是重要的抑癌基因[31],还通过调节创面炎症反应参与创面愈合。本研究通过检测2种细胞中NRF2和ATF3的mRNA表达,证实NRF2和ATF3可能是外泌体的作用靶点。因此进一步敲低NRF2和ATF3的基因表达,验证2种细胞的增殖、迁移及VEC的成管能力的改变,结果证实在外泌体的作用下,VEC和HSF的功能变化主要受NRF2上调和ATF3下调的影响。这些实验结果证实了HUVEC外泌体促进糖尿病创面愈合的作用,为未来相应的药物开发提供了较好的理论基础。
综上所述,HUVEC外泌体通过调节VEC和HSF的增殖、迁移等,从而促进糖尿病兔创面的愈合,而NRF2和ATF3 在这个过程中明显受到外泌体的影响,是外泌体作用的可能靶点。HUVEC外泌体显示出良好的临床应用潜力,且HUVEC比脐静脉血更便宜且易于获得,这为低价获得足够外泌体并将其用于临床提供了较好的基础。
所有作者均声明不存在利益冲突




























(1)通过动物实验、细胞实验及分子实验证实,人脐静脉内皮细胞(HUVEC)外泌体通过调节内皮细胞及Fb的功能,从而促进兔糖尿病创面愈合。
(2)证实核因子红细胞系2相关因子2、转录激活因子3是HUVEC外泌体的可能靶基因,为寻找糖尿病创面修复的靶点提供了新思路,也为后续该外泌体的临床应用提供了理论基础。