
遗传检测的结果对受检者当前及未来的健康管理均有一定的指导意义。特别是在目前临床全基因组/全外显子组测序技术已经迅速应用到临床实践的形势下,这些全面的基因检测方法不仅能够检测到与临床指征相关的变异,还可能会有次要发现和意外发现,包括可指导生育的严重隐性遗传病携带者信息、疾病易感性或预测性信息、对于临床应用有价值的祖先来源信息以及尚无临床症状的诊断信息。鉴于遗传信息的本质,基因检测的结果往往对受检者的亲属也有重要的意义。因此,医疗工作者在开具临床遗传检测单前,需对受检者提供检测前遗传咨询服务,讨论要点包括遗传检测的利弊、检测目的、可能的结果及其对受检者和亲属的意义、隐私和法律方面的影响,并充分解答受检方的疑问,这是遗传检测的重要一环,并且只有在取得受检者的知情同意后方可送检。基于这些情况,美国医学遗传专家委员会提出了参考要点,并建议临床医生对实施检测的原因以及当时所遵循的指南做好记录,以便在未来针对相关的医学症状和变异信息采用更新的知识或者指南进行进一步的解读。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
基因检测是指对个人的DNA进行分析,以寻找能够解释疾病发生的基因变异。与普通的临床检验不同的是,首先,除相对罕见的体细胞基因变异外,基因检测的结果基本上终身不变。其次,基因检测的结果在多数情况下不仅对受检者本人有意义,对其亲属也有价值。因此,基因检测的结果与个人隐私密切相关,并对个人和家庭具有长期的影响。此外,无论是儿童还是成人接受检查,尤其是用大规模高通量方式进行检测,均有可能检测到次要发现和意外发现[1]。次要发现是指与送检指征无关的检测结果,但由于能提示干预或者减轻病情的治疗措施,对患者可能有利。例如,按美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)推荐的次要发现基因列表找到的基因突变[2,3]。意外发现则是指基因检测中非主动寻找的发现,但意外揭示的信息,比如意外的亲子关系或与送检指征无关的携带者状态[1]。鉴于遗传检测的复杂性及其涉及敏感的隐私问题,临床基因检测前的遗传咨询是必不可少的[4]。遗传咨询的目标是提高受检者有效使用遗传信息的能力,以最大限度地减少心理困扰,提高个人自主能力,从而促进知情决策。遗传咨询中讨论的信息经常会对其家庭成员产生影响,可能会影响其家庭关系。遗传咨询的过程可能涉及多个阶段,包括与受检者临床前的接触、临床咨询、随访和复查、以及记录保存、文献和数据库搜索。基因检测方式有很多种,例如染色体微阵列芯片、靶向基因测序、全外显子组或全基因组测序等。咨询师应根据受检者的个人和家族史,选择哪种测试最适合作为遗传咨询过程的一部分,告知受检者所需样品的性质、测试的适宜性、测试的利弊以及可能的结果及影响。受检者在完全了解测试过程的所有方面后,必须签署适当的知情同意书,并视情况加以见证。由于临床全外显子组或全基因组测序(Clinical Genome and Exome Sequencing,CGES)是目前最复杂全面的基因检测手段,本文以此为重点介绍基因检测前遗传咨询的要点,但基本原则普遍适用于其他遗传检测方法。
医疗工作者在获得受检者在知情同意书上的签字后,才可以递交送检单。在实施临床遗传检测前,待检者需要得到遗传咨询服务,从而充分地了解情况,作出知情决策。检测前遗传咨询的内容包括下列要点:(1)告知检测的目的;(2)告知检测项目所涉及的范围;(3)告知检测技术的基本原理、优势、风险和局限性。若有多种检测方式,则应客观比较各种方法,陈述利弊,让受检者根据需要做出选择;(4)告知预期的各种结果及其意义,如阳性、阴性、不确定结果;(5)告知可能发现的变异的类型及其意义,例如致病、意义未明、良性等;(6)告知次要发现和意外发现的定义和可能的发现及其临床意义,并征求待检者的意愿,让其独立决定是否要求知晓次要发现或意外发现;(7)告知何人能够知晓受检者的基因信息;(8)告知基因信息可能对其亲属的影响;(9)告知检测结果按新知识重新分析的约定;(10)告知相关法律权限,例如美国1996年颁布的健康保险便利和责任法案(Health Insurance Portability and Accountability Act,HIPAA)和2008年颁布的反基因歧视法案(the Genetic Information Nondiscrimination Act,GINA);(11)告知有作为研究对象参与科研的机会。若受检者选择参与科研项目,则需要根据经机构委员会批准的科研协议另外取得其知情同意,内容已超出本文的范畴,不再展开。
一般情况下不建议对未成年人进行基因检测,可以等到其成年后自主决定是否再做检测。但基因检测仍能用于筛查或诊断能有效进行早期监控或干预的儿童遗传病。未成年人基因检测前的遗传咨询有别于成人的是:(1)咨询对象为未成年人的家长;(2)不使其知晓与成年发病风险相关或隐性基因携带者状态的次要发现或意外发现。
在检测前,咨询师需首先评估受检者的个人和家族病史,根据这些情况确定进行何种基因检测最为有用。同时可以发现从基因检测中获益的有发病风险的亲属。这种个人和家族病史的评估不能被遗传检测取代。例如,对于马凡综合征,一种能够引起软骨、骨骼和心血管疾病的结缔组织病,若对表型符合该综合征的患者进行FBN1基因的测序,即使得到阴性的结果,该患者仍会因其临床表现被诊断为马凡综合征。评估家族史的步骤包括:(1)了解所有一级直系亲属(父母、兄弟姐妹和子女)的健康状态;(2)了解所有二级亲属(祖父母、外祖父母、父母的兄弟姐妹、兄弟姐妹的子女)的健康状态;(3)了解相关的三级亲属的健康状态;(4)记录每个家庭成员的性别、目前的年龄或死亡时的年龄、患病状态、发病年龄以及临床症状,以及已有的基因检测结果;(5)父母的种族;(6)是否存在近亲婚配;(7)记录获得家庭健康资料的时间。
在了解检测需求、个人病史和家族史后,咨询师可建议检测项目,以及需要最先检测哪位家庭成员,检测什么样本,是否需要父母的样本。之后用通俗易懂的语言介绍相关的知识,包括遗传学基础知识、什么是遗传检测、检测的目的是什么、采用何种检测技术、如何进行、检测周期有多久、有无其他选择、各有何利弊等,并给待受检者足够的时间提出其关心的问题,而且予以一一解答。
在咨询过程中,需意识到文化或种族敏感的问题,提供做基因检测决定的支持信息,讨论遗传检测的益处、风险和局限性(表1)。例如,基于普通的高通量二代测序的检测能够可靠地测出序列水平的变异,但对于一些大片段的缺失/重复、染色体易位、甲基化异常、碱基重复或其他动态突变则无法检测到。

基因检测的益处、风险和局限性
基因检测的益处、风险和局限性
| 可能的益处 | 可能的局限性/风险 |
|---|---|
| 确定病因 | 获得意义未明的变异和意外的结果,加大解读难度 |
| 对发病风险提供更为精确的评估 | 可能存在假阳性或者临床意义未知的变异可能存在假阴性,因为(1)不能发现所有可能的基因变异;(2)当前检测可能未捕捉到致病变异,所以即使阴性报告也不一定相关基因不存在致病变异。 |
| 能够识别可能增加风险的亲属 | 若是预测性检测,可能受外显率不全的影响,不是所有带有致病基因变异的个体都会得病 |
| 为生育决定做指导 | 可能增加焦虑,增加责备,负罪感,成为家庭的秘密 |
| 带着致病变异携带者或遗传病高风险者的标签,可能增加不必要关注和歧视。 |
受检方通常希望了解有关检测的以下信息:(1)准确性和可重复性;(2)医学价值:这些基因检测结果与已知的疾病或风险因子是否有直接的相关性,是否有较为权威的认定。在这方面,基因检测的提供者有责任确保所提供的检测是基于临床研究证据的。然而,在现实中,基因检测技术的飞速发展,某些基因与疾病的相关性还缺乏足够的文献支持。因此,有些检测到的基因变异只能作为试验性或临床观察的部分,分析解读这类数据的难度和周期都会更长。在这种情况下,咨询师的解释在测试者进行决定时起着关键性的作用;(3)是否有益:对此的衡量是基于基因检测的经济负担和预计的检测结果对受检者生活的改善。尽管得益多少通常无法简单地估算出,但咨询师应尽量详尽地提供相关信息供受检者判断。
在讨论过上述所有要点并解答了待受检者的所有疑问之后,若其仍愿意接受检测,则签署知情同意书。之后医师可填写送检单,并根据检测需要的时间,预约安排检测后告知结果的遗传咨询。
CGES检测是迄今为止最为全面和复杂的基因检测项目,除遵循上述普通基因检测前咨询的常规内容外,还有一些需要特别注意的地方。我们在此将重点介绍CGES检测前遗传咨询的特点:(1)CGES检测的方法较为复杂,会产生大量的数据。需告知受检者获得原始数据的权利。告知受检者对数据的所有权和索取的方法;(2)CGES检测的价格相对昂贵,是否在其医疗保险范围内,受检方需自费支付多少。有时需要向保险公司出具检测必要性的说明信。在这种情况下,检测前咨询可能不止一次;(3)CGES检测周期比普通检测相对更长,需向受检方说明预期的时间;(4)检测结果可能为阳性(找到能够解释症状的致病变异)、阴性(未找到任何与症状相关的可能有临床意义的变异)和不确定(找到和症状相关的可能有临床意义的变异,但不足以解释症状)。之后给出针对各种可能性可以采取的后续措施。若结果为阳性,可能有针对性治疗方法,也可能目前尚无法治疗,但仍对亲属有提示作用。若结果为阴性,则可以排除一些疾病,但要意识到检测方法的局限性,可能进一步实施其他检测计划。若结果为不确定,可以在亲属中进行共分离分析,或用受检者本人的其他临床指标对临床意义不明的变异进一步解读,或用互补性的检测方法弥补CGES的局限性;(5)提供进行和不进行CGES的两套临床疾病管理的建议方案,供受检方选择;(6)告知样本的保存和个人隐私的保护;(7)告知可能产生哪些意外发现或次要发现,并征求受检者的意愿,选择知晓哪些;(8)告知检测结果对于亲属的意义,包括有血缘关系的亲属和揭示非亲生关系的可能;(9)检测后的咨询时间和后续跟踪计划,包括检测结果重新分析更新的约定。
美国临床遗传学智库(Clinical Genetics Think Tank,CGTT)2016年在《Genetics in Medicine》杂志上发表了对于临床进行基因组检测实践的建议,基于前期的规则给予了更多的修正,主要探讨了以下问题[5]。
在美国,只有符合授权资格的医疗工作者才能为患者开具送检单。但对于CGES检测,ACMG指南中已经明确指出,送检的医疗工者必须具备相关的遗传学专业知识和检测前的评估和解释能力。这些最基本的能力包括:(1)能够有效地进行临床遗传学评估,包括了解家族史、甄别遗传相关的临床表型、体格检查,并进行初步鉴别诊断;(2)能够判断CGES检测对于当前的临床指征的必要性,考虑其他检测(如代谢物检测、影像检测等)的可行性和可替代性,同时评估受检者的年龄和认知水平;(3)能够提供恰当的检测前咨询;(4)能够解读CGES的结果,并提供恰当的检测后咨询或者召集相关遗传学专家进行多学科会诊。
是否送检CGES将取决于受检者的临床需求(图1)。(1)若受检者的临床症状与特定的已知遗传病表型高度相符,应优先考虑采用灵敏度和特异性更高且相对经济的单基因检测或靶向捕获基因包检测(例如对于Noonan Spectrum disorder);(2)若临床表型不典型且根据家族史无法确定其遗传模式,染色体微阵列分析应先于CGES。但若用CGES产生的数据分析拷贝数变异与染色体微阵列分析技术灵敏度一致时,可以考虑只用CGES;(3)若存在近亲结婚,且临床表型不提示特定的已知遗传病,可首选CGES;(4)在基因包检测结果为阴性的情况下,通常CGES不是必须的后续检测步骤。然而,随着CGES检测成本的不断下降,若实验室已具备建立通用CGES平台并优化数据分析流程进行有效检测的能力,可在优先分析相关基因无阳性结果后,扩大到对整个数据的分析;(5)若表型的遗传倾向明显,但没有合适的临床靶向基因包检测,可考虑CGES。例如,由于新的科研发现,现有的基因包已经过时;患者的表型不典型,没有相应的基因包可选;(6)CGES也可用于有临床诊断急迫需求时或对亲属风险评估有紧急的临床需求时。
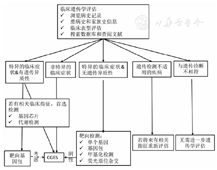

首先,获得前后一致的表型数据对于CGES数据的分析和再分析至关重要。建议使用标准的人类表型术语(Human Phenotype Ontology,HPO)词条来准确描述收集到的临床表型;使用器官或者系统特异的表型模块来保证收集数据的一致性;无论病兆的原发器官,对每个患者的表型均应使用统一的表型数据集。
其次,长期的追踪随访,结合其临床表型,将有助于进一步精确解读基因变异。因此,在CGES前咨询中就需要计划预约患者后续的随访,管理每次随访的表型记录,包括更新的体格检查、治疗史和家族史、以及其他的检测结果。CGES检测后的遗传咨询可能需要多次。例如,第一次针对临床指征的检测结果加以讨论,决定后续诊疗或进一步检测的方案。若受检者要求获悉次要发现或意外发现,可同时或在第二次另行解释咨询。
再者,CGES能够检测出许多类型的基因变异。建立数据库,随时更新变异的解读和分类依据,并实现数据共享,可通过比较结果,提高解读变异的能力。因此,在检测前咨询时,可告知一些不泄漏受检者身份信息的数据分享平台(如Matchmaker Exchange[6])和在受检方自愿的前提下分享数据的平台(如GenomeConnect[7])。
CGES检测前遗传咨询的重要议题是告知受检者将收到什么样检测报告,具体参见《美国临床遗传学检测报告的标准和规范》一文。受检者将获悉已知或者预计与疾病相关的致病性或可能致病的变异。这些变异需要至少在CGES检测中达到足够的测序深度并通过质量控制或通过其他方法得到验证。CGES检测常以核心家系(先证者及其父母)的形式送检,以找出新生变异和确定隐性遗传的复合杂合突变,从而提高检测的效率。若亲属有次要发现或意外发现,无论在先证者有无可报告的次要发现或意外发现,都需要根据亲属的意愿告知其本人的信息。此外,应告知成年受检者与其他亲属分享检测结果的意义、道义、以及保密的权利,具体参见《美国临床基因检测后遗传咨询的原则与实践》一文。
需要告知受检者,有些信息虽然CGES能够得到但一般不会提供:(1)有些基因变异可能与常见病(如糖尿病、心脏病、老年痴呆等)的发病风险相关,尽管已经报道会增加患病风险,但和疾病的关系和致病机制尚未被很好地阐明,而且目前尚无相关的临床措施可以延缓或者改变发生的可能性,对健康管理无影响,因此不予报告;(2)对于未成年受检者,无论家长是否为自己或为患儿选择获悉次要发现或意外发现,与成年发病相关的基因变异且在儿童期对健康管理无指导意义的信息将不予报告;(3)使用亲属样本作为参照帮助解读先证者的基因变异,除非有要求获悉次要发现或意外发现,一般不另行发放检测报告。但咨询师会在解释先证者结果的同时,为其亲属的检测结果提供相关的解释。例如,若患儿携带的基因突变来自父母的一方,携带变异的父母为携带者。此时将不会报告携带者状况,若其对携带者状态表示关心,则需要与遗传咨询师讨论或者单独进行携带者状态的检测。
一份简洁而全面的遗传检测送检单可帮助咨询师有条理地进行检测前的遗传咨询。我们在此以哈佛医学院附属麻省总医院分子医学实验室的基因组检测送检单[8]为例,介绍其内容和要素。
CGES的送检单包含知情同意书。知情同意涉及的要点有(1)检测的目的;(2)需要提供何种样品及临床信息(如医疗记录、既往检测报告、家族史等);(3)CGES检测可能获得的信息;(4)CGES的局限性;(5)如何得到检测结果;(6)检测所需的时间;(7)能否一次性得到全部结果;(8)基因检测对其亲属有何影响;(9)检测能获得其他什么信息(例如偶然发现或意外发现);(10)是否将记入病历;(11)样品和数据的使用;(12)检测的风险;(13)谁能获悉受检者的遗传信息;(14)若有疑问可找谁咨询;(15)费用如何承担;(16)是否愿意被联系,商讨参加科研项目的机会;(17)成年受检者或未成年受检者的法定监护人签名;(18)送检者的签名。
送检单上首先要提供受检者基本信息,包括姓名、性别、出生日期、身份证、联系方式(家庭住址、邮编、电话/手机号、邮箱等)、就医的机构和该机构的病历号(相当于中国医院的登记号或住院号)。此外,需要标明受检者是否为领养或已故、以及受检者的族裔。这些信息若无法从已有病历中获得,咨询师需在临床检测前遗传咨询时进行了解。
送检单上接着需要标出检测项目,例如个人的基因组检测、核心家庭(先证者及其父母)的基因组检测、为解读先证者的检测数据而进行的亲属检测、抑或其他亲属是否携带与先证者相同的变异等。检测前咨询时需解释清楚各种检测的用途。
临床表型信息是对于解读基因变异非常有用,因此在咨询时可按所列系统一一详细记录表型,并列出家族史。根据这些情况,可给出初步鉴别诊断和怀疑的遗传模式。若受检者或家属曾做过基因检测,则需列出结果。
在决定检测项目后,应按需要提供送检样本的信息,包括采样时间和样本类型(全血、DNA、干血片等)。若提供血液样本,需注明采血管类型(何种抗凝剂)。若提供DNA样本,则需提供提取组织的来源。送检亲属的样品时还要求提供与先证者的关系。
最后,在送检单上也需要提供送检机构的信息,包括送检医师和遗传咨询师的姓名和联系方式。支付方式与检测机构的收费规定有关,由各临床实验室自定。但在检测前咨询时,需要告知费用并解释清楚支付方式。咨询师需在提供检测咨询前与检测机构联系,了解价格和检测周转期。
基因检测前遗传咨询是保障遗传检测被合理利用,达到基因检测利益最大化、负面影响最小化的重要措施,也是了解病患家族史、教育病患及其家庭成员的重要环节,同时也为病患行使法律权利及知情选择、参加临床研究提供了机会。检测前遗传咨询是基因检测不可或缺的重要环节之一,应得到足够的重视。
要做好遗传咨询,还需要做好一些重要的铺垫,需要多方面的共同努力。政府主管部门应该在与专家和行业沟通的基础上,制定相关的规范和指南,重视对基因检测相关法律法规的制定和实施。通过对基因检测的规范化,保障患者的利益及权益,确保基因检测产业的长期发展和社会责任。为此,临床医生也需要不断提高自身的业务水平,除需要对患者进行全面、标准化的评估,还需要了解疾病的遗传模式、可能的临床诊断,并了解不同检测方法的特点和局限性,这样才能为其推荐最合适的基因检测项目或方法。此外,临床医生还要能够解读临床基因检测报告,不仅能够判断和患者临床相关的致病变异,也要了解次要发现和意外发现的意义及具有把握何时、如何报告次要发现和意外发现的能力。基因诊断检测机构也需要按规范化的内容设计使用送检单,把好知情同意这一关,保障检测质量及数据解读的可靠性和准确性,做好与临床医生的沟通,保护患者的隐私及法律权利。然而,为了保证上述这些环节的落实,最为关键的还是需要培养专业化的遗传咨询师。这方面我们的使命任重而道远,更希望国家能确立遗传咨询师的工作岗位,使遗传咨询师能够发挥其在基因检测各个环节的重要作用。
所有作者均声明不存在利益及版权冲突































