
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
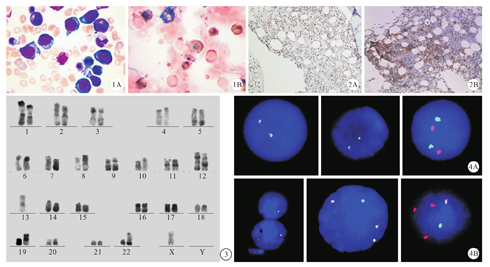
患者 女,47岁,2月前无明显诱因下出现后背痛,持续约数分钟至半小时后可自行缓解,无放射痛、胸痛、胸闷、心悸,无腹痛、腹胀、腹泻、恶心、呕吐,无发热、乏力,未予重视及治疗,此后间断发作,均可自行缓解。1月前患者无明显诱因下出现发热,最高体温39.2℃,偶伴有大汗,出汗后体温可降至正常,伴有肌肉关节酸痛;伴有左腹疼痛,吸气及咳嗽时加重,平静卧床可缓解,伴有腹胀、恶心,无呕吐。无畏寒、寒战,无咳嗽、咳痰,无尿频、尿急,无盗汗、乏力。患者于当地医院就诊,查胸腹部平扫CT示脾大。肝内钙化灶,未予治疗。此后患者仍感左腹疼痛明显,自感左侧腹部"脾脏逐渐增大",遂于外院查腹部超声示脾大,18.7 cm × 6.7 cm,并于1周后再次复查腹部超声示脾大,25.5 cm ×8.9 cm。为求进一步治疗转入我院,予骨髓穿刺检查。因淋巴结较小且表面红肿、触痛放弃活检。骨髓细胞形态学检查:可见分类不明细胞占21%,胞体大,染色质粗糙、核仁大而清晰,胞浆内偶见空泡,POX染色阴性(图1);骨髓活检免疫组化:BCL2(+;50%)、C-MYC(+;70%)(图2);染色体核型异常:-X,dup(1q),del(1p),der(7),add(8p),add(10p),add(12p),add(12q),der(13;14),der(13;22),+14(图3);FISH显示IgH(+,25%)、C-MYC(+,22%)、IgH/C-MYC(+,21%)(图4);确诊为BCL-2和C-MYC蛋白高表达,IgH/C-MYC融合基因阳性,且C-MYC基因扩增的双重表达淋巴瘤(double-protein-expression lymphomas,DPL )。该患者明确诊断后行分次减量CHOPE方案治疗,辅以碱化、水化、止吐、护胃等对症支持治疗,后连续两次R-EPOCH方案化疗,三月后PET-CT提示原全身多发淋巴结病灶部分较前缩小。本研究经医院伦理委员会批准(D2018085)。

DPL指通过免疫组织化学染色检测到MYC和Bcl-2蛋白的过表达,其Cut-off值一般为MYC≥40%、BCL2 ≥50%~70%,DPL多数为ABC来源[1]。在DLBCL中,双重打击淋巴瘤(double-hit lymphoma,DHL)占5%~10%,DPL占30%~40%。研究发现,当Bcl-2蛋白表达异常时,导致突变或受损的细胞无法及时清除,细胞存活延长,这极有可能是肿瘤发生的原因之一[2]。MYC蛋白阳性表达则是DLBCL患者的不良预后因素[3,4],有研究表明MYC/BCL2共表达多见于老年患者,占DLBCL的19%~34%。MYC和Bcl-2蛋白共表达的DLBCL患者对标准R-CHOP化疗方案反应较低[5]。研究发现,MYC和Bcl-2低表达均可使DLBCL患者总生存期及无进展生存期延长,高表达则提示预后较差[5]。
c-MYC的伙伴基因常涉及IG,本例患者出现t(8;14)(q24;q32)易位,形成了IgH/C-MYC融合基因,该融合基因常见于85%的Burkitt淋巴瘤中,也可见于成熟母细胞瘤,但仅在2%~5%的DLBCL中会出现[6]。在淋巴肿瘤发病机制中,该融合基因涉及到C-MYC的过表达和细胞诱导扩散[7] 。c-MYC是一种调节细胞周期和细胞凋亡的多功能转录因子,通过基因扩增编码的产物能与细胞核内DNA特异性结合,从而上调细胞增殖的相关基因表达,促进细胞增殖,与淋巴瘤特别是B细胞淋巴瘤的发生密切相关[8,9]。t(8;14)(q24;q32)是导致IGH/C-MYC融合基因形成的直接原因,但是,在B淋巴细胞发育过程中,何时发生t(8;14)形成IGH/MYC融合基因尚不清楚[10],若染色体核型检查未见t(8;14)(q24;q32),但间期FISH里C-MYC和IgH均检出阳性时应该进一步明确是否形成了IGH/C-MYC融合基因。若染色体核型没有检出t(8;14)(q24;q32),但间期FISH里MYC阳性,IgH阴性的情况,还可以直接用C-MYC探针做中期FISH,看看C-MYC是否易位到2p11上形成IGK/MYC融合基因或易位到22q11上形成IGL/MYC融合基因。
随着FISH技术在血液恶性肿瘤中的广泛应用,淋巴瘤相关染色体异常的检出率得以明显提高,FISH已成为淋巴瘤在诊断、预后判断、疗效分析及用药指导中不可或缺的一种检测手段。对于DLBCL患者尤其应该进行FISH检测,2016年世界卫生组织诊断中专门将具有MYC、Bcl-2和(或)Bcl-6基因重排阳性,即所谓的双重打击(double-hit)或三重打击(triple-hit)的高侵袭性B细胞淋巴瘤作为一个新的分类,而利用免疫组化检测MYC和Bcl-2蛋白表达阳性,即"双重表达",仅作为一项预后不良的指标,因为引起蛋白过表达原因较多,所以MYC蛋白表达阳性患者未必同时具有MYC基因重排,由于DHL较DPL预后更差,所以对于DLBCL患者可先行免疫组化,发现"双重表达"者有必要进一步行FISH检测明确是否为"双重打击"。
所有作者均声明不存在利益冲突


























