
微粒是真核细胞活化或凋亡时释放的直径约为0.1~1.0 μm的双层脂质膜囊泡,来源于血小板、白细胞、红细胞、单核细胞、内皮细胞及肿瘤细胞等。组织因子(TF)是一种跨膜糖蛋白,是体内凝血途径的启动因子。TF主要以在微粒上表达的形式存在,这种微粒称为组织因子阳性微粒(TF+MPs)。TF+MPs具有较高的促凝活性,其表达水平可在血栓性疾病和相关凝血性疾病中升高。因此,测定TF+MPs可能作为血栓性疾病的有效监测指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
微粒是直径约0.1~1.0 μm的完整细胞膜囊泡,在真核细胞在受到刺激或凋亡过程中产生,其中表达组织因子(tissue factor,TF)的微粒被称为组织因子阳性微粒(tissue factor-bearing microparticles,TF+MPs)[1]。已有研究结果显示,血小板、红细胞、单核细胞、粒细胞、淋巴细胞、内皮细胞和肿瘤细胞等受到活化或凋亡刺激时均可产生微粒,并发挥促凝、促炎症、促进血管生成和调节内皮功能等作用,而不同细胞来源的微粒与多种疾病的发生密切相关[2]。尽管目前对微粒的研究涉及很多生理病理学领域,但微粒的凝血活性及其相关血栓性疾病仍是研究的热点[1]。所有的微粒都具有促凝活性,其中促凝活性最高微粒是TF+MPs,对于血栓性疾病和相关凝血性疾病的发生、发展有重要意义和作用[3]。现对TF+MPs在凝血及血栓形成中的作用进行综述如下。
微粒是真核细胞受到刺激或凋亡时细胞膜释放出的含有多种成分的直径为0.1~1.0 μm的囊泡,具有完整的磷脂膜并表达其亲本细胞特异性的膜抗原[3]。对于微粒的鉴定通常包括大小的辨别及膜外磷脂酰丝氨酸(phosphatidylserine,PS)的存在[4]。细胞膜磷脂双分子层不对称性的消失而导致PS暴露是微粒形成的关键,该过程是由外翻酶(flippase)、内翻酶(floppase)及混杂酶(scramblase)等膜转运蛋白协同完成,在正常情况下上述三者和膜内侧带负电荷的PS一起维持细胞膜磷脂双分子层的不对称性[5]。另外,Ca2+内流也是微粒形成的先决条件,不仅促进PS外翻,还激活细胞骨架蛋白裂解所必需的钙蛋白酶(calpains, CAPN)和半胱氨酸天冬氨酸蛋白酶(cysteinylasparate-specificproteinase,caspase),促进细胞骨架的重塑,使磷脂双分子层不对称性的消失和细胞骨架的破坏,导致细胞膜出泡形成并释放微粒[3]。
TF是一种跨膜糖蛋白,是体内凝血途径的主要起始因子。TF主要以在微粒上表达的形式存在,这种微粒即为TF+MPs。TF在微粒上的存在极大地提高了后者的促凝活性。首先,TF是凝血因子FⅦ和FⅦa的受体,对FⅦ/Ⅶa有较高亲和力,血液中TF+MPs能够快速和FⅦ/Ⅶa结合形成TF/FⅦa复合物,激活FⅩ和FⅪ从而启动凝血过程。同时,各种细胞来源的微粒表面均有负电荷的PS暴露,与FⅦ、FⅨ和FⅩ等多种凝血蛋白上带正电荷的γ-羟基谷氨酸相互吸引,也促进了TF的"解密"[6]。已证实与无TF表达的微粒相比,TF+MPs的促凝活性升高10倍[7]。因此,各种细胞来源微粒均有促凝活性,其中促凝活性最强的是TF+MPs[3]。
微粒在血液循环中的存留时间较短,清除TF+MPs和不含TF的微粒的主要部位为脾脏。在清除血小板微粒(platelet microparticles,PMPs)过程中,PS结合蛋白乳凝集素有重要作用。Owen和Mackman[3]研究结果显示,与野生型的同胎小鼠相比,乳凝集素缺乏的小鼠PMPs水平明显升高,可达野生型的同胎小鼠的5倍,而已切除脾脏小鼠比对照组也有较高的微粒水平。该研究将人类肿瘤细胞来源的TF+MPs注射到已切除脾脏及未切除脾脏小鼠中,未切除脾脏小鼠的TF+MPs在注射后30 min出现峰值,在120 min后无法检出,并且在小鼠脾脏中检测到人类TF,而切除脾脏小鼠的TF+MPs在注射后120 min出现峰值[3]。
血液循环中的TF+MPs按照其细胞来源可分为组织因子阳性血小板微粒(tissue factor-bearing platelet microparticles,TF+PMPs)、组织因子阳性单核细胞微粒(tissue factor-bearing monocyte microparticles,TF+MMPs)、组织因子阳性内皮细胞微粒(tissue factor-bearing endothelial microparticles,TF+EMPs)、组织因子阳性中性粒细胞微粒(tissue factor-bearing neutrophil microparticles,TF+NMPs)、组织因子阳性红细胞微粒(tissue factor-bearing red blood cell microparticles,TF+RMPs)和肿瘤细胞来源TF+MPs等[3]。TF+MPs的细胞来源主要由其亲本细胞表面抗原决定。根据不同细胞来源的特点,常使用亲本细胞特异性表面抗原的抗体CD142通过流式细胞分析(flow cytometry, FCM)技术检测特定的TF+MPs(表1),此外,也常使用Annexin V或乳凝集素等进行检测[1]。
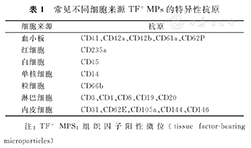
常见不同细胞来源TF+MPs的特异性抗原
常见不同细胞来源TF+MPs的特异性抗原
| 细胞来源 | 抗原 |
|---|---|
| 血小板 | CD41、CD42a、CD42b、CD61a、CD62P |
| 红细胞 | CD235a |
| 白细胞 | CD45 |
| 单核细胞 | CD14 |
| 粒细胞 | CD66b |
| 淋巴细胞 | CD3、CD4、CD8、CD19、CD20 |
| 内皮细胞 | CD31、CD62E、CD105a、CD144、CD146 |
注:TF+MPS:组织因子阳性微位(tissue factor-bearing microparticles)
血小板能表达TF,但部分研究发现不管在静息还是活化状态的血小板中都未检测到TF[3]。究其结果矛盾的原因,可能是一些研究未使用抗TF抗体抑制剂验证血小板的促凝活性是否是由于TF的存在所致,但这一步骤尤为重要,因为高浓度的活化FⅦ可以在TF存在情况下激活FⅩ。此外,血小板上存在的部分TF可能粘附于活化的血小板上的TF+PMPs。全血中加入胶原蛋白可增加血小板上TF的表达。有研究结果显示,TF+PMPs发挥促凝作用主要通过TF介导的外源性凝血途径完成[5]。
未受刺激的单核细胞不表达TF,使用脂多糖(lipopolysaccharide,LPS)刺激单核细胞可增加TF的表达和TF+MPs的释放。TF+MMPs通过释放TF招募富含血小板和纤维蛋白血栓集聚在血管受损起始部位,表达TF和P选择素糖蛋白(P-selectin glycoprotein,PSGL)-1,后者与P选择素结合后附着于活化的血小板及内皮细胞上,从而防止过度出血[5]。值得注意的是,LPS刺激单核细胞产生的微粒能表达低水平的组织因子途径抑制剂(tissue factor pathway inhibitor,TFPI)[3]。伴有败血症的细菌性脑膜炎患者血浆中也发现表达TF和CD14的微粒。内毒素血症患者体内TF及CD14呈双阳性的微粒水平一过性升高。镰刀形细胞贫血(sickle cell disease,SCD)患者TF+MMPs水平也有所升高,而在SCD合并股骨坏死的患者血液中TF+MMPs水平显著高于未合并股骨坏死者,并且上述二者TF+MMPs水平均显著高于健康对照组[8]。上述研究结果表明单核细胞是正常人及病人体内TF+MPs的主要来源。
体外培养的内皮细胞在细胞因子、LPS等多种刺激下也会表达TF。Owens和Mackman[3]利用内毒素血症和败血症的动物模型研究结果显示,脾血管及大动脉分支处的内皮细胞会表达TF,在内皮细胞表达的TF+MPs中还发现含有白细胞标记PSGL-1的粒状结构,而在病危SCD患者中也可发现表达TF和CD144的TF+EMPs。在急性心肌梗死患者,TF+EMPs通过表达TEPI和减少TF依赖的血栓形成从而产生抗凝作用及防止病理性血栓产生[5]。上述研究结果表明TF+EMPs能表达TFPI,调节TF活性。
中性粒细胞活化后会表达TF,在抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody, ANCA)相关血管炎(ANCA-associated vasculitis, AAV)患者的血液高凝状态是因为中性粒细胞释放TF+NMPs所致,且释放出的TF+NMPs又会进一步促进中性粒细胞表达TF[9]。
TF+RMPs在循环微粒中所占比例较少。有研究结果显示,TF+RMPs可通过依赖FⅫ的内源性凝血途径引起并促进凝血酶的形成[10]。
肿瘤细胞及肿瘤微环境内细胞(如内皮细胞、成纤维细胞和单核细胞)等可过度表达TF,并使大量肿瘤细胞来源TF+MPs产生。该类型微粒与肿瘤细胞的生长、血管的生成和转移、患者的血液高凝状态及血栓栓塞等事件的发生密切相关[11]。
微粒的促凝活性与膜外PS和TF的存在有关。TF由除内皮细胞外的大部分血管壁细胞和血细胞释放,经常被称为围绕血管的"止血外壳",能预防外伤造成的过度出血[12]。正常生理条件下,血液循环中的TF表达水平很低,而单核细胞被认为是其主要来源[1]。单个TF+PMPs的促凝活性比单个活化血小板相同区域的促凝活性高50~100倍[13]。Ollivier等[14]研究结果显示,使用高速离心(20 000×g离心15 min)方法去除血浆中微粒后,凝血酶形成时间延长,但仅加入TF+MPs而不加入凝血酶,即可使凝血时间缩短,该结果提示TF+MPs在凝血中发挥重要作用。在TF存在情况下,微粒的促凝活性明显增强,其生成的TF︰FⅦa复合物主要受到由内皮细胞合成并释放到血液中的TFPI调控,以FⅩa依赖方式抑制TF︰FⅦa复合物形成,从而抑制病理性凝血系统激活。TF︰FⅦa复合物具有低活性和高活性两种状态,这与TF具有不同构象有关。正常状态下,TF+MPs数量及活性很低,在抗凝系统作用下保持机体凝血稳态、阻止血栓形成或降解已形成的微血栓。在血管损伤时,循环中TF+MPs增多,并随血流聚集到已经受损血管局部,启动凝血过程,并形成血栓[3]。Owens和Mackman[3]研究结果还显示,健康人或小鼠体内的血管壁含有大量的TF,其中较大血管的血管壁中TF含量大约是循环TF+MPs所表达TF含量的1 000倍,该结果提示循环中TF+MPs在小血管中的凝血活性显著高于在较大血管和TF低表达的器官(如肝脏、骨骼肌等),但究其发生机制,目前尚未明确。
长期高血糖损伤血管内皮及血液高凝状态是糖尿病患者发生严重心血管疾病的基础。有研究结果显示,糖尿病患者持续血液高凝状态主要是由于血浆TF+MPs增加所致,并且高血糖或高胰岛素会增加TF+MPs的促凝活性[15]。在急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)患者发病时常表现出严重凝血功能紊乱,出血及血栓形成是该病常见的早期死亡原因。APL细胞质内含有大量TF、癌性促凝物质,细胞表面含有较多AnnexinⅡ和组织性纤溶酶原激活物等促纤溶物质,是导致APL凝血功能紊乱的根本原因。APL患者血浆TF+MPs约高于健康人10倍。Ma等[16]研究结果显示,在30例APL患者中,当使用抗人组织因子抗体抑制外源性凝血途径时,APL细胞来源微粒的凝血酶活性减少54%,然而使用抗FⅪ或抗TFPI却未能产生明显的抑制作用,该结果提示APL患者的血液高凝状态主要是循环中的早幼粒细胞来源微粒依赖TF相关的促凝途径造成的。因此,TF+MPs可作为APL相关凝血紊乱的新监测指标。ANCA是一种以中性粒细胞和单核细胞的细胞质成份为靶抗原的自身抗体,是诊断系统性血管炎的特异性指标。AAV是中、小血管产生炎症和坏死的一组系统性免疫功能紊乱性疾病,其主要特征是中性粒细胞过度激活。凝血酶-抗凝血酶复合物(thrombin antithrombin complexes,TAT)是反映凝血酶活性的指标,在存在血液高凝状态的患者中升高。急性发作的AAV患者组外周血TF+NMPs约是健康对照组的4倍,约是AAV缓解组的2倍[5]。Huang等[17]测定急性发作AAV组(n=11)和健康对照组(n=10)的血浆TF+MPs水平,所有研究对象采血前均无静脉血栓栓塞(venous thrombus embolism,VTE)形成且其抗磷脂抗体(anti-phospholipid antibody, aPLA)、抗肾小球基底膜抗体均呈阴性,该研究结果显示,急性发作AAV组血浆TF+MPs水平高于健康对照组,而前者的血浆TAT水平达25.4 ng/mL,后者仅为13.3 ng/mL。该研究结果还显示,当使用抗TF抗体复合物孵育中性粒细胞30 min后,其TAT水平明显下降至17.8 ng/mL,该结果证实AAV患者的血液高凝状态是由于TF+NMPs和中性粒细胞外诱捕网络所引起,并且产生的TF+MPs会进一步促进中性粒细胞释放TF,而中性粒细胞活性与C5a有关[17]。也有研究结果显示,唾液中存在的TF+MPs可促进受损口腔表皮止血[18]。
TF+MPs具有最强的促凝活性,可直接参与体内病理性血栓的形成过程[1,3]。Biro等[19]研究结果显示,老鼠静脉瘀滞模型组微粒总数与健康对照组比较,差异无统计学意义(P>0.05),但前者TF+MPs活性、TF+MPs促凝活性和促血栓生成均显著高于后者(P<0.05),前者产生的平均血栓量也是后者的24.8倍。许多血栓前状态(prethrombotic state,PTS)常伴随循环微粒的增加。尽管微粒数量的增加和PTS之间存在密切联系,但并不能据此推断循环微粒的增加与血栓形成间存在必然的因果关系[1]。Owens和Mackman[3]利用小鼠动脉血栓形成模型证实来源于单核细胞的TF+MPs会聚集在血栓形成部位并参与血凝块的进一步形成,P选择素连接表达PSGL-1的微粒,捕捉TF+MPs粘附于血管受损部位,从而促进血栓形成。值得注意的是,上述研究中,小鼠血栓模型使用破坏或结扎血管的方法来制作血栓形成,并非在特定病理学背景下,因此其血栓模型仍存在缺陷,使其结果具有局限性。此外,上述研究常将外源性微粒注入小鼠体内,这可能也限制了其对人类血栓性疾病的适用性。
肝素诱导性血小板减少症(heparin-induced thrombocytopenia,HIT)是患者由于使用肝素而引起的血小板减少,与肝素制剂来源有关。HIT患者产生自身抗体与血小板因子(platelet factor,PF)4、肝素形成复合物,即HIT抗体复合物。尽管HIT患者血小板减少,易导致出血,但其最严重并发症是全身动、静脉血栓形成。Kasthuri等[20]通过体外测定HIT抗体复合物对外周血单核细胞表达TF并释放TF+MPs的影响,研究结果显示,用HIT抗体复合物孵育6 h的单核细胞来源的研究组TF活性高达72.08,而健康对照组单核细胞来源的TF活性仅为6.22,研究组TF+MPs水平也显著升高,此外,研究组单核细胞中TF的mRNA是对照组的37倍,且该组血栓形成发生率也随单核细胞数量减少而降低。HIT抗体复合物能促进单核细胞表达TF并释放TF+MPs,表明TF+MMPs与HIT相关动、静脉血栓形成及发展有关。抗磷脂抗体综合症(antiphospholipid syndrome,APS)是一组由aPLA引起,以动、静脉血栓和血小板减少为主要临床表现的综合症。Willemze等[21]对比APS患者(n=30)和无症状的aPLA阳性患者(n=72)血浆中TF+MPs的研究结果显示,30例APS患者中8例发生静脉血栓(其中1例患者发生2次),7例发生动脉血栓(其中3例患者各发生2次),APS患者血液TF+MPs明显高无动、静脉血栓的aPLA阳性患者,该结果证实APS患者血液中TF+MPs水平升高并导致病理性血栓形成。
动脉粥样硬化(atherosclerosis,AS)是最常见的一组动脉硬化性血管病变,其主要特点是动脉管壁增厚变硬、失去弹性和管腔狭窄,粥样硬化斑块中脂质及结缔组织的含量决定粥样硬化斑块的稳定性及是否导致急性缺血事件的发生。Leroyer等[22]研究结果显示,在26例AS患者中,粥样硬化斑块中的微粒主要来源于中性粒细胞,其次来源于巨噬细胞、淋巴细胞、红细胞等,但不包含血小板来源的微粒。粥样硬化斑块中的微粒浓度至少超过血浆中微粒浓度的200倍,血浆和粥样硬化斑块中的微粒都表达TF,其中在粥样斑块中50%微粒表达TF,但斑块微粒中97%的促凝活性依赖于TF的存在,该斑块中的微粒产生凝血活性是血浆中微粒产生的凝血活性的1.5倍,从而增加血栓发生率。Huisse等[23]对123例接受阿司匹林和普通肝素治疗的ST段抬高型心肌梗死患者(包括53例自发冠状动脉再通患者和70例冠状动脉造影中发现冠状动脉持续闭塞患者)和25例健康人的病例对照研究结果显示,有持续性栓塞患者的TF+MPs促凝血酶活性明显升高。
脓毒症常伴有血栓形成。脑膜炎奈瑟菌是一种常见革兰阴性球菌,可侵入扁桃体导致脑膜炎球菌脑炎,发生暴发性紫癜、出血或血栓。多种血细胞来源的TF+MPs在脑膜炎球菌脓毒症患者中升高并发挥高度促凝作用[3]。Hellum等[24]分析23例脑膜炎球菌感染患者(包括13例脑膜炎球菌感染性休克患者和9例脑膜炎)血浆TF+MPs促凝活性及相关血栓发生率的研究结果显示,与9例脑膜炎患者相比,13例感染性休克患者血浆的TF+MPs能快速启动凝血酶生成途径,生成的凝血酶峰值分别为79 nmol和24 nmol,凝血酶生成的速度指数分别是9 nmol/min和1 nmol/min。因此,与脑膜炎球菌脑炎患者相比,脑膜炎球菌感染性休克患者的血浆TF+MPs具有更高、更快促进凝血酶产生及血栓形成的活性,且TF+MPs的活性与其血浆中LPS浓度有关。
TF+MPs与肿瘤相关的血栓形成有密切关系。肿瘤患者较为常见且可危及生命的并发症是动、静脉血栓形成,在发生动、静脉血栓形成的所有实体器官肿瘤中,以胰腺和脑肿瘤发生率最高,可达26%。肿瘤细胞(特别是上皮细胞来源)能表达TF并释放TF+MPs。此外,TF表达量与不同的肿瘤组织类型有关。已有研究结果显示,发生VTE肿瘤患者的血浆TF活性是未发生VTE患者的18倍,该结果证实TF的活性与血栓事件有关[11]。Zwicker等[25]研究结果显示,60%(18/30)的急性VTE的肿瘤患者(包括胰腺癌、乳腺癌、卵巢癌、肺癌、慢性淋巴细胞白血病和非霍奇金淋巴瘤等,n=30)血浆中检测到TF+MPs,而仅28%(16/60)的未发生VTE肿瘤患者(n=60)血浆中检测到TF+MPs,而血浆中检测到TF+MPs患者发生病理性血栓的风险是健康人的4倍以上。该研究对60例未发生VTE的肿瘤患者进行1年的回顾性研究结果显示,TF+MPs升高的患者VTE发生率为34.8%,而血浆中未检测到TF+MPs的肿瘤患者未发现VTE形成。因此,肿瘤细胞来源的TF+MPs与肿瘤患者发生VTE有关,并且在肿瘤相关的病理性血栓形成的发病机制中发挥重要作用。有研究结果显示,20例晚期结肠直肠癌并发VTE组的血浆TF+MPs浓度是健康对照组的2倍,发生VTE的肿瘤患者的TF+MPs浓度是未发生VTE患者的7倍[11]。Geddings和Mackman[26]研究结果显示,1例大细胞肺癌并发Trousseau's综合症患者血浆中的TF浓度是健康人的40倍。该结果表明晚期肿瘤患者TF明显升高,肿瘤细胞自发释放TF+MPs增加与PTS有关,并增加血栓形成发生风险,其中,TF+MPs的浓度与肿瘤患者发生VTE的几率呈正相关关系。同时,对于TF+MPs在肿瘤相关血栓的发生过程中的作用,可能是由于TF参与肿瘤的生长、血管生成及转移所致。Sartori等[27]61例多形性胶质母细胞瘤(glioblastomamultiforme,GBM)患者在手术+化疗治疗前、治疗后1周及第1、4、7个月后分别用FCM测定血浆TF+MPs的结果显示,GBM组治疗前和治疗后1周血浆TF+MPs浓度显著高于对照组,但GBM组治疗前及治疗后1周血浆TF+MPs浓度差异无统计学意义;在治疗后1、4个月,血浆TF+MPs浓度较治疗前显著下降,11例发生VTE患者中,7例测得TF+MPs活性升高,该结果表明通过FCM检测脑肿瘤患者的TF+MPs有预测VTE形成的可能。但其他研究结果未能表明微粒增加能成为血栓形成的预测指标,究其结果不一致原因,可能与不同类型恶性肿瘤发生血栓形成的风险存在差异性有关,也可能与研究方法和变量分析的不同有关[28]。但是,上述研究结果由于没有动态监测微粒而存在局限性。Khorana等[29]动态观察11例胰腺癌患者TF+MPs促凝活性的研究结果显示,TF+MPs水平升高的患者深静脉血栓(deep vein thrombosis,DVT)发生率为26.3%,TF+MPs呈低表达者DVT发生率仅为4.5%;使用达肝素的4例患者中,1例患者用药后2 h的TF抗原表达水平明显升高,用药后12 d形成大面积肺栓塞;1例未采取任何处理的患者血浆TF抗原表达水平在化疗3个月内逐渐增加,在56 d后出现DVT。该结果表明随时间延长而升高的TF+MPs水平和血栓事件的发生有显著相关性。而转移性胰腺癌患者血浆TF+MPs的活性也明显升高,类似现象也发生于卵巢癌患者,并且TF+MPs水平的增高与患者的临床不良预后有关。Thomas等[30]在胰腺癌老鼠VTE模型中,人为性阻断下腔静脉血流,并且分别对其注射高剂量和低剂量的TF,该研究结果显示与注射低剂量TF组相比,约67%的注射高剂量TF组胰腺癌老鼠发生VTE,而且注射低剂量TF可降低血栓形成发生率和减小血栓体积。肿瘤细胞来源的TF+MPs更易导致DVT,增加肿瘤相关性VTE的发生率。Bharthuar等[31]对117例胰胆管肿瘤患者(包括80例胰腺癌、34例胆管癌和2例原发性胆汁性肝硬化)的研究结果显示,52例(约44.5%)患者发生血栓栓塞,栓塞类型包括肺栓塞、DVT和其他动、静脉血栓,且所有肿瘤患者平均TF+MPs水平为2.15 pg/mL,发生血栓栓塞的胰腺癌患者的平均TF+MPs水平为3.54 pg/mL,未发生血栓栓塞者的平均TF+MPs水平为1.15 pg/mL;当TF+MPs水平<2.5 pg/mL时,患者平均生存期为231.0 d,而当TF+MPs>2.5 pg/mL时,患者平均生存期仅为98.5 d。该结果表明TF+MPs水平升高不仅能增加肿瘤患者的血栓栓塞发生率,更重要的是可缩短肿瘤患者的生存期。
TF+MPs具有最强促凝活性,在凝血及血栓形成中具有明确且重要的作用,为相关疾病发生机制的研究及治疗策略提供了新的诊疗思路和线索。但是TF+MPs的产生机制、凝血作用机理与途径及其与血栓性疾病的关系尚待进一步明确。
无



























