
血小板抗原与抗体的研究,在各类免疫性血小板减少症的诊断和治疗中具有重要作用。与红细胞血型遗传和免疫血液学技术相比,血小板抗原、抗体的基础研究和免疫检测技术相对落后,尤其是国内,在新的种族特异性血小板抗原的发现、血小板抗体特异性鉴定、血小板输注同种免疫问题等方面,亟需加大研究力度,以推动我国血小板免疫学研究和临床应用的发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
有效的血小板输注,可提高患者血小板计数,改善止血效果,降低出血风险。近年随着血液供求紧张,血小板ABO血型非同型输注备受关注和争论,其焦点主要在于血小板抗原、抗体免疫学反应对输注效果的影响及其与现行法律、法规的相适性[1]。血小板抗原、抗体相互作用,亦在多次血小板输注无效、输血后紫癜、胎儿及新生儿同种免疫性血小板减少症、自身免疫性血小板减少症、药物诱导的免疫性血小板减少症等临床症状中起着决定性作用[2]。与国外相关研究相比,我国对血小板抗原、抗体的基础研究及其临床转化研究相对滞后,主要表现在血小板抗体特异性鉴定技术落后,同种免疫性血小板减少症实验诊断技术缺乏,ABO血型非同型血小板输注效果的基础研究数据缺乏,血小板抗原基因分型数据库建设各自为政等。笔者拟对血小板抗原、抗体研究与临床应用及其存在问题进行论述。
血小板表面的抗原系统主要包括同种抗原、自身抗原和药物依赖性抗原。其中,血小板表面的同种抗原主要为血小板特异性抗原,即人类血小板同种抗原(human platelet alloantigen,HPA),其他还包括与白细胞共有的人类白细胞抗原(human leucocyte antigen,HLA)-Ⅰ类分子,与红细胞共有的ABO、H、Lewis、Ii、P1Pk血型等糖链抗原(carbohydrate antigen,CA),与单核/巨噬细胞共有的CD36等。血小板表面的自身抗原主要为血小板膜糖蛋白(glycoprotein,GP)上的一些公共抗原表位构成的抗原决定簇。血小板表面的药物依赖性抗原,主要是血小板GP或细胞因子与某些药物结合后形成的抗原决定簇。
HPA是位于血小板GP上的特定抗原表位,并被认为是血小板特异性抗原。事实上,除了GPⅡb、GPⅠbα、GPⅠbβ携带的HPA主要表达于血小板表面,某些HPA,如位于GPⅠa上的HPA-5、-13、-18、-25,CD109上的HPA-15等,还可表达于血管内皮细胞、淋巴细胞、单核/巨噬细胞、上皮细胞等细胞表面,并非血小板专有抗原。迄今共计发现35个HPA,分别位于6个血小板GP分子上。按照国际输血协会的命名原则,可将35个HPA分为29个系统(或准系统)[3]。其中,12个HPA为对偶抗原,分别归入6个系统,即HPA-1~-5和HPA-15,其余23个HPA均为单个低频抗原,未发现相应的高频对偶抗原,归入23个准系统,见表1。该命名原则与红细胞血型系统命名不同,如红细胞Diego血型系统,单个系统含有22个抗原,包括4个对偶抗原和18个低频非对偶抗原,均由SLC4A1基因突变所致。按照此原则,笔者认为,将HPA归入6个系统更为合理,分别由6个GP基因(ITGB3、GP1BA、ITGA2B、ITGA2、GP1BB和CD109)编码。
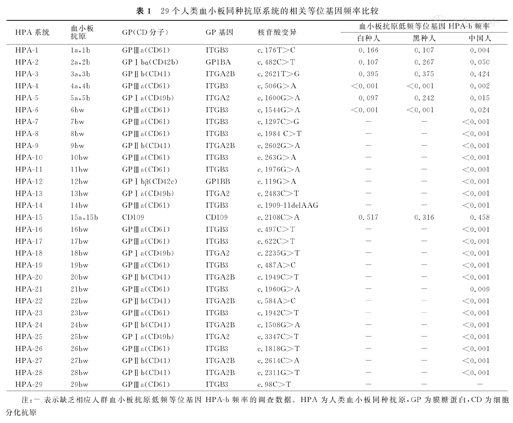
29个人类血小板同种抗原系统的相关等位基因频率比较
29个人类血小板同种抗原系统的相关等位基因频率比较
| HPA系统 | 血小板抗原 | GP(CD分子) | GP基因 | 核苷酸变异 | 血小板抗原低频等位基因HPA-b频率 | ||
|---|---|---|---|---|---|---|---|
| 白种人 | 黑种人 | 中国人 | |||||
| HPA-1 | 1a,1b | GPⅢa(CD61) | ITGB3 | c.176T>C | 0.166 | 0.107 | 0.004 |
| HPA-2 | 2a,2b | GPⅠbα(CD42b) | GP1BA | c.482C>T | 0.107 | 0.267 | 0.050 |
| HPA-3 | 3a,3b | GPⅡb(CD41) | ITGA2B | c.2621T>G | 0.395 | 0.375 | 0.424 |
| HPA-4 | 4a,4b | GPⅢa(CD61) | ITGB3 | c.506G>A | <0.001 | <0.001 | 0.002 |
| HPA-5 | 5a,5b | GPⅠa(CD49b) | ITGA2 | c.1600G>A | 0.097 | 0.242 | 0.015 |
| HPA-6 | 6bw | GPⅢa(CD61) | ITGB3 | c.1544G>A | <0.001 | <0.001 | 0.024 |
| HPA-7 | 7bw | GPⅢa(CD61) | ITGB3 | c.1297C>G | - | - | <0.001 |
| HPA-8 | 8bw | GPⅢa(CD61) | ITGB3 | c.1984 C>T | - | - | <0.001 |
| HPA-9 | 9bw | GPⅡb(CD41) | ITGA2B | c.2602G>A | - | - | <0.001 |
| HPA-10 | 10bw | GPⅢa(CD61) | ITGB3 | c.263G>A | - | - | <0.001 |
| HPA-11 | 11bw | GPⅢa(CD61) | ITGB3 | c.1976G>A | - | - | <0.001 |
| HPA-12 | 12bw | GPⅠbβ(CD42c) | GP1BB | c.119G>A | - | - | <0.001 |
| HPA-13 | 13bw | GPⅠa(CD49b) | ITGA2 | c.2483C>T | - | - | <0.001 |
| HPA-14 | 14bw | GPⅢa(CD61) | ITGB3 | c.1909-11delAAG | - | - | <0.001 |
| HPA-15 | 15a,15b | CD109 | CD109 | c.2108C>A | 0.517 | 0.316 | 0.458 |
| HPA-16 | 16bw | GPⅢa(CD61) | ITGB3 | c.497C>T | - | - | <0.001 |
| HPA-17 | 17bw | GPⅢa(CD61) | ITGB3 | c.622C>T | - | - | <0.001 |
| HPA-18 | 18bw | GPⅠa(CD49b) | ITGA2 | c.2235G>T | - | - | <0.001 |
| HPA-19 | 19bw | GPⅢa(CD61) | ITGB3 | c.487A>C | - | - | <0.001 |
| HPA-20 | 20bw | GPⅡb(CD41) | ITGA2B | c.1949C>T | - | - | <0.001 |
| HPA-21 | 21bw | GPⅢa(CD61) | ITGB3 | c.1960G>A | - | - | 0.009 |
| HPA-22 | 22bw | GPⅡb(CD41) | ITGA2B | c.584A>C | - | - | <0.001 |
| HPA-23 | 23bw | GPⅢa(CD61) | ITGB3 | c.1942C>T | - | - | <0.001 |
| HPA-24 | 24bw | GPⅡb(CD41) | ITGA2B | c.1508G>A | - | - | <0.001 |
| HPA-25 | 25bw | GPⅠa(CD49b) | ITGA2 | c.3347C>T | - | - | <0.001 |
| HPA-26 | 26bw | GPⅢa(CD61) | ITGB3 | c.1818G>T | - | - | <0.001 |
| HPA-27 | 27bw | GPⅡb(CD41) | ITGA2B | c.2614C>A | - | - | <0.001 |
| HPA-28 | 28bw | GPⅡb(CD41) | ITGA2B | c.2311G>T | - | - | <0.001 |
| HPA-29 | 29bw | GPⅢa(CD61) | ITGB3 | c.98C>T | - | - | - |
注:-表示缺乏相应人群血小板抗原低频等位基因HPA-b频率的调查数据。HPA为人类血小板同种抗原,GP为膜糖蛋白,CD为细胞分化抗原
研究发现,所有HPA多态性,均由GP基因核苷酸突变所致,见表1。就人群中基因频率而言,HPA-3、-15系统的a和b等位基因频率比较接近,而其他系统均为a等位基因频率远大于b等位基因频率[4]。值得注意的是,与白种人和黑种人群相比,中国人群的HPA-1b、-2b、-5b频率更低,虽然产生相应抗体的几率也更低,但bb纯合子患者一旦产生相应抗体,则很难找到相匹配的血液进行输注。HPA-4b、-6b、-21b在中国人群中频率相对较高,产生相应抗体的几率亦相对较高。HPA的29个系统的相关等位基因频率比较,见表1。低频等位基因HPA-b频率数据,主要来源于免疫多态性数据库(Immuno Polymorphism Database,IPD)和相关文献[4,5,6],其中白种人(欧、美人群),黑种人(非洲人群)和中国人,分别为23、7及5个群体数据的均值。
血小板表面存在HLA-Ⅰ类分子,以HLA-A、-B为主,HLA-C很少。正常血小板表面不表达HLA-DR、-DP、-DQ等HLA-Ⅱ类分子。虽然血小板表面的HLA数目在不同个体中存在明显差异,但因血液循环中的血小板数目远高于白细胞数目,故血小板表面的HLA-A、-B数目仍占血液中HLA-A、-B总量的绝大部分。血小板输注后产生HLA抗体的几率,远高于产生HPA抗体的几率,即使输注去白血小板,也不能完全避免HLA抗体的产生。
血小板表面的红细胞共有抗原包括ABO、H血型等CA,不存在Rh、Kidd血型等多肽类抗原。单采血小板制剂中,红细胞残留量极低(<107/袋),RhD不合血小板输注,虽然存在同种免疫反应产生RhD抗体的风险,但微量红细胞不足以导致溶血性输血反应,故除育龄期女性外,不提倡额外增加采供血成本而向RhD阴性患者输注RhD阴性血小板。在CA中,仅ABO血型系统因其存在天然抗体而具有临床意义,其他H、Lewis、Ii、P1Pk等血型,在血小板输注中基本无临床意义。考虑血小板输注效果和主、次侧不相容导致的溶血性输血反应,一般遵循ABO血型同型血小板输注,但近年因血液供需矛盾、ABO异型造血干细胞移植术后输血等原因,ABO血型非同型血小板输注需求日益增多。从技术层面而言,ABO血型非同型血小板输注包括主侧不合和次侧不合。主侧不合血小板输注,如将A型血小板输注给O型患者,应主要考虑供者血小板表面ABO抗原的表达水平。我们的最新研究发现,不同个体的血小板表面ABO抗原表达水平存在较大差异,ABO抗原低、中、高表达的个体,在人群中约分别占60%、35%、5%。这种ABO抗原表达水平的个体差异表达特性,虽然在血小板采集和储存过程中,因血小板活化而导致ABO抗原表达水平出现波动[7],但总体而言,仍具有ABO抗原表达相对稳定和个体遗传特性[8]。由于ABO抗原低表达个体在人群中所占比例较高,采供血机构可对固定单采血小板供者进行预筛,建立ABO抗原低表达供者数据库,用于ABO主侧不合的血小板输注。其中,ABO抗原低表达的AB型和ABO亚型供者,更具有"通用型"血小板的优势。次侧不合血小板输注,如将O型血小板输注给A型患者,应主要考虑供者血浆抗体输入患者体内后,导致的溶血性输血反应风险。预防血小板输注引起的溶血性输血反应风险对策包括以下2类。第1类预防次侧不合溶血性输血反应风险的策略,是对供者进行ABO抗体效价检测,选择ABO抗体低效价供者进行跨型血小板输注。目前欧洲和日本使用该策略筛选"低危"供者,但各国采用的ABO抗体筛选技术和临界效价尚不统一[9]。ABO抗体效价筛选技术包括试管盐水法,手工抗人球蛋白试验(indirect antiglobulin test,IAT)及微柱凝胶法等。ABO抗体临界效价包括盐水终点、抗人球终点、溶血终点等。从安全角度考虑,ABO抗体临界效价设定盐水效价≤1/32(芬兰)和IAT效价≤1/256(意大利、挪威),视为安全效价;从扩大"低危"供者比例考虑,可将ABO抗体临界效价适当放宽至盐水效价≤1/64(德国、捷克、苏格兰)和IAT效价≤1/512(日本、瑞典),视为安全效价[9]。第2类预防次侧不合溶血性输血反应风险的策略,是以血小板添加液(platelet additive solution,PAS)替代或部分替代供者血浆。目前PAS配方的主要成分包括K+、Mg2+、葡萄糖酸盐、枸橼酸盐、乙酸盐等,以降低采集和储存期血小板活化率和代谢速率,其储存效果有望与血浆相媲美[10]。
CD36抗原可参与同种免疫,并导致血小板减少,表现为CD36缺陷型个体在接触外源性CD36抗原后产生抗体,进一步引发同种免疫性血小板减少症。由于中国人群CD36缺陷型个体人群频率(3%~5%)高于白种人(0~0.3%),所以CD36同种免疫在中国人群中更具有临床意义。根据CD36抗原分布,可将CD36缺陷分为CD36Ⅰ型缺陷(血小板和单核细胞均缺乏CD36)和CD36Ⅱ型缺陷(血小板缺乏CD36,单核细胞表达CD36)。虽然仅CD36Ⅰ型缺陷个体会产生CD36同种抗体,但仍可对CD36Ⅰ型缺陷患者输注CD36Ⅱ型缺陷供者血小板,进行输血治疗。与单核苷酸多态性导致的HPA分型差异相比,CD36缺陷的分子机制较为复杂,特别是CD36Ⅱ型缺陷的分子机制,目前尚不明确[11]。
由于针对血小板抗原的商品化定型抗体的缺乏,以及血清学抗原鉴定的准确性较低,HPA和HLA鉴定均以基因分型替代。血小板抗原的基因分型方法从最初的PCR-序列特异性引物(sequence specific primer,SSP)与PCR-限制性片段长度多态性(restriction fragment length polymorphism,RFLP)等,发展到目前的定量PCR、液相芯片(PCR-序列特异性寡核苷酸探针结合Luminex技术)、测序分型等技术。其中,通量较高的Luminex技术和高准确性的测序技术,成为目前HLA基因分型的主流方法。HPA分子机制简单、明确,尤其适用于血小板抗原的测序分型,而且某些HPA核苷酸多态性位于同一基因的同一外显子,单个测序就可以同时鉴定多个HPA基因型,如HPA-3、-9、-27位于ITGA2B基因的第26外显子,而HPA-4、-16、-19和HPA-8、-11、-21、-23分别位于ITGB3基因的第4和第12外显子,3个测序即可同时鉴定这10个HPA基因型。此外,血小板抗原的测序分型还可以发现新的基因突变点,尤其是可引起氨基酸变异的GP基因突变,可能是潜在的HPA变异点,如首先在中国人群中发现的ITGB3基因c.1960G>A(p.E628K)突变[14],随后在美国1例新生儿同种免疫性血小板减少症患儿中被证实为新的HPA-21bw抗原[15]。对于血小板表面的CD36抗原,一般采用荧光标记的异种抗体结合流式细胞术(flow cytometry,FCM)进行检测。由于CD36缺陷的分子机制较为复杂,目前血小板抗原的基因分型方法,仅可作为其分子机制的研究,不宜作为CD36缺陷型筛选的方法。对于血小板表面的ABO抗原检测,则可以红细胞血清学方法替代。
2009年在国家卫生计生委组织下,国内13个省、市开展献血者血小板抗原基因分型数据库建设,该数据库可为临床免疫性血小板减少症患者提供配合型血小板。固定献血者的ABO血型、HPA和HLA-Ⅰ类基因型为该数据库的基本内容。按照中国人群遗传特征,笔者建议HPA基因型应包括HPA-1~-6、-15、-21共计8个系统,HLA基因型可根据HLA低分辨分型技术检测结果入库,但根据HLA高分辨分型技术检测结果入库更佳。经过7年的努力,献血者血小板抗原基因分型数据库在各省级血站已初具规模,但由于各地数据库容量较小,亦未实现资源共享,导致此数据库临床应用价值很低。未来几年献血者血小板抗原基因分型数据库的发展,应首先以省级血站为点,带动各地市级血站,共建全省范围的献血者血小板抗原基因分型数据库,再逐步开展邻省联网和全国性联网。
与红细胞抗体检测相比,目前我国对于血小板抗体检测能力较低,迄今尚缺乏兼具较高灵敏度与特异性的血小板抗体简便检测技术。目前对于血小板抗体检测的方法,主要包括基于酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)的血小板相关抗体(platelet associated immunoglobulin G,PAIgG)检测,抗原捕获ELISA(antigen capture ELISA,ACE),改良抗原捕获ELISA(modified antigen capture ELISA,MACE),单克隆抗体特异性血小板抗原固定术(monoclonal antibody immobilization of platelet antigens assay,MAIPA),基于红细胞指示的固相红细胞黏附试验(solid phase red cell adherence assay,SPRCA),基于荧光指示的FCM和液相微球偶联糖蛋白捕获抗体(Luminex)等技术。目前国内临床应用最广泛的血小板抗体检测方法为PAIgG检测法(辅助诊断特发性血小板减少性紫癜)和SPRCA技术(血小板配型),但这2种方法及FCM,对于血小板抗体检测均缺乏特异度。MAIPA和ACE/MACE对于血小板抗体检测具有较高特异性,但由于单克隆抗体和待检抗体的竞争作用、血小板谱细胞难以获得、实验操作要求高、针对血小板抗体的商品化试剂昂贵等原因,MAIPA和ACE/MACE目前只在少数实验室作为研究技术开展。目前最有希望成为下一代血小板抗体检测技术的是Luminex法,该技术可将各种纯化的GP或血小板成分(GPⅢa、GPⅡb、GPⅠa、GPⅠbα、GPⅠbβ、CD109、CD36、HLA-Ⅰ、药物结合的血小板成分等),偶联至不同的Luminex荧光微球上,每种偶联蛋白又分为不同分型的HPA、HLA和药物组合,这种预制的荧光微球,可特异性捕获待检样本中的血小板抗体,经荧光二抗显色后,进行血小板抗体检测。Luminex法具有对血小板抗体检测的灵敏度和特异性均较高,以及检测快速(<3 h/96个样本)等优点,是目前血小板抗体检测方法的研究的热点[16]。
为了提高血小板抗体检测及基因分型能力,国际输血协会血小板免疫学委员会每2年举办1次研讨会(workshop),会议内容包括血小板抗体筛选和特异性鉴定,抗体效价测定,各类抗体检测技术、方法、流程、试剂等的比较和评价,疑难HPA基因分型,以及实验室间评价等。我国亦举办了包括南宁、广州、杭州等地血站在内的30余家国际性血小板免疫学实验室参与的第14届研讨会,有效提高了我国血小板抗原、抗体研究和应用水平[17]。
无



























