
探讨人多能干细胞(hPSC)、人脐血CD34+造血干/祖细胞与人白血病细胞系THP-1这3种来源巨噬细胞表型分子及其不同极化状态下炎症细胞因子mRNA相对表达水平,确定这3种来源巨噬细胞的功能。
选择上述3种来源巨噬细胞,包括hPSC与AGM-S3基质细胞共培养来源巨噬细胞、人脐血CD34+造血干/祖细胞来源巨噬细胞、THP-1来源巨噬细胞为研究对象。对其研究内容包括:①形态观察,并且进行麦格-姬姆萨(MGG)复合染色分析,判断巨噬细胞是否成功获得。②采用流式细胞术对其表型分子进行检测。③在脂多糖、白细胞介素(IL)-4刺激下,通过荧光定量PCR方法检测不同刺激物作用下其各种炎症细胞因子mRNA的相对表达水平,确定3种来源巨噬细胞的极化功能。采用独立样本t检验比较3种来源巨噬细胞不同刺激物作用下各种炎症细胞因子mRNA的相对表达水平。
①根据细胞形态学观察及MGG复合染色结果,3种来源巨噬细胞均成功获得。②流式细胞术检测结果显示,3种来源巨噬细胞均表达髓系相关表型分子CD45、人类白细胞抗原(HLA)-Ⅱ、CD36与CD11b。另外,THP-1来源巨噬细胞仅表达巨噬细胞相关分子CD64与CD11c,而hPSC与AGM-S3基质细胞共培养来源巨噬细胞与人脐血CD34+造血干/祖细胞来源巨噬细胞,均高表达巨噬细胞相关表型分子CD14、CD64、CD11c、CD68、CD86、CD206。③荧光定量PCR结果显示,hPSC与AGM-S3共培养来源巨噬细胞在脂多糖刺激3 h时,炎症细胞因子IL-1β、-6、-12β与肿瘤坏死因子(TNF)-α mRNA的相对表达水平达到峰值,分别为(14.69±0.24)、(305.50±67.26)、(10.91±1.48)、(128.31±9.90),均分别高于IL-4刺激3 h时的(0.75±0.14)、(2.66±0.27)、(0.54±0.04)、(0.89±0.08),并且差异均有统计学意义(t=85.630、7.798、12.128、22.295,P=0.000、0.001、0.000、0.000)。人脐血CD34+造血干/祖细胞来源巨噬细胞在脂多糖刺激9 h时,IL-1β、-6 mRNA的相对表达水平达到峰值,分别为(16.80±0.56)、(481.50±26.81),均分别高于IL-4刺激9 h时的(0.02±0.00)、(0.51±0.23),并且差异均有统计学意义(t=52.133、31.080,P=0.000、0.000);IL-12β与TNF-α mRNA相对表达水平在刺激3 h时达到峰值,分别为(56.48±3.78)、(11.12±0.76),均分别高于IL-4刺激3 h时的(3.53±0.46)、(0.33±0.18),并且差异均有统计学意义(t=24.090、24.010,P=0.000、0.000);THP-1来源巨噬细胞在脂多糖刺激3 h时,TNF-α mRNA的相对表达水平达到峰值,为(21 388.05±2 464.90),高于IL-4刺激3 h时的(143.89±5.30),并且差异有统计学意义(t=14.930,P=0.000);IL-1β、-6、-12β mRNA的相对表达水平在刺激9 h时达到峰值,分别为(4.33±0.01)、(14.53±3.79)、(525.56±34.65),均分别高于IL-4刺激9 h时的(0.48±0.08)、(0.01±0.00)、(1.03±0.26),并且差异均有统计学意义(t=82.710、6.640、26.220,P=0.000、0.003、0.000)。3种来源巨噬细胞在脂多糖刺激下,均可以形成M1型巨噬细胞。IL-4刺激9 h时,THP-1来源巨噬细胞IL-10 mRNA的相对表达水平为(262.79±20.18),显著高于脂多糖刺激的(1.71±0.02),并且差异有统计学意义(t=22.410,P=0.000)。于IL-4刺激下,仅THP-1来源巨噬细胞可以被有效极化形成M2型巨噬细胞,而其他2种来源巨噬细胞,均不能被有效极化形成M2型巨噬细胞。
3种不同来源巨噬细胞具有显著表型分子表达差异,hPSC与AGM-S3共培养来源巨噬细胞与人脐血CD34+造血干/祖细胞来源巨噬细胞,可以表达更多的巨噬细胞相关表型分子;而THP-1来源巨噬细胞缺失部分巨噬细胞相关表型分子表达,不能完全模拟体内巨噬细胞表型分子表达情况。hPSC与AGM-S3共培养来源巨噬细胞与人脐血CD34+造血干/祖细胞来源巨噬细胞在较短刺激下,即可以分化成M1型巨噬细胞,但是无明显M2型极化。THP-1可在不同刺激下极化成M1与M2型巨噬细胞,但是所需刺激时间较长。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人多能干细胞(human pluripotent stem cell,hPSC)包括人胚胎干细胞(human embryonic stem cell,hESC)与人诱导性多能干细胞(human induced pluripotent stem cell,hiPSC)[1]。这2种hPSC在细胞形态学、功能学方面均具有极大相似性,这2种细胞株的成功建立,为人类胚胎发育研究及其体外研究与hPSC的临床应用奠定了坚实基础。①hPSC可以体外诱导分化形成多胚层与组织。利用hPSC与基质细胞的共培养体系形成特定微环境,在体外诱导hPSC分化产生大量造血干/祖细胞,从而进一步增殖分化为各类血细胞。②本课题组前期研究报道,通过与小鼠AGM-S3基质细胞共培养,hPSC可以分化产生大量CD34+ CD45+造血干/祖细胞,添加不同种类细胞因子,有效诱导其分化产生功能成熟的巨噬细胞[2]。文献报道,利用人脐血CD34+造血干/祖细胞,亦可以在体外分化产生大量成熟巨噬细胞[3]。③THP-1为人白血病细胞系之一,1980年由Tsuchiya等从1例患有急性单核细胞白血病男性患儿外周血中分离获得[4],THP-1可以在佛波酯、维生素D3或者粒细胞-巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)刺激下分化成为单核巨噬细胞,分化获得的单核巨噬细胞与外周血单核细胞来源巨噬细胞功能相似[5]。上述3种途径均可以产生功能成熟的巨噬细胞,但是所产生巨噬细胞功能是否具有差异及偏向性,目前尚无相关研究报道。
本研究通过3种不同体外培养方法诱导分化获得巨噬细胞,①利用hPSC与AGM-S3基质细胞共培养方法,产生大量CD34+ CD45+造血干/祖细胞,通过添加不同种类细胞因子,于体外定向分化产生巨噬细胞[2];②分离提取人脐血CD34+造血干/祖细胞,添加不同细胞因子,于体外定向分化产生巨噬细胞;③THP-1在佛波酯刺激下,于体外定向分化产生的巨噬细胞。将上述3种体外诱导分化来源巨噬细胞,进行表型分子及不同极化条件下炎症细胞因子表达情况比较,旨在研究3种来源巨噬细胞的功能差异,为研究巨噬细胞相关功能及其与疾病关系建立有效的细胞模型。现将研究结果报道如下。
hPSC细胞株H1购自Wicell研究所。人脐血来自四川新生命干细胞科技股份有限公司。THP-1细胞株受助于本单位陈利民教授课题组。
hPSC细胞株H1(P31)购自Wicell研究所;AGM-S3基质细胞取自日本C3H小鼠胚胎AGM区,1998年建立细胞系;人脐血来自四川新生命干细胞科技股份有限公司(批号:20170415-1);THP-1细胞株受助于本单位陈利民教授课题组。DMEM(批号:1897078,美国GIBCO公司);F12培养基(批号:1889164,美国GIBCO公司);IMDM(批号:1918614,美国GIBCO);α-MEM(批号:AC10248328,美国Hyclone公司);血清代替物(KnockOut™ serum replacement,KSR)(批号:1910326,美国GIBCO公司);L-谷氨酰胺(批号:1894162,美国GIBCO);非必须氨基酸(nonessential amino acid,NEAA)(批号:1916650,美国GIBCO);β-疏基乙醇(批号:01496DKV,德国Sigma公司);碱性成纤维细胞生长因子(fibroblast growth factor-basic,bFGF)(批号:0101BCE34,美国PeoroTech公司);青霉素/链霉素(penicillin/streptomycin,PS)(批号:1857814,美国Hyclone公司);胎牛血清(fetal bovine serum,FBS)(批号:P160305,美国BioTECH公司);抗坏血酸(ascorbic acid,AA)(批号:011M0140V,德国Sigma公司);转铁蛋白(transferrin,Tri)(批号:03256TRI,德国Sigma公司);血管内皮生长因子(vascular endothelial growth factor,VECF)(批号:D615BCO272,BBI生命科学公司);干细胞生长因子(stem cell growth factor,SCF)(批号:0708AFC34,美国PeoroTech公司);白细胞介素(interleukin,IL)-6(批号:0409AFC16,美国PeoroTech公司);IL-3(批号:213433,美国PeoroTech公司);Fms样酪氨酸激酶3配体(Fms-like tyrosine kinase 3 ligand,FLT3L)(批号:121245,美国PeoroTech公司);血小板生成素(thrombopoietin,TPO)(批号:324571,美国PeoroTech公司);M-CSF(批号:332456,美国PeoroTech公司);佛波酯(批号:16561-29-8,美国Gene Operation公司);脂多糖(批号:tlrl-b5lps,美国Invivogen公司);IL-4(批号:1276AFC34,美国PeoroTech公司);0.25%胰蛋白酶-乙二胺四乙酸二钠(ethylenediaminetetraacetic acid,EDTA)(批号:1868744,美国GIBCO公司);麦格-吉姆萨(May-Gr Giemsa)复合染色试剂(批号:HX43166304/HX61425824,德国Merck公司)。CD34-APC抗体(批号:6029660,美国BD公司);CD45-藻红蛋白(phycoerythrin,PE)抗体(批号:6081531,美国BD公司);7-氨基放线菌素D(7-aminoactinomycin D,7-AAD)(批号:6084701,美国BD公司);人类白细胞抗原(human leukocyte antigen,HLA)-Ⅱ-FITC抗体(批号:30413,美国BD公司);CD36-FITC抗体(批号:05605,美国BD公司);CD11b-APC抗体(批号:6217995,美国BD公司);CD14-PE抗体(批号:4205772,美国BD公司);CD64- APC抗体(批号:5093521,美国BD公司);CD11c-APC抗体(批号:5217539,美国BD公司);CD68-PE抗体(批号:4336586,美国BD公司);CD86-别藻蓝蛋白(allophycocyanin,APC)抗体(批号:4073675,美国BD公司);CD206-APC抗体(批号:5163829,美国BD公司)。淋巴细胞分离液(批号:17-1440-02,美国GE公司);CD34磁珠分选试剂盒(批号:17M86159,英国STEMCELL公司);PureLink™ RNA Micro试剂盒(批号:00430379,美国Invitrogen公司);iScript™ cDNA synthesis试剂盒(批号:64105847,美国Bio-Rad公司);FastStart Universal SYBR Green Master试剂盒(批号:18570700,美国Roche公司)。
超净工作台(美国LABCONCO公司)、细胞离心甩片机(美国Thermo公司)、CO2培养箱(美国Thermo公司)。普通光学显微镜(德国LEICA公司)、倒置相差显微镜(德国LEICA公司)、PCR仪(美国BioRad公司)、FACS Canto Ⅱ流式细胞仪(美国BD公司)。
hPSC与AGM-S3基质细胞共培养试验步骤如下。在普通光学显微镜下将常规培养条件下的hPSC克隆切割成小的克隆,接种至丝裂霉素C处理后的AGM-S3基质细胞上,采用维持培养液(DMEM与F12培养基比例为1∶1,其中包含20% KSR、1% L-谷氨酰胺、1% NEAA、0.000 8% β-疏基乙醇、5 ng/mL bFGF及0.5% PS)维持培养3 d。随后,将维持培养液更换为造血分化培养液(IMDM中包含10% FBS、1% NEAA、0.1% AA、0.007% Tri、20 ng/mL VEGF、0.000 8% β-疏基乙醇及0.5% PS),37 ℃,5% CO2继续培养16 d。更换为造血分化培养液后,于d10、d12、d14、d16收集hPSC与AGM-S3基质细胞共培养细胞,采用兔血清封闭,孵育流式细胞术检测CD34-APC抗体、CD45-PE抗体。通过FACScanton Ⅱ流式检测仪检测CD34+ CD45+造血干/祖细胞比例,采用Flowjo10软件(美国BD公司)分析数据。全部试验操作步骤均严格按照试剂、仪器说明书进行。
hPSC与AGM-S3基质细胞共培养来源巨噬细胞定向分化实验步骤如下。收集与AGM-S3基质细胞共培养3 d(共培养早期)与14 d的hPSC,分别以细胞密度为5×105 /mL重悬于巨噬细胞定向分化培养液(IMDM中包含10% FBS、20 ng/mL SCF、20 ng/mL IL-6、10 ng/mL IL-3、5 ng/mL FLT3L、5 ng/mL TPO、50 ng/mL M-CSF)中,悬浮培养7 d。随后,更换培养基为IMDM(包含10% FBS、50 ng/mL M-CSF),继续悬浮培养7 d,收集悬浮细胞备用。在倒置相差显微镜下观察hPSC与AGM-S3基质细胞共培养及定向分化过程中细胞形态变化。
采用淋巴分离液,通过密度梯度离心分离人脐血的单个核细胞。采用CD34+造血干/祖细胞磁珠分选试剂盒分选CD34+造血干/祖细胞。取少量分选前与分选后的人脐血单个核细胞,采用兔血清封闭,孵育流式细胞术检测CD34-APC抗体,以及7-AAD。通过FACS Canto Ⅱ流式细胞仪进行检测,确定分选前、后CD34+造血干/祖细胞百分率。采用Flowjo10软件分析数据。将分选、纯化后的CD34+造血干/祖细胞悬浮培养于巨噬细胞定性分化液,采用低吸附24孔细胞培养板,经过14 d二步法培养,定向分化,收集悬浮细胞[3]。在倒置相差显微镜下观察人脐血CD34+造血干/祖细胞的培养及定向分化过程中细胞形态变化。全部试验操作步骤均严格按照试剂、仪器说明书进行。
THP-1为悬浮细胞,以细胞密度为7×105/孔接到0.1%明胶预处理后的6孔细胞培养板中,5% CO2,37 ℃恒温细胞培养箱过夜培养。加入佛波酯刺激,使佛波酯含量为100 ng/mL,轻轻晃动培养板至液体混匀,5% CO2、37 ℃培养箱培养48 h[7,8,9]。待细胞贴壁后,弃上清液,加入新鲜DMEM继续培养24 h,普通光学显微镜下观察细胞形态,并收集细胞。在倒置相差显微镜下观察THP-1细胞系培养及定向分化过程中细胞形态变化。
收集上述3种来源巨噬细胞:hPSC与AGM-S3共培养来源巨噬细胞的收集时间为更换定向分化培养液d14,人脐血来源巨噬细胞为14 d二步法后,THP-1来源巨噬细胞为佛波酯诱导48 h。分别取1×104个巨噬细胞细胞均匀甩至载坡片上,自然风干。固定上述收集的3种来源巨噬细胞,进行MGG复合染色。MGG复合染色的具体步骤为:麦格染液预染色10 min后,缓慢加入Giemsa B液混匀,再染色2~3 min后,慢速冲洗掉染液,加入Giemsa A液染色20 min,慢速冲洗,自然风干,树脂封片,镜检、拍照、记录。普通光学显微镜下观察上述经MGG复合染色当的3种来源巨噬细胞并计数。
收集hPSC与AGM-S3基质细胞共培养来源巨噬细胞、人脐血CD34+造血干/祖细胞来源巨噬细胞,由于巨噬细胞比其他髓系细胞更容易贴壁,通过贴壁培养、纯化巨噬细胞。将纯化后2种来源巨噬细胞与THP-1分化后巨噬细胞收集,采用兔血清封闭,孵育流式细胞术检测抗体,包括CD45-PE抗体、HLA-Ⅱ-FITC抗体、CD36-FITC抗体、CD11b-APC抗体、CD14-PE抗体、CD64-APC抗体、CD11c-APC抗体、CD68-PE抗体、CD86-APC抗体、CD206-APC抗体。通过FACScanton Ⅱ流式检测仪检测3种来源巨噬细胞表型分子表达情况,采用Flowjo10软件分析数据。全部试验操作步骤均严格按照试剂、仪器说明书进行。
在3种来源巨噬细胞中,分别加入脂多糖(含量为100 ng/mL)与IL-4(含量为20 ng/mL),诱导细胞向M1与M2型巨噬细胞极化。收集刺激物作用前、后不同时间点(3、6、9、12 h)的巨噬细胞,采用PureLinkTM RNA Micro试剂盒提取细胞总RNA。巨噬细胞总RNA采用iScriptTM cDNA synthesis试剂盒通过PCR仪将RNA逆转录成cDNA。采用FastStart Universal SYBR Green Master试剂盒,通过荧光定量PCR检测M1、M2型巨噬细胞炎症细胞因子IL-1β、-6、-12β与肿瘤坏死因子(tumor necrosis factor,TNF)-α,IL-10 mRNA的相对表达水平,以管家基因GAPDH为内参照基因。荧光定量PCR所用引物,见表1。上述全部试验操作步骤均严格按照试剂、仪器说明书进行。通过计算2-ΔΔCt值得到炎症细胞因子基因的相对表达水平,其中,ΔΔCt=[目的基因的平均Ct值(检测样本)-管家基因的平均Ct值(检测样本)]-[目的基因的平均Ct值(对照组)-管家基因的平均Ct值(对照组)]。

荧光定量PCR引物序列
荧光定量PCR引物序列
| 引物名称 | 引物序列(5′-3′) | |
|---|---|---|
| IL-1β | ||
| 正向引物 | CAAGGCACAACAGGCTGCT | |
| 反向引物 | TCCTGGAAGGAGCACTTCATC | |
| IL-6 | ||
| 正向引物 | CAAATTCGGTACATCCTCGA | |
| 反向引物 | AATCCAGATTGGAAGCATCC | |
| IL-12β | ||
| 正向引物 | CATTGGACTCTCCGTCCTGCC | |
| 反向引物 | TGAGGACCACCATTTCTCCAGG | |
| TNF-α | ||
| 正向引物 | GGCAGTCAGATCATCTTCTCGA | |
| 反向引物 | TGGTTATCTCTCAGCTCCACGC | |
| IL-10 | ||
| 正向引物 | CTGCCTAACATGCTTCGAGA | |
| 反向引物 | TGGATCATCTCAGACAAGGC | |
| GAPDH | ||
| 正向引物 | GTCTCCTCTGACTTCAACAGCG | |
| 反向引物 | ACCACCCTGTTGCTGTAGCCAA | |
注:IL为白细胞介素,TNF为肿瘤坏死因子
本研究数据采用SPSS 13.0统计学软件包对所得数据进行统计学分析。采用Ssize软件,确定满足本研究统计检验的最小样本量。先进行计量资料的正态性检验、方差齐性检验;对呈正态分布炎症细胞因子IL-1β、-6、-12β与TNF-α,IL-10 mRNA相对表达水平等计量资料,以 ±s表示;对方差齐性2组计量资料比较,采用独立样本t检验。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
±s表示;对方差齐性2组计量资料比较,采用独立样本t检验。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
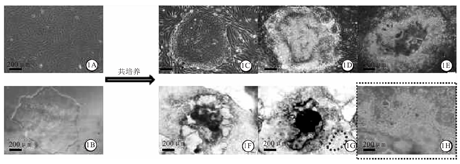
AGM-S3基质细胞(图1A)与hPSC(图1B)采用维持培养基共培养3 d时,hPSC克隆逐渐增大,但是未分化,边缘比较清晰(图1C)。然后,更换为造血分化培养液后,hPSC克隆逐渐分化、克隆边缘逐渐铺出;d3时,hPSC克隆边缘铺出面积增大(图1D);d6时,hPSC克隆边缘铺出部分出现血管样结构(图1E),d12时,可见在hPSC克隆边缘血管样结构沟壑中,出现鹅卵石样细胞(图1F)[6];d14时,hPSC克隆边缘出现大量鹅卵石样细胞(图1G),高倍镜下可以更清晰地观察到鹅卵石样细胞形态(图1H),即造血干/祖细胞。通过流式细胞术检测更换为造血分化培养液后,hPSC与AGM-S3基质细胞共培养d10(图2A)、d12(图2B)、d14(图2C)、d16(图2D)总细胞表面分子变化结果显示,共培养d10、d12、d16、d14时,CD34+ CD45+造血干、祖细胞比例分别为1.1%、8.6%、19.5%及36.8%。

注:hPSC为人多能干细胞


注:PE通道为561 nm激发光激发。hPSC为人多能干细胞,APC为别藻蓝蛋白,PE为藻红蛋白
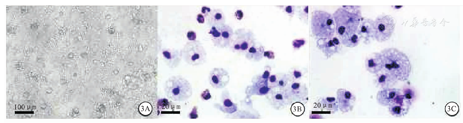
更换为定向分化培养液后,hPSC与AGM-S3基质细胞共培养14 d时部分细胞为悬浮细胞(图3A)。对悬浮细胞MGG复合染色结果显示,巨噬细胞占总细胞的比例约为45.5%(图3B)。贴壁、纯化后,悬浮细胞MGG复合染色结果显示,巨噬细胞占总细胞比例增高至90.0%(图3C)。由此成功获得hPSC与AGM-S3基质细胞共培养来源巨噬细胞。

注:hPSC为人多能干细胞,MGG为麦格-吉姆萨
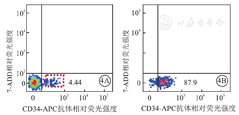
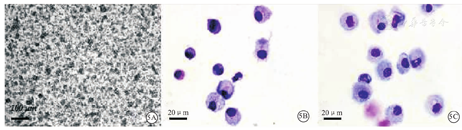
流式细胞术检测结果显示,人脐血单个核细胞经CD34+磁珠分选试剂盒分选前,CD34+造血干/祖细胞约占人脐血单个核细胞的7.0%(图4A);分选后,CD34+造血干、祖细胞比例达87.9%(图4B)。分选后CD34+造血干/祖细胞经14 d二步法定向分化后,总细胞呈悬浮培养状态(图5A);总细胞经MGG复合染色后,普通光学显微镜下计数结果显示,巨噬细胞占总细胞的百分率约为50.0%(图5B),经贴壁、纯化后,巨噬细胞占总细胞的百分率达91.0%(图5C)。由此成功获得人脐血CD34+造血干/祖细胞来源巨噬细胞。

注:7-ADD为7-氨基放线菌素D,APC为别藻蓝蛋白

注:MGG为麦格-吉姆萨
THP-1细胞经佛波酯诱导处理后,从悬浮状态(图6A)变为贴壁状态(图6B),此时获得的THP-1来源巨噬细胞处于M0型巨噬细胞,其具有单核巨噬细胞特性。普通光学显微镜下观察上述贴壁细胞的MGG复合染色结果显示(图6C),细胞均为单核细胞,相比hPSC与AGM-S3基质细胞共培养来源与人脐血CD34+造血干/祖细胞来源巨噬细胞,具有较大的细胞核,并且细胞核位于细胞中央,形态幼稚。
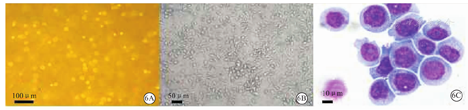

注:MGG为麦格-吉姆萨
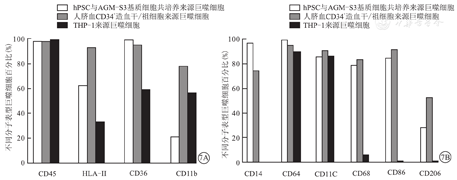
通过流式细胞术检测3种来源巨噬细胞表型分子结果显示,均表达髓系细胞相关表型分子CD45、HLA-Ⅱ、CD36与CD11b(图7A)。另外,THP-1来源巨噬细胞还表达巨噬细胞相关分子CD64与CD11c,而hPSC与AGM-S3基质细胞共培养来源巨噬细胞与人脐血CD34+造血干/祖细胞来源巨噬细胞,均高表达巨噬细胞相关表型分子CD14、CD64、CD11c、CD68、CD86、CD206(图7B)。3种来源巨噬细胞表型分子CD14、CD64、CD68的流式细胞术检测结果显示,THP-1来源巨噬细胞缺失部分巨噬细胞相关表型分子表达,不能完全模拟体内巨噬细胞表型分子表达情况,见图8。

注:hPSC为人多能干细胞
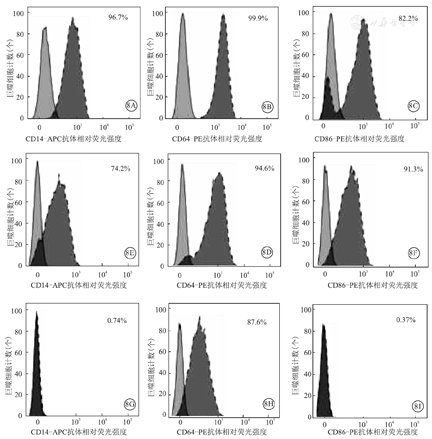

注:APC为别藻蓝蛋白,PE为藻红蛋白
荧光定量PCR结果显示,hPSC与AGM-S3共培养来源巨噬细胞在脂多糖刺激3 h时,促炎细胞因子IL-1β、-6、-12β及TNF-α mRNA相对表达水平,均已经达峰值,分别为(14.69±0.24)、(305.50±67.26)、(10.91±1.48)、(128.31±9.90),均分别高于IL-4刺激3 h时的(0.75±0.14)、(2.66±0.27)、(0.54±0.04)、(0.89±0.08),并且差异均有统计学意义(t=85.630、7.798、12.128、22.295,P=0.000、0.001、0.000、0.000)(图9A~D)。人脐血CD34+造血干/祖细胞来源巨噬细胞在脂多糖刺激9 h时,IL-1β、-6 mRNA相对表达水平达到峰值,分别为(16.80±0.56)、(481.50±26.81),均分别高于IL-4刺激9 h时的(0.02±0.00)、(0.51±0.23),并且差异均有统计学意义(t=52.133、31.080,P=0.000、0.000)(图9E、图9F);IL-12β与TNF-α mRNA相对表达水平在刺激3 h达到峰值分别为(56.48±3.78)、(11.12±0.76),均分别高于IL-4刺激3 h时的(3.53±0.46)、(0.33±0.18),并且差异均有统计学意义(t=24.090、24.010,P=0.000、0.000)(图9G、图9H)。THP-1来源巨噬细胞在脂多糖刺激3 h时,TNF-α mRNA相对表达水平达到峰值,为(21 388.05±2 464.90),高于IL-4刺激3 h时的(143.89±5.30),并且差异有统计学意义(t=14.930,P=0.000)(图9L);IL-1β、-6、-12β mRNA相对表达水平在刺激9 h时达到峰值,分别为(4.33±0.01)、(14.53±3.79)、(525.56±34.65),均分别高于IL-4刺激9 h时的(0.48±0.08)、(0.01±0.00)、(1.03±0.26),并且差异均有统计学意义(t=82.710、6.640、26.220,P=0.000、0.003、0.000)(图9I~K)。由此可见,3种来源巨噬细胞在脂多糖刺激下,均可以形成M1型巨噬细胞。
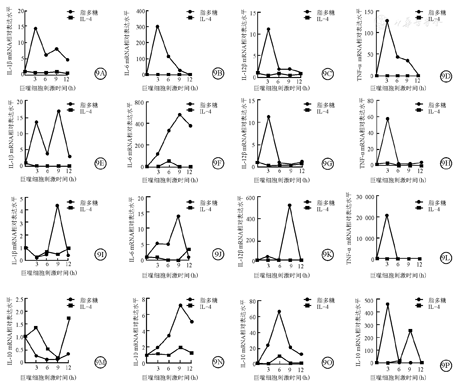

注:hPSC与AGM-S3共培养来源巨噬细胞在脂多糖刺激3 h时,IL-1β、-6、-12β,TNF-α mRNA相对表达水平均分别高于IL-4刺激3 h时,并且差异均有统计学意义(t=85.630、7.798、12.128、22.295,P=0.000、0.001、0.000、0.000)。人脐血CD34+造血干/祖细胞来源巨噬细胞在脂多糖刺激9 h时,IL-1β、-6 mRNA相对表达水平,均分别高于IL-4刺激9 h时,并且差异均有统计学意义(t=52.133、31.080,P=0.000、0.000);IL-12β与TNF-α mRNA相对表达水平在脂多糖刺激3 h时,均分别高于IL-4刺激3 h时,并且差异均有统计学意义(t=24.090、24.010,P=0.000、0.000)。THP-1来源巨噬细胞在脂多糖刺激3 h时,TNF-α mRNA相对表达水平高于IL-4刺激3 h时,并且差异均有统计学意义(t=14.930,P=0.000);IL-1β、-6、-12β mRNA相对表达水平在脂多糖刺激9 h时,均分别高于IL-4刺激9 h时,并且差异均有统计学意义(t=82.710、6.640、26.220,P=0.000、0.003、0.000)。hPSC与AGM-S3共培养早期来源巨噬细胞与THP-1来源巨噬细胞,分别在IL-4刺激3、9 h时,IL-10 mRNA相对表达水平显著高于脂多糖刺激3、9 h时,并且差异统计学意义(t=10.520、22.410,P=0.000、0.000)。hPSC与AGM-S3共培养来源巨噬细胞与人脐血CD34+造血干/祖细胞来源巨噬细胞在IL-4刺激9、6 h时,IL-10 mRNA相对表达水平均低于脂多糖刺激下9、6 h时,并且差异均有统计学意义(t=-39.150、-15.690,P=0.000、0.000)。hPSC为人多能干细胞,IL为白细胞介素,TNF为肿瘤坏死因子
hPSC与AGM-S3共培养早期(d3时)来源巨噬细胞与THP-1来源巨噬细胞,分别在IL-4刺激3、9 h时,IL-10 mRNA相对表达水平为(1.36±0.16)、(262.79±20.18),显著高于脂多糖刺激的(0.26±0.09)、(1.71±0.02),并且差异具有统计学意义(t=10.520、22.410,P=0.000、0.000)(图9M、图9P)。这说明,IL-4刺激可以有效刺激hPSC与AGM-S3共培养早期来源巨噬细胞与THP-1来源巨噬细胞形成M2型巨噬细胞。hPSC与AGM-S3共培养来源巨噬细胞在IL-4刺激9 h时,IL-10 mRNA相对表达水平达到峰值,为(1.90±0.13),低于脂多糖刺激下相同时间的峰值(7.19±0.20);人脐血CD34+造血干/祖细胞来源巨噬细胞在IL-4刺激6 h时,IL-10 mRNA相对表达水平达到峰值,为(10.46±0.68),低于脂多糖刺激6 h时的峰值(67.09±6.21),并且差异均具有统计学意义(t=-39.150、-15.690,P=0.000、0.000)(图9N、图9O)。这说明,这2种来源巨噬细胞,均不能被IL-4刺激产生M2型巨噬细胞。
hPSC体外维持培养与诱导分化实验技术逐渐成熟,利用hPSC体外诱导分化产生功能血细胞进行实验研究,不仅为探索人类早期血细胞的发育机制提供独特模式,亦为临床相关疾病发生机制及筛选新型治疗药物的研究奠定基础。利用hPSC形成拟胚体(embryonic body,EB)或者采用AGM、OP9等基质细胞共培养等方法,体外诱导分化产生巨噬细胞。本课题组前期工作通过hPSC与AGM-S3基质细胞共培养体系,建立了1种体外高效诱导产生巨噬细胞的方法[2],流式细胞术检测结果证实,诱导获得的细胞具有成熟巨噬细胞表型分子表达。在脂多糖刺激下,CD80表达水平显著增高,提示其具有成熟的巨噬细胞功能[2]。目前对于hPSC来源巨噬细胞研究局限于培养方法的建立与完善,少有与其他来源巨噬细胞功能比较的文献报道。本研究通过比较hPSC与AGM-S3基质细胞共培养、人脐血CD34+造血干/祖细胞与THP-1这3种来源巨噬细胞膜表型分子表达与极化功能,阐明不同来源巨噬细胞特性,为临床研究相关疾病的发生及治疗提供有效的细胞模型。
巨噬细胞形态多为单核不分叶,细胞膜表面分布多种CD分子,可以与补体、抗体及其他免疫细胞进行结合,为固有免疫系统效应细胞之一,具有吞噬、杀伤等重要细胞免疫功能[10]。机体内巨噬细胞根据免疫功能不同被分为2类:①经典活化巨噬细胞(M1型),由脂多糖或者γ干扰素激活,释放促炎细胞因子,例如IL-1、-12与TNF-α等,在辅助性T淋巴细胞(helper T lymphocyte,Th)1型免疫应答中,作为诱导细胞与效应细胞参与杀伤病原体与肿瘤细胞[11];②选择活化巨噬细胞(M2型),由IL-4与-13激活,释放抗炎细胞因子,以IL-10为主,介导组织修复及体液免疫应答[12]。目前研究M1与M2型巨噬细胞极化功能的实验体系多依赖单核/巨噬细胞系,例如THP-1、U937(组织细胞淋巴瘤细胞系)、ML-2(急性髓单核细胞白血病细胞系)、Mono Mac6(单核细胞白血病细胞系)等[13]。其中,THP-1来源巨噬细胞与外周血单个核来源巨噬细胞的功能相似度最高,因此THP-1作为研究巨噬细胞表型分子及极化功能的重要细胞模型[14,15]。
本研究实验结果提示,THP-1来源巨噬细胞缺失部分表型分子表达,例如CD14、CD68、CD86与CD206,不能完全有效模拟体内巨噬细胞功能相关表型分子表达情况。hPSC与AGM-S3基质细胞共培养来源巨噬细胞与人脐血CD34+造血干/祖细胞来源巨噬细胞具有相似表型分子表达,共同高表达巨噬细胞功能分子CD14、CD64、CD68、CD86与CD206等。采用脂多糖与IL-4对不同来源巨噬细胞进行刺激,提取细胞总RNA,利用荧光定量PCR技术检测各种炎症细胞因子mRNA的相对表达水平,为确定巨噬细胞属于M1型极化或者M2型极化状态,提供了1种准确、耗时较短、成本较低的检测方法。这不同于其他课题组通过商业化细胞因子检测试剂盒(Procarta Cytokine Assay Kit),或者利用Luminex xMAP多重分析技术对各种细胞因子进行的检测[16,17,18,19,20]。后面2种检测方法成本较高,需要专业仪器设备,并且耗时长。在脂多糖刺激下,本组3种来源巨噬细胞均可以有效极化成M1型巨噬细胞,并且高表达各种促炎细胞因子。通过于不同时间点检测细胞RNA水平,发现促炎细胞因子释放具有连续性。
随着基因重编程技术的发展,体外体细胞诱导形成的hiPSC具有广泛应用前景。由于hiPSC不涉及医学伦理,并且不存在免疫排斥等问题,所以在医学临床领域具有更广泛的前景。通过基因重编程技术,将患者体细胞诱导成hiPSC,利用共培养体系诱导成具有成熟功能的巨噬细胞,既可以作为疾病研究的细胞模型,有助于了解疾病的发生、发展,亦为相关精准化、个体化治疗奠定基础。hPSC与AGM-S3基质细胞共培养来源与人脐血CD34+造血干/祖细胞来源成熟巨噬细胞,不能被IL-4有效刺激极化成M2型巨噬细胞,说明这2种来源巨噬细胞功能具有偏向M1型巨噬细胞的特性。研究发现,hPSC与AGM-S3共培养早期(共培养d3)细胞,亦可以定向分化成巨噬细胞,此群巨噬细胞的产生,不依赖CD34+ CD45+造血干/祖细胞,基于前期研究发现,hPSC与AGM-S3共培养体系在培养10 d时,才开始出现CD34+ CD45+造血干/祖细胞[2]。以上研究结果说明,hPSC与AGM-S3基质细胞共培养早期来源巨噬细胞,具有特有的发育途径。此种巨噬细胞在IL-4的作用下,3 h即可以有效被极化成M2型巨噬细胞,说明此种巨噬细胞具有偏向M2型巨噬细胞的独特功能(图10A)。
近年随着对造血发生过程的深入研究,各国课题组相继报道小鼠体内巨噬细胞发育存在不依赖成体造血干/祖细胞的独特路径,此群巨噬细胞来源于卵黄囊,可以分布在小鼠各种组织中,以组织型巨噬细胞存在,并具有M2型巨噬细胞的极化功能[21,22,23,24,25,26,27]。hPSC早期巨噬细胞的发现及功能研究,提示人体中同样存在类似的独特发育途径。hPSC/AGM-S3基质细胞共培养体系的建立,有效地模拟了人胚胎造血的发生过程,为进一步研究人类胚胎早期发育建立体外模型提供了参考。本研究3种不同来源巨噬细胞诱导分化方法的建立,或许可为探索早期自然免疫细胞的功能提供参考。
无



























