
分析费城染色体阳性急性淋巴细胞白血病(Ph+ALL)成年患者诱导治疗的疗效与预后影响因素。
选择2013年11月至2018年11月山西医科大学第二医院血液科收治的52例初诊Ph+ALL患者为研究对象。根据诱导治疗方法的不同,将其分为化疗联合酪氨酸激酶抑制剂(TKI)组(n=33)和单纯化疗组(n=19)。采用回顾性分析方法,收集52患者的完全缓解(CR)率、未完全缓解(NR)率、复发率、总体预后,以及分析Ph+ ALL成年患者预后的影响因素。随访时间截至2018年11月30日。2组患者CR率的组间比较采用χ2检验。采用Kaplan-Meier法进行生存分析。采用Log-rank检验对不同性别、年龄与肝、脾大及白细胞计数等预后影响因素进行单因素分析。将单因素分析结果中有统计学意义,以及有临床指导意义的影响因素,纳入Cox比例风险回归模型进行多因素分析。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,所有患者在治疗前均被告知病情及可能出现的不良反应,与患者常规签署化疗知情同意书。
①本研究52例初诊Ph+ALL患者接受4周诱导治疗后,获得CR患者为36例(69.2%), NR者为16例(30.8%)。4周诱导治疗后,化疗联合TKI组患者的CR率为83.3% (30/33),高于单纯化疗组的16.7%(6/19),并且差异有统计学意义(χ2=17.237,P<0.001)。②本研究52例Ph+ALL患者的复发率为69.2%(36/52),中位复发时间为9个月(1~49个月)。③本研究52例Ph+ALL患者截至随访结束,中位生存时间为11个月(4~52个月),1年总体生存(OS)率为42.3%,1年无事件生存(EFS)率为32.8%。④单因素分析结果显示,联合使用TKI患者的中位EFS率和OS率分别为11.0%(95%CI: 9.3%~12.7%)和11.0%(95%CI: 10.1%~11.8%),高于未联合使用TKI者的6.0%(95%CI: 5.0%~7.0%)和9.0%(95%CI: 7.6%~10.4%),并且差异均有统计学意义(χ2=19.021,P<0.001;χ2=11.894,P<0.001)。诱导化疗4周达CR患者的中位EFS率和OS率分别为10.0% (95%CI: 7.7%~12.4%)和11.0% (95%CI: 10.3%~11.9%),高于未达CR者的6.0% (95%CI: 4.7%~7.3%)和9.0% (95%CI: 7.0%~11.0%),并且差异亦均有统计学意义(χ2=15.447,P<0.001;χ2=11.139,P=0.001)。⑤Cox多因素分析结果显示,联合使用TKI是Ph+ ALL患者EFS率(HR=0.370,95%CI:0.157~0.872,P=0.023)和OS率(HR=0.321,95%CI:0.156~0.660,P=0.002)的独立保护因素。
Ph+ALL成年患者诱导治疗中联合使用TKI,可能提高患者诱导治疗疗效,改善患者预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
费城染色体(Philadelphia,Ph),即t(9;22)(q34;q11)染色体易位,形成BCR/ABL融合基因。费城染色体阳性急性淋巴细胞白血病(Philadelphia chromosome-positive acute lymphoblastic leukemia,Ph+ALL)是成年人ALL较常见类型,发生率占后者的25%~30%,该类患者预后通常较差,5年生存率约为10%~20%,中位生存期仅为8个月[1]。酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKI)为Ph+ ALL患者提供新治疗策略。研究结果显示,应用TKI治疗Ph+ ALL患者的完全缓解(complete remission,CR)率达90%~100%,总体生存(overall survival,OS)率达40%~60%[2,3]。笔者对2013年11月至2018年11月山西医科大学第二医院血液科收治的52例Ph+ ALL患者的临床特征、生物学特征、治疗方案等病例资料,进行回顾性分析,旨在探讨影响Ph+ ALL患者预后的因素。现将研究结果报道如下。
选择2013年11月至2018年11月山西医科大学第二医院血液科收治的52例初诊Ph+ ALL患者为研究对象。其中,男性患者为24例,女性为28例;年龄≥35岁者为33例,<35岁为19例,中位年龄为40岁(13~74岁);初诊时外周血白细胞计数≥30×109/L者为27例,<30×109/L者为25例;中位白细胞计数为31.7×109/L[(0.4 ~445.7)×109/L];中位血红蛋白水平为91.8 g/L(37.1~162.0 g/L);中位血小板计数为36.5×109/L[(3.0~172.0)×109/L];伴肝、脾大者为25例,未伴者为17例;中位骨髓原始细胞比例为92.0%(40.0%~98.5%);免疫表型检测结果系普通型B-ALL患者为48例,系前体B-ALL为4例;髓系抗原表达患者为31例,不表达髓系抗原为21例;染色体核型检测结果系单纯t(9;22)患者为41例,伴附加染色体异常(additional chromosomal abnormalities,ACA)者为11例;BCR/ABL融合基因检测结果系单纯P190阳性者为40例,单纯P210阳性者为12例;伴中枢神经系统白血病(central nervous system leukemia,CNSL)者为11例,未伴者为41例。本研究纳入标准:①依据骨髓细胞形态学、免疫分型、细胞遗传学及分子遗传学(morphology, immunology, cytogenetics, molecular genetics,MICM)结果初次诊断为ALL,既往未接受相关治疗;②经细胞遗传学和(或)分子生物学检测结果显示Ph染色体和(或)BCR/ABL融合基因呈阳性。排除标准:①发生慢性髓细胞白血病急淋变者;②临床资料不全者。根据诱导治疗方法的不同,将研究对象分为化疗联合TKI组(n=33)和单纯化疗组(n=19)。2组患者的年龄、性别构成比等一般临床资料比较,差异无统计学意义(P>0.05)。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,所有患者在治疗前均被告知病情及可能出现的不良反应,与患者常规签署化疗知情同意书。
本研究Ph+ ALL的诊断及分型标准依据《血液病诊断及疗效标准》(第三版)[4]。
本研究化疗联合TKI组患者采用VCDP±L(长春地辛+环磷酰胺+多柔比星+泼尼松±门冬酰胺酶)方案为主的化疗联合伊马替尼作为诱导治疗方法。其具体药物剂量为:长春地辛(批号:1707020、180324d等,杭州民生药业有限公司)1.5 mg/(m2·d),d1、8、15、22使用;环磷酰胺(批号:9C292A、7H0590等,百特国际有限公司)750 mg/(m2·d),d1、15使用;多柔比星(批号:037180909、037180101、037170901等,山东新时代药业有限公司)40 mg/(m2·d),d1~3、15~16使用;泼尼松(批号:CP170619A、CP180134A等,天津天药有限公司)60 mg/(m2·d),d1~28使用;门冬酰胺酶(批号:670801、680401等,广州白云山医药有限公司)6 000 U/(m2·d),d18~28使用;伊马替尼(批号:WN549、WN817、S0171,瑞士诺华公司) 400~600 mg/d,确诊后即开始持续使用。以28 d(4周)为诱导治疗时间。单纯化疗组患者仅采用以VCDP±L方案为主的化疗进行诱导治疗,具体药物剂量与化疗联合TKI组相同。
对经诱导治疗获得CR的患者,继续进行巩固强化治疗。巩固强化治疗方案为TKI联合由长春碱类药物、蒽环类药物、糖皮质激素、大剂量甲氨蝶呤、阿糖胞苷、6-巯嘌呤等组成的多药联合化疗方案,并以序贯、交替方式进行。所有患者治疗过程中,均采用鞘内注射甲氨蝶呤+阿糖胞苷+地塞米松预防CNSL。
本研究2组患者诱导治疗疗效评估在诱导治疗4周后进行。疗效评估标准参考《中国成人急性淋巴细胞白血病诊断与治疗指南》(2016版)[5],将患者疗效分为CR和未完全缓解(no complete remission,NR)。OS期定义为确诊日至死亡或随访截止时间。无事件生存(event-free survival,EFS)期定义为确诊日至发生疾病进展、复发、死亡或随访截止等任何事件的时间。
本研究观察指标包括Ph+ ALL患者CR率、NR率、复发率,以及OS率、EFS率等。
通过查阅住院病历、门诊复诊资料或电话、微信等方法,获取生存情况、生存时间、疾病进展时间。随访频率:诱导治疗结束后第14天、第28~35天各随访1次,巩固治疗结束后每个月随访1次,维持治疗结束后每3个月随访1次。随访时间截至2018年11月30日。
本研究所得数据采用SPSS 21.0统计学软件进行统计分析。化疗联合TKI组和单纯化疗组患者的CR率、NR率、复发率等计数资料采用百分比(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制52例患者的OS及EFS曲线,OS率及EFS率采用M(95%CI)表示。采用Log-rank检验对影响Ph+ALL患者预后的因素进行单因素分析,纳入因素包括性别、年龄与肝、脾大及白细胞计数、原始细胞比例、髓系表达、染色体、融合基因类型、联合使用TKI、CNSL、诱导治疗4周获得CR。将单因素分析结果中有统计学意义,以及有临床指导意义的影响因素,纳入Cox比例风险回归模型进行多因素分析。本研究所有统计学检验均采用双侧检验,以P<0.05表示差异有统计学意义。
本研究52例初诊Ph+ ALL患者接受4周诱导治疗后,获得CR患者为36例(69.2%),NR者为16例(30.8%)。4周诱导治疗后,化疗联合TKI组患者CR率为83.3% (30/33),高于单纯化疗组的16.7%(6/19),并且差异有统计学意义(χ2=17.237,P<0.001)。
本研究52例Ph+ ALL患者的复发率为69.2%(36/52),中位复发时间为9个月(1~49个月)。52例患者经巩固强化治疗最终达CR后,49例(94.2%)患者继续接受巩固强化治疗,3例(5.8%)患者接受异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT),其中1例患者在移植6个月后死于移植物抗宿主病,其余2例患者获得长期生存,至随访截至时间,其生存时间分别为37和11个月。
本研究52例患者的中位生存时间为11个月(4~52个月),1年OS率为42.3%,1年EFS率为32.8%。本研究52例患者的1年OS曲线和EFS曲线,见图1,图2。
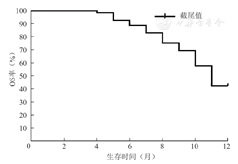

注:Ph+ALL为费城染色体阳性急性淋巴细胞白血病,OS为总体生存
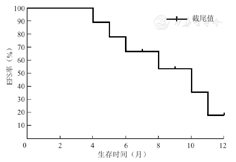

注:Ph+ALL为费城染色体阳性急性淋巴细胞白血病,EFS为无事件生存
单因素分析结果显示,联合使用TKI患者的中位EFS率和OS率分别为11.0%(9.3%~12.7%)和11.0%(10.1%~11.8%),高于未联合使用TKI者的6.0%(5.0%~7.0%)和9.0%(7.6%~10.4%),并且差异有统计学意义(χ2=19.021, P<0.001;χ2=11.894, P<0.001)。诱导化疗4周达CR患者的中位EFS率和OS率分别为10.0%(7.6%~12.4%)和11.0%(10.3%~11.9%),高于未达CR者的6.0%(4.7%~7.3%)和9.00%(7.0%~11.0%),并且差异亦有统计学意义(χ2=15.447,P<0.001;χ2=11.139,P=0.001)。不同性别、年龄与肝、脾大及白细胞计数、原始细胞比例、髓系表达、染色体异常、融合基因类型、CNSL等患者的EFS率和OS率分别比较,差异均无统计学意义因素(P>0.05)。影响Ph+ALL患者预后的单因素分析结果,见表3。
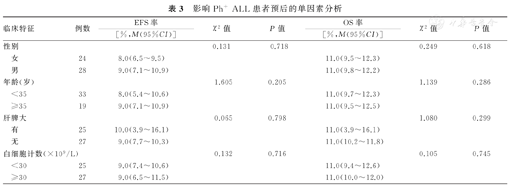
影响Ph+ ALL患者预后的单因素分析
影响Ph+ ALL患者预后的单因素分析
| 临床特征 | 例数 | EFS率 | χ2值 | P值 | OS率 | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| [%,M(95%CI)] | [%,M(95%CI)] | |||||||
| 性别 | 0.131 | 0.718 | 0.249 | 0.618 | ||||
| 女 | 24 | 8.0(6.5~9.5) | 11.0(9.5~12.3) | |||||
| 男 | 28 | 9.0(7.1~10.9) | 11.0(9.8~12.2) | |||||
| 年龄(岁) | 1.605 | 0.205 | 1.139 | 0.286 | ||||
| <35 | 33 | 8.0(5.4~10.6) | 11.0(9.7~12.3) | |||||
| ≥35 | 19 | 9.0(7.1~10.9) | 11.0(9.5~12.5) | |||||
| 肝脾大 | 0.065 | 0.798 | 1.080 | 0.299 | ||||
| 有 | 25 | 10.0(3.9~16.1) | 11.0(3.9~16.1) | |||||
| 无 | 27 | 9.0(7.7~10.3) | 11.0(10.2~11.8) | |||||
| 白细胞计数(×109/L) | 0.132 | 0.716 | 0.105 | 0.745 | ||||
| <30 | 25 | 9.0(7.4~10.6) | 11.0(9.4~12.6) | |||||
| ≥30 | 27 | 9.0(6.5~11.5) | 11.0(10.0~12.0) | |||||
| 原始细胞比例(%) | 0.841 | 0.359 | 1.708 | 0.191 | ||||
| <92 | 25 | 8.0(5.5~10.5) | 10.0(8.9~11.1) | |||||
| ≥92 | 27 | 9.0(7.3~10.7) | 11.0(8.7~12.2) | |||||
| 髓系表达 | 0.107 | 0.744 | 0.494 | 0.482 | ||||
| 有 | 31 | 8.0(6.5~9.6) | 11.0(10.2~11.7) | |||||
| 无 | 21 | 10.0(8.3~11.8) | 11.0(10.2~11.9) | |||||
| 染色体类型 | 0.002 | 0.961 | 0.254 | 0.614 | ||||
| 单纯Ph | 41 | 9.0(7.6~10.4) | 11.0(10.3~11.8) | |||||
| 复杂核型 | 11 | 8.0(2.6~13.4) | 10.0(9.8~12.1) | |||||
| 融合基因类型 | 0.153 | 0.696 | 0.035 | 0.851 | ||||
| P190 | 40 | 9.0(7.3~10.8) | 11.0(10.0~12.0) | |||||
| P210 | 12 | 8.0(5.5~10.6) | 11.0(9.3~12.7) | |||||
| 联合使用TKI | 19.021 | <0.001 | 11.894 | <0.001 | ||||
| 是 | 33 | 11.0(9.3~12.7) | 11.0(10.1~11.8) | |||||
| 否 | 19 | 6.0(5.0~7.1) | 9.0(7.6~10.4) | |||||
| 合并CNSL | 0.002 | 0.965 | 0.122 | 0.727 | ||||
| 是 | 11 | 9.0(5.0~13.1) | 11.0(9.3~12.7) | |||||
| 否 | 41 | 9.0(7.6~10.4) | 11.0(10.0~12.0) | |||||
| 诱导治疗4周获得CR | 15.447 | <0.001 | 11.139 | 0.001 | ||||
| 是 | 36 | 10.0(7.7~12.4) | 11.0(10.3~11.9) | |||||
| 否 | 16 | 6.0(4.7~7.3) | 9.0(7.0~11.0) | |||||
注:Ph+ ALL为费城染色体阳性急性淋巴细胞白血病,OS为总体生存,EFS为无事件生存,TKI为酪氨酸激酶抑制剂,CNSL为中枢神经系统白血病,CR为完全缓解
将单因素分析结果中有统计学意义的联合使用TKI、诱导治疗4周获得CR纳入Cox比例风险回归模型进行多因素分析的结果显示,联合使用TKI是Ph+ ALL患者EFS率(HR=0.370,95%CI:0.157~0.872,P=0.023)和OS率(HR=0.321, 95%CI:0.156~0.660,P=0.002)的独立保护因素(表4)。
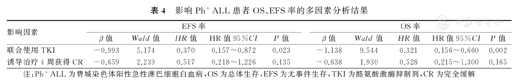
影响Ph+ALL患者OS、EFS率的多因素分析结果
影响Ph+ALL患者OS、EFS率的多因素分析结果
| 影响因素 | EFS率 | OS率 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| β值 | Wald值 | HR值 | HR值95%CI | P值 | β值 | Wald值 | HR值 | HR值95%CI | P值 | |
| 联合使用TKI | -0.993 | 5.174 | 0.370 | 0.157~0.872 | 0.023 | -1.138 | 9.544 | 0.321 | 0.156~0.660 | 0.002 |
| 诱导治疗4周获得CR | -0.659 | 2.239 | 0.517 | 0.218~1.226 | 0.135 | -0.638 | 1.930 | 0.528 | 0.215~1.300 | 0.165 |
注:Ph+ALL为费城染色体阳性急性淋巴细胞白血病,OS为总体生存,EFS为无事件生存,TKI为酪氨酸激酶抑制剂,CR为完全缓解
Ph+ ALL是成年人ALL的常见类型之一,占成年人ALL的25%~30%,儿童发生率<5%[1]。Ph+ ALL患者在治疗和预后方面具有常规化疗CR率低、缓解持续时间短、复发率高、OS期短、预后差等特点,常规诱导化疗后其CR率为50%~70%,5年OS率为10%~20%,中位OS期仅为8个月[2,3]。TKI应用于临床后,Ph+ ALL患者的CR率、OS率均较前显著提高,国外研究结果显示,应用TKI诱导治疗后,Ph+ALL患者的CR率提高至90%~100%,OS率达40%~60%[6,7,8]。张越峰等[7]回顾性分析117例Ph+ALL成年患者临床资料的研究结果显示,117例患者的总CR率为62%,中位OS期为9个月;16例采用TKI联合诱导化疗患者的CR率达83.1%,3年OS率为52.2%。本研究结果显示,52例初诊Ph+ALL患者经4周诱导治疗后,CR率为69.2%(36/52),3年OS率为21.2%。该结果低于上述研究结果,究其原因,可能与本研究中纳入的样本量小且接受移植患者的数量相对较少有关。
伊马替尼是第一代TKI,可以通过竞争性结合激酶区的三磷酸腺苷(adenosine triphophate,ATP)结合位点,从而抑制BCR/ABL融合基因自身和底物磷酸化,从而达到抑制肿瘤细胞的增殖、促进其细胞凋亡的治疗目的,为Ph+ALL患者的治疗带来新的选择和转机。一项英国大型临床研究对初诊Ph+ALL患者采用伊马替尼联合治疗或者多药物联合化疗的疗效进行分析,结果显示,伊马替尼组(n=89)患者CR率明显优于多药物联合化疗组(n=86)(92%比82%,P=0.004)[2]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐,伊马替尼联合诱导化疗方案为Ph+ALL患者的一线治疗方案,并且该方案可明显改善患者不良预后。国外一项临床研究对Ph+ALL患者采用VAD(长春新碱+阿霉素+地塞米松)方案、Hyper-CVAD(环磷酰胺+长春新碱+阿霉素+地塞米松)方案、Hyper-CVAD方案联合伊马替尼方案的疗效进行回顾性分析,结果显示,Hyper-CVAD方案联合伊马替尼方案组患者CR率为92%,显著高于VAD方案组的52%和Hyper-CVAD方案组的66%(P<0.05)[8]。Chalandon等[9]对45例Ph+ALL成年患者的疗效进行回顾性分析,比较伊马替尼联合VD(长春新碱+地塞米松)方案及伊马替尼联合Hyper CVAD强化疗方案的疗效,结果显示,伊马替尼联合VD方案患者的CR率显著优于联合Hyper CVAD组(100%比96%,P<0.05)。本研究结果显示,4周诱导治疗后,化疗联合TKI组患者CR率为83.3% (30/33),高于单纯化疗组的16.7%(6/19),并且差异有统计学意义(χ2=17.237,P<0.001)。这表明,TKI对Ph+ALL成年患者诱导治疗的疗效确切。
本研究中,Ph+ALL成年患者具有初诊时年龄≥35岁,初诊时白细胞计数较高,伴有肝、脾大,合并CNSL,免疫表型以普通型B-ALL为主,多伴髓系抗原表达,BCR/ABL融合蛋白以P190为主的临床特点。单因素分析结果显示,联合使用TKI患者的中位EFS率和OS率分别为11.0%(95%CI: 9.3%~12.7%)和11.0%(95%CI: 10.1%~11.8%),高于未联合使用TKI者的6.0%(95%CI: 5.0%~7.1%)和9.0%(7.6%~10.4%),并且差异有统计学意义(χ2=19.021,P<0.001;χ2=11.894,P<0.001);诱导化疗4周达CR患者的中位EFS率和OS率分别为10.0%(95%CI: 7.7%~12.4%)和11.0%(95%CI: 10.3%~11.9%),高于未达CR者的6.0%(95%CI: 4.7%~7.3%)和9.0%(95%CI: 7.0%~11.0%),并且差异亦有统计学意义(χ2=15.447,P<0.001;χ2=11.139,P=0.001)。这提示,联合使用TKI、诱导4周达CR的Ph+ALL患者的预后可能更佳。将单因素分析结果中有统计学意义的因素纳入多因素分析,结果显示,联合使用TKI是Ph+ALL患者预后的独立保护因素。这提示联合使用TKI作为Ph+ALL成年患者的诱导治疗方法,可能显著改善患者预后,延长其OS期。
Ph+ALL成年患者获得CR后,接受allo-HSCT是目前一线标准治疗方案,而TKI的应用极大提高可接受allo-HSCT患者比例。一项多中心随机对照试验纳入267例Ph+ALL患者,其中74例患者在获得CR1后接受allo-HSCT,结果显示,接受allo-HSCT者5年OS率为44%,显著高于未接受allo-HSCT者的19%[10]。Laport等[11]对79例Ph+ALL患者获得CR1后接受allo-HSCT的预后进行回顾性分析,结果显示,10年OS率和EFS率分别为54%和48%。一项纳入145例Ph+ALL患者的研究中,136例患者接受伊马替尼联合化疗诱导治疗后获得CR,其中77例患者接受allo-HSCT,56例患者接受伊马替尼维持治疗,4年随访结果显示,移植组和非移植组患者的累积复发率分别为23.6%和36.9%,无病生存率分别为62.4%和43.8%,OS率分别为76.1%和47.7%,2组比较,差异均有统计学意义(P<0.05)[12]。本研究获得CR患者中,3例患者接受allo-HSCT,其中1例患者在移植6个月后死于移植物抗宿主病,其余2例患者获得长期生存。但是,本研究纳入样本量较小,接受allo-HSCT患者数更少,因此Ph+ALL成年患者获得CR后接受allo-HSCT治疗的疗效及预后,仍需扩大样本量进一步研究证实。
综上所述,Ph+ALL成年患者预后较差,具有众多可能影响预后的相关因素。其中,联合使用TKI、诱导4周达CR可能对改善Ph+ALL患者生存、提高疗效具有一定作用。联合使用TKI是Ph+ALL成年患者预后的独立保护因素。对于诱导治疗获得CR患者,若进行allo-HSCT可能延长患者生存期。
所有作者均声明不存在利益冲突



























