
探讨山东省潍坊市RhD初筛结果呈阴性汉族无偿献血者的Rh血型表型及RHD基因多态性分布特点。
选择2015年3月至2017年7月,于潍坊中心血站参加无偿献血的1 307例RhD初筛结果呈阴性的汉族献血者为研究对象。其中,男性献血者为921例,女性为386例,年龄为18~55岁。采用血清学检测方法对1 307例RhD初筛结果呈阴性献血者的RhD阴性进行确认。血清学检测采用3个不同厂家的抗-D血型定型试剂和间接抗人球蛋白试验。对经血清学检测确认为RhD阴性的献血者,进行Rh血型表型分型,并且计算各RhCcEe的表型频率和单倍型频率。选择2015年9月至2016年3月参加无偿献血的116例RhD初筛结果呈阴性献血者进行RHD基因检测。RHD基因检测采用PCR-序列特异性引物(SSP)法和人类红细胞RHD基因分型试剂盒,并且进行基因多态性分析。Rh血型表型频率和单倍型频率,采用方根法计算。各Rh血型表型频率分布的Hardy-Weinberg遗传平衡检验采用χ2检验。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,并且与所有献血者签署临床研究知情同意书。
①本研究对1 307例RhD初筛结果呈阴性献血者的RhD阴性进行确认的结果显示,RhD阴性献血者为1 244例(95.2%),RhD变异型为63例(4.8%)。②本研究1 244例RhD阴性献血者中,ccee、Ccee、ccEe、CCee、CcEe、CCEe表型献血者分别为773例(62.14%)、329例(26.45%)、83例(6.66%)、40例(3.22%)、18例(1.45%)、1例(0.08%)。cde、CdE、Cde、cdE单倍型频率分别为78.83%、0.06%、16.99%和4.12%。经Hardy-Weinberg遗传平衡检验,本研究纳入的1 244例RhD阴性献血者的Rh血型表型频率观察值与期望值比较,差异无统计学意义(χ2=2.17,P>0.05)。③本研究116例RhD初筛结果呈阴性献血者的RHD基因分型结果显示,RHD外显子全部缺失基因型为77例(66.4%),RHD-CE(2-9)-D型为13例(11.2%),弱D15型为3例(2.6%),DEL RHD1227A纯合型为19例(16.4%),DEL RHD1227A杂合型为4例(3.5%)。
本研究初步探明本地区RhD阴性献血者的Rh血型表型及RHD基因分布特点,可为确保本地区Rh阴性血型患者的临床输血安全,并为Rh阴性稀有血型库建立,提供参考依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前已发现的36个血型系统中,Rh血型系统为遗传多态性最复杂的血型系统之一,其临床重要性仅次于ABO血型系统。人类Rh血型系统抗原不匹配,可能引起溶血性输血反应、新生儿溶血病等疾病。Rh血型系统中,编码D抗原的RHD基因位于人类染色体1p34.3-36.1,RHD基因的缺失、重组、突变等,引起D抗原的表达发生变异,产生D变异体。随着对RHD基因研究的深入,D变异体被分为部分D、弱D和Del型[1]。大部分弱D型变异引起的氨基酸改变,位于红细胞内或D抗原跨膜区,导致细胞膜表面D抗原的免疫原性减弱,但是不引起抗原表位缺失,不会产生抗-D[2,3]。部分D型变异体引起D抗原表位缺失,所以存在产生同种抗-D的风险[4]。Del型变异体红细胞表面存在极弱的D抗原,采用常规方法无法鉴定Del型,只能依靠敏感度较高的吸收放散试验检测红细胞表面的D抗原[5]。D抗原表达的多样性为RHD基因多态性的表现形式,通过对不同地区人群的RHD基因分子遗传学特征进行研究,可以了解该地区人群的D抗原分布情况,从而指导该地区临床输血,为临床输血安全提供保障。本研究拟就潍坊市1 307例RhD初筛结果呈阴性无偿献血者的Rh血型表型及RHD基因多态性分布特点进行分析、总结,旨在探讨本地区人群Rh血型表型及RHD基因型分布特征。现将研究结果报道如下。
选择2015年3月至2017年7月,于潍坊中心血站参加无偿献血的1 307例RhD初筛结果呈阴性的汉族献血者为研究对象。其中,男性献血者为921例,女性为386例,年龄为18~55岁。研究对象纳入标准:①汉族;②献血前体检及相关血液学检查结果,符合《献血者健康检查要求》(GB18467-2011)相关规定;③血清免疫球蛋白(immunoglobulin,Ig)M型抗-D初筛结果呈阴性者。排除标准:非自愿参加本试验者。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,并且与所有献血者签署临床研究知情同意书。
IgG抗-D血型定型试剂(批号:20151224,上海血液生物医药有限责任公司;批号:2015063010北京金豪制药有限责任公司);IgM+IgG抗-D血型定型试剂(批号:8000207508,荷兰三昆公司);抗-C血型定型试剂(批号:20153001,上海血液生物医药有限责任公司);抗-c血型定型试剂(批号:20153101,上海血液生物医药有限责任公司);抗-E血型定型试剂(批号:20153201,上海血液生物医药有限责任公司);抗-e血型定型试剂(批号:20153301,上海血液生物医药有限责任公司);血液基因组DNA提取试剂盒(离心柱型)[批号:4020,天根生化科技(北京)有限公司];人类红细胞RHD基因分型试剂盒(批号:201603012,天津市秀鹏生物技术开发有限公司)。ABI 9700型PCR扩增仪(新加坡ABI公司),BioPhotometer Plus型核酸蛋白测定仪(德国eppendorf公司),Syungene InGenius型凝胶成像仪(美国Gene公司),Universal 16R型低温高速台式离心机(德国Hettch公司)。
收集1 307例RhD初筛结果呈阴性献血者的新鲜抗凝全血样本,1 000×g离心5 min后,分离红细胞用于血清学检测。选择2015年9月至2016年3月参加无偿献血的116例RhD初筛结果呈阴性献血者的抗凝全血样本,1 000×g离心5 min后,分离白膜层,用于血液基因组DNA的提取,以及RHD基因分型检测。
采用3个不同厂家的抗-D血型定型试剂及间接抗人球蛋白试验,对1 307例献血者血液标本的D抗原进行确认。并且采用相应血型定型试剂对C、c、E、e抗原进行检测。根据血清学检测结果,对献血者Rh血型表型进行分型。血清学检测方法及结果判读,均按照《全国临床检验操作规程》(第4版)[6]标准进行。
采用血液基因组DNA提取试剂盒提取116例献血者白膜层样本的血液基因组DNA 80~100 μL,于-20 ℃保存。采用核酸蛋白测定仪测定提取DNA的浓度及纯度,要求DNA浓度为30~100 ng/μL,纯度为1.8~2.0。RHD基因分型采用PCR-序列特异性引物(sequence specific primer,SSP)法和人类红细胞RHD基因分型试剂盒,SSP由天津秀鹏生物技术公司设计,RHD基因特异性引物包被于RHD基因引物板中,每份DNA样本检测包括8孔特异性引物,内参照基因为人类生长激素(human growth hormone,HGH)基因,亦包被于每个引物孔中。PCR反应体系为11.1 μL,包括10 μL dNTP-buffer工作液、0.1 μL Taq酶、1 μL DNA标本。PCR反应程序为:96 ℃ 2 min,1个循环;96 ℃ 20 s,68 ℃ 60 s,5个循环;96 ℃ 20 s,65 ℃ 50 s,72 ℃ 45 s,10个循环;96 ℃ 20 s,62 ℃ 50 s,72 ℃ 45 s,18个循环;72 ℃ 25 min,1个循环;4 ℃保存。PCR反应完成后,将PCR扩增产物转移至2.5%琼脂糖凝胶孔中,140~150 V电泳15~20 min,使用凝胶成像仪观察电泳结果。阳性反应为同时出现内参照基因扩增条带和特异性扩增条带,阴性反应为只出现内参照基因扩增条带。根据人类红细胞RHD基因分型试剂盒(PCR-SSP法)结果分型表,判定DNA样本的RHD基因分型结果。
本研究1 307例RhD初筛结果呈阴性献血者的RhD阴性确认结果显示,RhD阴性献血者为1 244例(95.2%),RhD变异型为63例(4.8%)。
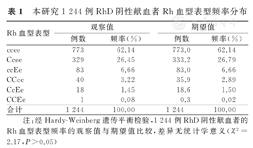
本研究1 244例RhD阴性献血者中,ccee表型献血者为773例(62.14%),Ccee为329例(26.45%),ccEe为83例(6.66%),CCee为40例(3.22%),CcEe为18例(1.45%),CcEe为1例(0.08%)(表1)。cde单倍体频率为78.83%,CdE为0.06%,Cde为16.99%,cdE为4.12%。经Hardy-Weinberg遗传平衡检验,本研究纳入的1 244例RhD阴性献血者Rh血型表型频率的观察值与期望值比较,差异无统计学意义(P>0.05),提示纳入献血者的Rh血型表型分布符合Hardy-Weinberg遗传平衡定律。
本研究1 244例RhD阴性献血者Rh血型表型频率分布
本研究1 244例RhD阴性献血者Rh血型表型频率分布
| Rh血型表型 | 观察值 | 期望值 | ||
|---|---|---|---|---|
| 例数 | 频率(%) | 例数 | 频率(%) | |
| ccee | 773 | 62.14 | 773.0 | 62.14 |
| Ccee | 329 | 26.45 | 333.2 | 26.79 |
| ccEe | 83 | 6.66 | 83.0 | 6.66 |
| CCee | 40 | 3.22 | 35.9 | 2.89 |
| CcEe | 18 | 1.45 | 18.6 | 1.50 |
| CCEe | 1 | 0.08 | 0.3 | 0.02 |
| 合计 | 1 244 | 100.00 | 1 244 | 100.00 |
注:经Hardy-Weinberg遗传平衡检验,1 244例RhD阴性献血者的Rh血型表型频率的观察值与期望值比较,差异无统计学意义(χ2=2.17,P>0.05)
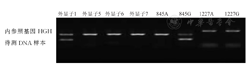
本研究116例RhD初筛结果呈阴性献血者RHD基因分型结果显示,RHD基因外显子全部缺失为77例(66.4%),RHD-CE(2-9)-D型为13例(11.2%),弱D15型为3例(2.6%),DEL RHD1227A纯合型为19例(16.4%),DEL RHD1227A杂合型为4例(3.5%)。RHD基因外显子全部缺失、RHD-CE(2-9)-D型、弱D15型、DEL RHD1227A纯和型、DEL RHD1227A杂合型献血者DNA样本的RHD基因分型电泳图,见图1,图2,图3,图4,图5。


注:HGH为人类生长激素

注:HGH为人类生长激素
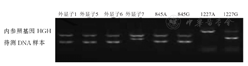

注:HGH为人类生长激素


注:HGH为人类生长激素
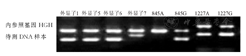

注:HGH为人类生长激素
Rh血型系统具有复杂的遗传多态性和免疫表型,Rh阴性血型的地域和种族分布不同存在较大差异,中国汉族人群Rh阴性血型比例约为0.4%,少数民族为1%~5%。Rh血型表型在不同地域、民族分布不同,研究C、c、E、e抗原分布频率,建立Rh阴性稀有血型库,可为不同血型表型Rh阴性血型患者的临床输血安全提供保障。我国华东、华北地区Rh阴性血型人群中,Rh血型表型分布以ccee、Ccee为主[8]。本研究针对潍坊市1 244例汉族RhD阴性献血者Rh血型表型的调查结果显示,Rh血型表型主要以ccee(62.14%)和Ccee(26.45%)为主,其他表型频率由高至低依次为ccEe(6.66%)、CCee(3.22%)、CcEe(1.45%)和CCEe(0.08%),未检出CCEE和CcEE表型。该研究结果提示,潍坊市汉族RhD阴性个体的Rh血型表型分布与济南[9]、石家庄[10]等地一致。而重庆[11]地区RhD阴性汉族献血者的ccee表型比例(49.92%)低于潍坊市;乌鲁木齐[12]地区RhD阴性维吾尔族献血者的ccee表型比例(86.11%)高于潍坊市。这表明,RhD血型表型分布具有地域、民族特点。
输血和妊娠是体内产生Rh血型抗体的主要原因,RhD阴性者多次输血或有妊娠史,其体内可能产生抗-C、-c、-E、-e,或者不同类型的复合抗体[13]。本研究结果显示,潍坊市RhD阴性献血者Rh血型表型有其分布特点。因此,本地区Rh阴性血型个体接受输血治疗前,应进行C、c、E、e抗原检测。从而避免受血者因输注Rh抗原不合血液,引起的输血反应。
我国RhD阴性个体RHD基因呈现出多态性,主要表现为RHD基因外显子全部缺失、部分缺失和不缺失[14]。本研究116例RhD初筛结果呈阴性献血者的RHD基因分型结果显示,RHD基因外显子全部缺失为77例(66.4%),RHD-CE(2-9)-D型为13例(11.2%),弱D15型为3例(2.6%),DEL RHD1227A纯合型为19例(16.4%),DEL RHD1227A杂合型为4例(3.5%)。该结果与新乡[1]、宁夏[15]地区分布相近。Del表型个体占我国Rh阴性血型汉族人群的20%~30%,并且多与DEL RHD1277A等位基因直接相关[16]。邵超鹏等[17]报道,在207例确认为RhD阴性的孕妇中,46例有妊娠史的Del表型孕妇,在生育RhD阳性胎儿后体内均未检出抗-D。章旭等[18]对确认为RhD阴性的1 030例献血者和89例孕妇进行Rh血型抗体筛选结果显示,10例献血者和5例孕妇体内检出抗-D,其DEL基因分型呈阴性,117例RhD阴性献血者中,24例为DEL基因型呈阳性,其抗-D呈阴性。若Del表型红细胞膜表面表达完整的D抗原,则其接触D抗原时不会产生同种抗体,即Del表型患者可以接受RhD阳性血液输注,并且当Del表型孕妇怀有RhD阳性胎儿时,可能不会发生新生儿溶血病,可以避免产前抗-D检测及抗-D免疫球蛋白的使用[17,18]。因此,在RhD阴性确认过程中,采用基因分型方法或者吸收放散方法鉴定出DEL基因型,尤为重要。
本研究通过对潍坊市1 307例RhD初筛结果呈阴性献血者的Rh血型表型及RhD基因多态性分布特点进行分析,初步探寻本地区Rh阴性血型个体RHD基因的分型特征,为Rh阴性血型的稀有血型队伍建设提供依据。同时,对本血站合理招募献血者及稀有血型库的建立提供了一定的数据支持。
所有作者均声明不存在利益冲突



























