
系统评价来那度胺治疗多发性骨髓瘤(MM)的疗效及其相关严重感染的发生风险。
采用计算机检索Pubmed、Embase、Cochrane图书馆临床对照试验数据库等英文数据库中,关于来那度胺治疗MM的疗效及其相关严重感染发生风险的随机对照试验(RCT)研究文献,其中研究组采用来那度胺或来那度胺联合地塞米松进行治疗,对照组采用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。由2位研究者按照本研究设定的文献纳入和排除标准独立筛选文献,评价纳入文献的质量并提取资料。将纳入文献通过改良后Jadad量表进行RCT质量评价。使用R3.3.1软件对来那度胺治疗MM的无病生存(PFS)期、总体生存(OS)期、严重感染发生率、呼吸道严重感染发生率、严重感染相对危险度进行Meta分析。
通过文献筛选,共计纳入符合本研究纳入标准的7篇RCT文献。共计纳入4 007例MM患者,其中研究组患者为2 117例,对照组患者为1 890例。7篇文献均为高质量RCT。Meta分析结果示:①与对照组相比,研究组3年PFS期显著延长(HR=0.54,95%CI:0.36~0.82, P=0.004),而3年OS期无明显受益(HR=0.84,95%CI:0.62~1.14, P=0.262)。②接受来那度胺治疗的MM患者严重感染率为6.67%~21.47%,总体发生率为14.01%(95%CI:11.01%~17.02%),呼吸道感染发生率为46%(95%CI:27%~65%)。与对照组相比,研究组来那度胺治疗MM患者相关严重感染发生风险增高(RR=1.92, 95%CI:1.59~2.33, P<0.000 1)。
来那度胺虽可使MM患者PFS期获益,但其对患者OS期无明显改善,并且所致的严重感染发生风险较高,尤其是呼吸道严重感染。在MM患者接受来那度胺治疗过程中,应对感染进行密切监测,以期实现来那度胺的优化治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(multiple myeloma,MM)是恶性浆细胞克隆增殖性肿瘤,好发于中老年人群。MM主要特征是克隆性浆细胞增殖,导致患者产生一系列靶器官功能异常和临床表现,包括贫血、肾功能损害、溶骨性病变、高钙血症和反复严重的感染等,影响患者的生存及预后。据统计,MM患者5年生存率未达50%[1],而感染是MM患者早期死亡的主要原因之一,约占45%[2]。因此,严重感染,甚至是致命性感染,仍然是临床治疗MM亟待解决的问题。
近年,免疫调节药物来那度胺在MM患者中应用广泛,显著改善MM患者的缓解率及生存率,但也使MM患者对病原微生物感染的易感性增加[3,4]。目前,已有多项临床试验报道了接受来那度胺治疗患者出现的各种感染事件,接受来那度胺治疗MM患者的感染率可高达20%,严重感染率达14%[5],但是由于上述研究样本量有限,并且国内、外尚缺乏相关Meta分析结果,故无法评估来那度胺治疗所致的感染与MM的相关性。因此,评估接受来那度胺治疗的MM患者的严重感染发生率和相对风险至关重要。本研究旨在应用系统评价的方法评估接受来那度胺治疗的MM患者的疗效及其相关严重感染的发生风险,以期为临床MM的治疗选择及感染预防提供依据。现将研究结果报道如下。
根据本研究设定的文献检索策略(检索范围、关键词、检索时间),采取计算机检索关于来那度胺治疗MM的疗效及其相关严重感染发生风险的随机对照试验(randomized clinical trial,RCT)文献,最终选择符合本研究纳入标准的RCT为研究对象。
本研究纳入文献的纳入标准包括以下方面。①研究内容:来那度胺治疗MM的疗效及其相关严重感染的研究;②研究类型:RCT,无论是否采用盲法、有无退出及失访;③受试对象:MM患者,年龄、国籍、性别不限;④干预措施:研究组采用来那度胺或来那度胺联合地塞米松进行治疗,来那度胺剂量为25 mg/d,对照组使用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。
本研究纳入文献的排除标准:①非RCT;②试验结果数据不全,研究设计不严谨;③重复发表的文献;④无对照组文献。
来那度胺治疗MM的疗效评价指标:3年总体生存(overall survival,OS)期,3年无进展生存(progression free survival,PFS)期。严重感染评价指标:美国国立癌症研究所常见不良反应评价系统(National Cancer Institute-Common Terminology Criteria for Adverse Events, NCI-CTCAE)或世界卫生组织(World Health Organization,WHO)分类系统分为3~5级的严重感染发生率、呼吸道严重感染发生率和严重感染的RR[3,4,5]。
本研究通过计算机检索Pubmed、Embase、Cochrane图书馆临床对照试验数据库等英文数据库。检索时间限定为2000-2019年。文献语种为英文。英文检索词包括:multiple myeloma,lenalidomide,clinical trial,randomized controlled trial,controlled clinical trial。
由2位研究者按照本研究制定的检索策略分别独立进行文献检索、浏览文献标题、摘要及全文内容,参照文献纳入与排除标准,判断文献是否被纳入分析,并按照预先设计的表格提取、填写资料。研究者若在文献筛选过程中出现意见分歧,则由富有相关经验的主任医师进行裁决。根据制定的表格,从文献中提取以下资料。①纳入研究的一般资料:题目、第一作者、发表年份、研究机构、文献来源;②研究特征:包括研究组及对照组纳入的病例数、治疗方法;③结局指标:中位年龄和结局指标(3年PFS、OS);④感染指标:治疗过程中各组发生严重感染(3~5级)事件的病例数及各感染部位的病例数。对纳入的RCT研究文献,根据改良后Jadad量表进行RCT质量评价。评价内容包括:随机序列的产生、随机化隐藏、盲法、撤出与退出,按照不恰当、不清楚、恰当分别计0、1、2分。若RCT研究文献评分为1~3分,则视为低质量研究;若RCT研究文献评分为4~7分,则视为高质量研究。
使用R3.3.1软件中Meta程序包对所有数据进行处理。用Metagen函数分析生存资料的效应量(3年PFS、OS),记录HR及其95%CI;用Metaprop函数对严重感染发生率和呼吸道严重感染发生率进行Meta分析,记录发生率及其95%CI;用Metabin函数分析严重感染事件的RR及其95%CI。纳入研究间异质性分析,采用Q检验和I2检验,I2值越大表示异质性越大。若纳入研究间的异质性分析结果为P≥0.1,I2≤50%,则表明各研究间异质性较小,采用固定效应模型;若P<0.1,I2>50%,则表明各研究间异质性较大,需对异质性来源进行分析,必要时行亚组分析或敏感性分析,若无法消除异质性,则选择随机效应模型进行Meta分析。使用R3.3.1软件,funnel函数绘制漏斗图,根据图形的不对称程度判断纳入文献的发表偏倚,若漏斗图对称性好则提示发表偏倚较小。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
按照本研究设定的文献检索策略,最初检索到来那度胺治疗MM的疗效及其相关严重感染的文献1 587篇。通过阅读文献标题、摘要、全文,按照设定的文献纳入及排除标准,最终纳入符合本研究文献共计7篇。本研究文献检索与筛选流程及结果,见图1。
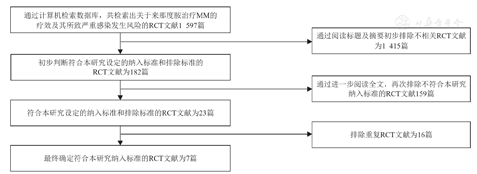

注:MM为多发性骨髓瘤,RCT为随机对照试验
本研究纳入的7篇文献中,共计纳入4 007例MM患者,其中研究组纳入患者为2 117例,对照组纳入患者1 890例。纳入文献的基本特征,见表1。
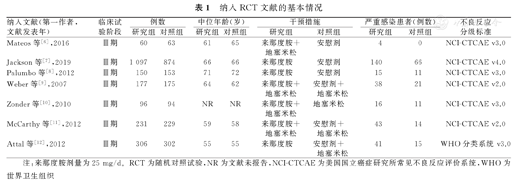
纳入RCT文献的基本情况
纳入RCT文献的基本情况
| 纳入文献(第一作者,文献发表年) | 临床试验阶段 | 例数 | 中位年龄(岁) | 干预措施 | 严重感染患者(例数) | 不良反应分级标准 | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 研究组 | 对照组 | 研究组 | 对照组 | 研究组 | 对照组 | 研究组 | 对照组 | |||
| Mateos等[6],2016 | Ⅲ期 | 60 | 63 | 61 | 65 | 来那度胺+地塞米松 | 安慰剂 | 4 | 0 | NCI-CTCAE v3.0 |
| Jackson等[7],2019 | Ⅲ期 | 1 097 | 874 | 66 | 66 | 来那度胺 | 安慰剂 | 140 | 66 | NCI-CTCAE v4.0 |
| Palumbo等[8],2012 | Ⅲ期 | 150 | 153 | 71 | 72 | 来那度胺 | 安慰剂 | 15 | 11 | NCI-CTCAE v3.0 |
| Weber等[9],2007 | Ⅲ期 | 177 | 175 | 64 | 62 | 来那度胺+地塞米松 | 安慰剂+地塞米松 | 38 | 21 | NCI-CTCAE v2.0 |
| Zonder等[10],2010 | Ⅲ期 | 96 | 94 | NR | NR | 来那度胺+地塞米松 | 地塞米松 | 16 | 11 | NCI-CTCAE v3.0 |
| McCarthy等[11],2012 | Ⅲ期 | 231 | 229 | 59 | 58 | 来那度胺+地塞米松 | 安慰剂+地塞米松 | 43 | 14 | NCI-CTCAE v2.0 |
| Attal等[12],2012 | Ⅲ期 | 306 | 302 | 55 | 55 | 来那度胺 | 安慰剂+地塞米松 | 41 | 15 | WHO分类系统v3.0 |
注:来那度胺剂量为25 mg/d。RCT为随机对照试验,NR为文献未报告,NCI-CTCAE为美国国立癌症研究所常见不良反应评价系统,WHO为世界卫生组织
根据Jadad评分量表评分标准,对纳入的7篇文献[6,7,8,9,10,11,12]进行质量评价的结果显示,Jadad量表评分总分系6分文献为1篇,5分文献为5篇,4分文献为1篇。上述文献均为高质量文献。纳入文献的质量评价结果,见表2。
本研究纳入7项RCT均对MM患者PFS期进行分析,其异质性检验结果显示,各项研究间存在异质性(P<0.01,I2=91%),故采用随机效应模型对来那度胺治疗MM患者PFS期的分析。与对照组相比,接受来那度胺治疗的研究组患者3年PFS期显著延长(HR=0.54,95%CI:0.36~0.82,P=0.004),见图2。这7项RCT研究组和对照组PFS期比较的发表偏倚检测结果显示,漏斗图散点分布不对称(图3),考虑可能存在发表偏倚。进一步对该组数据行敏感性分析结果显示,排除任何一个研究与排除前结果相比,均未发生较大变化(P<0.000 1),因此该组结果仍可信(表3)。
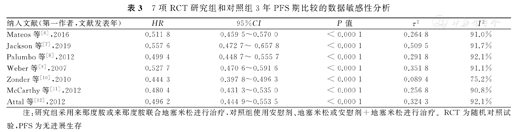
7项RCT研究组和对照组3年PFS期比较的数据敏感性分析
7项RCT研究组和对照组3年PFS期比较的数据敏感性分析
| 纳入文献(第一作者,文献发表年) | HR | 95%CI | P值 | τ2 | I2 |
|---|---|---|---|---|---|
| Mateos等[6],2016 | 0.511 8 | 0.459 5~0.570 0 | < 0.000 1 | 0.264 8 | 91.0% |
| Jackson等[7],2019 | 0.557 6 | 0.472 7~ 0.657 8 | < 0.000 1 | 0.509 5 | 91.7% |
| Palumbo等[8],2012 | 0.499 4 | 0.448 7~ 0.555 7 | < 0.000 1 | 0.291 8 | 92.1% |
| Weber等[9],2007 | 0.527 7 | 0.470 6~0.591 6 | < 0.000 1 | 0.351 8 | 91.1% |
| Zonder等[10],2010 | 0.444 3 | 0.397 8~0.496 3 | < 0.000 1 | 0.089 4 | 75.2% |
| McCarthy等[11],2012 | 0.480 4 | 0.431 3~0.535 0 | < 0.000 1 | 0.256 8 | 90.8% |
| Attal等[12],2012 | 0.496 2 | 0.444 9~0.553 5 | < 0.000 1 | 0.324 3 | 92.1% |
注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗,对照组使用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。RCT为随机对照试验,PFS为无进展生存
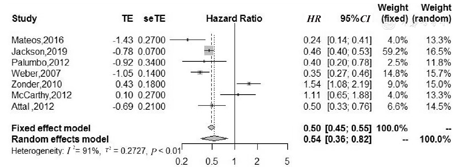

注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗,对照组使用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。MM为多发性骨髓瘤,PFS为无进展生存
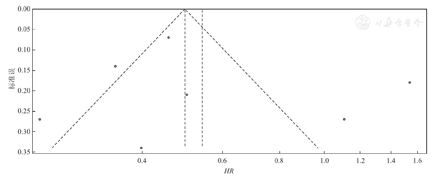

注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗,对照组使用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。RCT为随机对照试验,PFS为无进展生存
本研究纳入7项RCT研究均对MM患者的3年OS期进行分析,其异质性检验结果显示,各研究间存在异质性(P<0.01,I2=70%),使用随机效应模型评价。与对照组相比,研究组患者的3年OS期显著延长(HR=0.84,95%CI:0.62~1.14,P=0.262)。接受来那度胺与安慰剂/地塞米松治疗的MM患者的3年OS期比较的Meta分析,见图4。这7项RCT研究组和对照组3年OS期比较的发表偏倚检测结果显示,漏斗图基本对称(图5)
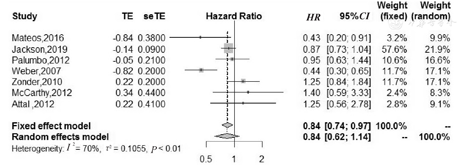

注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗,对照组使用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。MM为多发性骨髓瘤,OS为总体生存
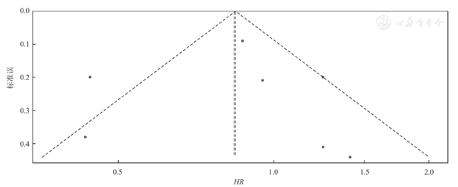

注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗,对照组使用安慰剂、地塞米松或安慰剂+地塞米松进行治疗。RCT为随机对照试验,OS为总体生存
本研究纳入的7项RCT均报道严重感染事件,其中,研究组患者共2 117例,发生严重感染的患者为297例,各项研究的严重感染率为6.67%~21.47%。各项研究间异质性检验结果显示,不同研究间存在异质性(P<0.01,I2=67%),故采用随机效应模型进行Meta分析。来那度胺治疗MM患者相关严重感染的总体发生率为14.01%(95%CI:11.01%~17.02%)。来那度胺治疗MM患者相关严重感染的Meta分析,见图6。7项RCT研究组严重感染发生率的发表偏倚检测结果显示,漏斗图基本对称(图7)。
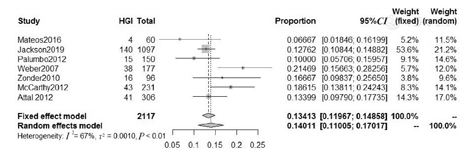

注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗。MM为多发性骨髓瘤

注:RCT为随机对照试验
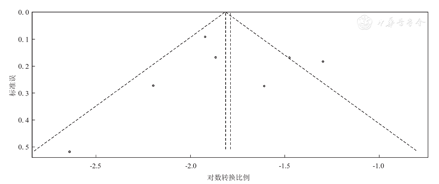
纳入的7项RCT中,有5项RCT报道感染部位。研究组严重感染患者为278例,其中呼吸道严重感染者为155例。异质性检验结果显示,各研究间存在异质性(P<0.01,I2=89%),选用随机效应模型进行Meta分析。通过对5项RCT数据汇总结果显示,接受来那度胺治疗后发生严重感染的MM患者中,呼吸道严重感染发生率为46%(95%CI:27%~65%)。来那度胺治疗相关呼吸道严重感染发生率的Meta分析,见图8。5项RCT的发表偏倚检测结果显示,漏斗图散点分布不对称(图9)。进一步对该组数据行敏感性分析结果示,排除任何一个研究结果,呼吸道严重感染发生率波动于40.6%~55.1%,与排除前相似,因此本组数据仍视为可靠。
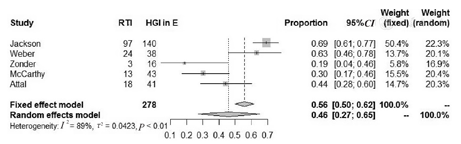

注:研究组采用来那度胺或来那度胺联合地塞米松进行治疗。MM为多发性骨髓瘤

注:RCT为随机对照试验
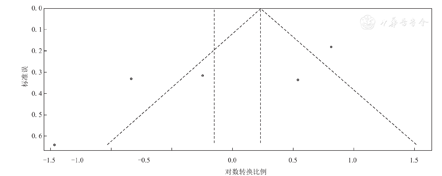
7项RCT研究均报告来那度胺治疗相关严重感染。异质性检测结果显示,纳入研究间无异质性(P=0.293,I2=17.9%),故采用固定效应模型进行Meta分析。与对照组相比,研究组来那度胺治疗MM患者相关严重感染的发生风险显著增加(RR=1.92,95%CI:1.59~2.33,P<0.000 1)。来那度胺治疗MM患者严重感染RR的Meta分析,见图10。7项RCT研究组和对照组严重感染RR比较的发表偏倚检测结果显示,漏斗图基本对称(图11)。
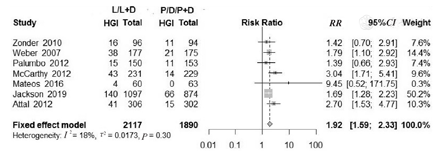

注:MM为多发性骨髓瘤
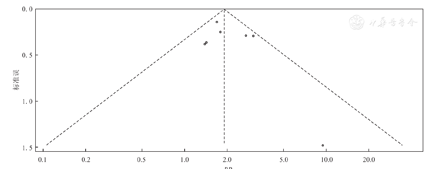

注:RCT为随机对照试验
MM是一种常见的血液系统恶性肿瘤,其主要特征为免疫功能缺陷,这使MM患者的感染发生率明显增高。与相同性别和年龄的健康个体相比,MM患者细菌感染的发生风险高7倍,病毒感染的发生风险高10倍。在罹患进展性MM患者中,感染是其第二大死亡原因(31%)[13]。但是,MM感染的高发生率不仅仅归因于MM的免疫功能缺陷,治疗相关的感染也是其主要原因。
目前,免疫调节剂(沙利度胺)、蛋白酶体抑制剂(硼替佐米)明显改善了MM患者的预后,但感染等不良反应仍是不可忽视的问题。在几乎所有接受上述药物治疗的患者中,MM患者易最终复发并产生耐药性。因此对于该类患者,需要新药提供更多的治疗选择。来那度胺作为新一代免疫调节剂,具有起效快、缓解率高、耐受性高的特点。相关文献结果表明,采用来那度胺进行治疗的患者中位PFS期可达39个月,较对照组明显延长(20个月)[7]。但是,关于来那度胺治疗MM相关的感染数据很少,国内、外尚无相关系统评价。本研究利用Meta分析方法对来那度胺治疗MM的疗效及所致严重感染进行系统评价,旨在进一步验证来那度胺对MM患者的疗效及明确其与严重感染的关系,为治疗及预防抗感染的选择提供理论依据。
由于目前国内来那度胺治疗MM相关严重感染方面的研究数量较少,并且大部分为回顾性队列研究,因此本研究仅选择英文数据库进行检索。本次系统研究对来那度胺治疗MM及其所致严重感染的RCT进行总结和评价,共计纳入7项RCT,均报道来那度胺治疗MM的结局指标及严重感染事件。本研究Meta分析结果显示,与对照组相比,研究组患者3年PFS期显著改善(HR=0.54,95%CI:0.36~0.82, P=0.004),而3年OS期无明显改善(HR=0.84,95%CI:0.62~1.14, P=0.262)。来那度胺治疗MM患者所致的严重感染方面,在各个RCT中,接受来那度胺治疗的MM患者的严重感染发生率为6.67%~21.47%,严重感染的总体发生率为14.01%,而与对照组相比,来那度胺治疗MM患者的严重感染发生风险显著(RR=1.92,95%CI:1.59~2.33, P<0.000 1)。在来那度胺相关的所有严重感染事件中,研究组呼吸道严重感染发生率为46%(95%CI:27%~65%)。上述结果表明,来那度胺可延长MM患者的PFS期,但对OS期无明显获益,并且接受来那度胺治疗的MM患者严重感染发生率明显升高,其中,呼吸道严重感染发生率最高。
来那度胺可通过抑制血管生长、增加自然杀伤(natural killer,NK)细胞的细胞毒效应等免疫调节途径及非免疫调节途径发挥抗肿瘤作用[14,15]。但是,来那度胺相关的骨髓抑制(主要为中性粒细胞减少),对肿瘤坏死因子(tumor necrosis factor,TNF)-α的抑制[16],以及来那度胺所致的器官功能障碍(如肾损伤、静脉血栓、周围神经病变、消化道黏膜损伤等)[17]均可直接或间接导致MM患者发生感染,使MM严重感染发生风险增加。研究结果表明,接受来那度胺治疗的MM患者中,约83%MM患者T4淋巴细胞计数<400/μL,这亦是导致病毒感染的重要因素,而预防性使用抗病毒药物后,未再观察到病毒感染的病例[4]。这表明,预防性使用抗生素可最大限度降低来那度胺治疗MM的相关感染事件。另外,MM患者中外周血CD3+CD4+CD161+细胞计数低与来那度胺治疗相关早期感染的发生有关[18,19],并且女性、复发/难治性MM患者,血清肌酐、铁蛋白水平升高的MM患者及MM诊断后第1年为感染高危因素,对接受来那度胺治疗的MM患者感染发生的类型及严重程度均有影响。这表明,接受来那度胺治疗的MM患者的感染易感性较高,与本研究结果相符。因此,结合MM患者的临床特征、相关实验室检测结果、治疗方案等,可对其严重感染发生风险进行预测,从而指导临床治疗方案的制定和预防使用抗生素的选择,尽量减少来那度胺治疗所致的严重感染不良反应。由于本研究结果显示,来那度胺相关严重感染事件中,呼吸道感染占46%,所以尽早针对MM患者行胸部CT检查有助于严重感染的早发现、早治疗,以最大程度减少因感染所致的药物减量或停药,从而可以改善MM患者的预后和生存质量。
本研究存在一些局限性。①本次系统评价所纳入的研究由不同研究人员在不同的机构进行,对于严重感染的评估可能具有异质性;②部分文献未提及分配隐藏及盲法的运用,所以论证强度受到一定限制;③由于所纳入文献均未详细记录出现严重感染患者的年龄、性别、疾病进展程度等额外变量,可能使本次系统评价结果出现偏差。
综上所述,来那度胺作为第二代免疫调节剂,可显著延长MM患者的PFS期,但对OS期无明显改善。来那度胺治疗后MM患者严重感染的发生率明显升高,其中呼吸道感染占较大比例。由于纳入RCT数量较少,并且存在一定局限性,因此需要收集更多大样本、高质量RCT,以明确严重感染在接受来那度胺治疗的MM患者中的发生风险,并为优化来那度胺的临床使用提供更多依据。
所有作者均声明不存在利益冲突




























