
探讨外周T细胞淋巴瘤-非特指型(PTCL-NOS)患者的临床疗效及其预后影响因素。
选择2010年1月至2018年12月,于河南省淋巴瘤诊疗中心收治的87例PTCL-NOS患者为研究对象。患者中位年龄为54岁(19~79岁);男性患者为61例,女性为26例。采用回顾性分析方法,收集患者的一般临床资料,实验室及辅助检查结果等临床病例资料,并且分析患者的临床疗效、预后及其影响因素。采用Kaplan-Meier法绘制患者总体生存(OS)曲线,并且计算其1、3、5年OS率。采用log-rank检验,对可能影响患者OS率的临床特征进行单因素分析。采用多因素Cox比例风险模型,对单因素分析结果中有统计学意义的影响因素进行多因素分析。本研究遵循的程序符合2013年修订版《世界医学协会赫尔辛基宣言》要求,并且与所有患者签署临床研究知情同意书。
①本组87例患者中,接受CHOP(环磷酰胺+表柔比星+长春新碱+泼尼松)、GDPT(吉西他滨+顺铂+地塞米松+沙利度胺)及其他化疗方案治疗的患者分别为33例(37.9%)、33例(37.9%)和21例(24.1%)。②本组87例PTCL-NOS患者的客观缓解率(ORR)为75.9%,1、3、5年OS率分别为85.9%、50.2%和33.0%。③单因素分析结果显示,Ann Arbor分期(χ2=16.384,P<0.001),血清乳酸脱氢酶(LDH)水平(χ2=5.836,P=0.016),血清β2-微球蛋白(MG)水平(χ2=5.495,P=0.019),外周血淋巴细胞绝对计数(ALC)(χ2=8.922,P=0.003),PTCL-NOS预后指数(PIT)评分(χ2=22.263,P<0.001)及国际预后指数(IPI)评分(χ2=26.138,P<0.001),均为PTCL-NOS患者OS率的影响因素。④多因素Cox比例风险模型分析结果显示,Ann Arbor分期为Ⅲ~Ⅳ期(HR=2.112,95%CI:1.098~4.064,P=0.025)及IPI评分>2分(HR=5.744,95%CI:1.187~27.795,P=0.030)为影响PTCL-NOS患者OS率的独立危险因素。
目前,临床多采取CHOP及GDPT方案治疗PTCL-NOS患者,其近期疗效尚可,但是Ann Arbor分期为Ⅲ~Ⅳ期或IPI评分>2分者预后较差。因此,应积极探索新的PTCL-NOS治疗方案,进一步改善患者的临床疗效及预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
世界卫生组织(World Health Organization,WHO)将外周T细胞淋巴瘤-非特指型(peripheral lymphoma T cell lymphoma, not otherwise specified,PTCL-NOS)定义为一组起源于成熟T细胞的高度异质性、侵袭性非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)。约70.0% PTCL-NOS患者被确诊时,其疾病临床分期已达晚期(Ann Arbor分期Ⅲ~Ⅳ期),并且多伴有淋巴结和结外组织器官(骨髓、肝、脾和皮肤)受累,严重者可合并噬血细胞综合征[1]。既往临床研究结果显示,PTCL-NOS患者的临床分期,乳酸脱氢酶(lactate dehydrogenase,LDH)水平,外周血淋巴细胞绝对计数(absolute lymphocyte count,ALC),CD30表达情况,B症状,PTCL-NOS预后指数(Prognostic Index for PTCL-NOS,PIT)评分,国际预后指数(International Prognostic Index,IPI)评分等与其预后显著相关[2,3]。本研究回顾性分析河南省淋巴瘤诊疗中心2010年1月至2018年12月收治的87例PTCL-NOS患者的临床病例资料,进一步明确本中心PTCL-NOS患者的临床特征、疗效及预后影响因素,旨在探索更有效的PTCL-NOS治疗方案,以提高患者疗效及预后。现将研究结果报道如下。
选择2010年1月至2018年12月,于河南省淋巴瘤诊疗中心收治的87例PTCL-NOS患者为研究对象。患者中位年龄为54岁(19~79岁);男性患者为61例,女性为26例。研究对象纳入标准:①年龄为14~80岁;②生存时间>3个月;③经病理学和免疫组织化学检查确诊确诊为PTCL-NOS;④既往未接受针对PTCL-NOS的治疗;⑤临床病例资料及随访记录完整的患者。排除标准:①合并严重基础疾病者;②孕产妇。本研究遵循的程序符合2013年修订版《世界医学协会赫尔辛基宣言》要求,并且与所有患者签署临床研究知情同意书。
① PTCL-NOS的诊断标准。本组87例PTCL-NOS患者均经病理学及免疫组织化学检查确诊,并且经CT或者PET/CT明确淋巴瘤病灶及侵犯部位,所有患者的诊断遵循2008年WHO造血与淋巴组织肿瘤分类标准[4]。②患者疗效评价。根据2015年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)发布的NHL指南标准[5],于2、4、6周期治疗结束后,对患者进行疗效评价。疗效评价结果可分为:完全缓解(complete response,CR),部分缓解(partical response,PR),疾病稳定(stable disease,SD),疾病进展(progress disease,PD)。患者的治疗客观缓解率(objective response rate,ORR)计算公式为:ORR(%)=(治疗后达CR患者例数+治疗后达PR患者例数)/接受治疗患者总例数×100%。
本组87例PTCL-NOS患者中,对33例采取CHOP(环磷酰胺+表柔比星+长春新碱+泼尼松);33例采取GDPT(吉西他滨+顺铂+地塞米松+沙利度胺)化疗方案[6];21例采取其他治疗方案,包括沙利度胺+环磷酰胺+泼尼松,沙利度胺+西达苯胺+环磷酰胺+长春新碱+福莫司汀等。
本研究对所有患者采用规律门诊复查及电话回访的方式进行随访,随访时间截至2019年12月31日。对本组患者的总体生存(overall survival,OS)期定义为:患者确诊PTCL-NOS至因任何原因死亡或末次随访的时间间隔。
本研究所得数据采用SPSS 21.0统计学软件进行统计学分析。采用Ssize软件,确定满足本研究统计检验的最小样本量。采用Kaplan-Meier法绘制患者OS曲线,并且计算其1、3、5年OS率。采用log-rank检验,对可能影响患者OS率的临床特征进行单因素分析。采用多因素Cox比例风险回归模型,对单因素分析结果中有统计学意义的影响因素进行多因素分析。本研究所有检验采用双侧检验,以P<0.05表示差异存在统计学意义。
本组87例PTCL-NOS患者的中位年龄为54岁(19~79岁);男性患者为61例,女性为26例,男女比例为2.3∶1;接受CHOP、GDPT化疗方案治疗的患者均为33例(37.9%);Ann Arbor分期Ⅲ~Ⅳ期者为61例(70.1%);IPI评分>2分者为37例(42.5%)。本组87例PTCL-NOS患者的一般临床特征,见表1。

本组87例外周T细胞淋巴瘤-非特指型患者的一般临床特征[例数(%)]
本组87例外周T细胞淋巴瘤-非特指型患者的一般临床特征[例数(%)]
| 临床特征 | 例数 | |
|---|---|---|
| 性别 | ||
| 男 | 61(70.1) | |
| 女 | 26(29.9) | |
| 年龄(岁) | ||
| <60 | 50(57.5) | |
| ≥60 | 37(42.5) | |
| 化疗方案 | ||
| CHOP | 33(37.9) | |
| GDPT | 33(37.9) | |
| 其他 | 21(24.1) | |
| Ann Arbor分期 | ||
| Ⅰ~Ⅱ期 | 26(29.9) | |
| Ⅲ~Ⅳ期 | 61(70.1) | |
| 血清LDH水平(U/L) | ||
| 升高(>300) | 41(47.1) | |
| 正常(100~300) | 46(52.9) | |
| 血清β2-MG水平(μg/L) | ||
| 升高(>2.6) | 36(41.4) | |
| 正常(1.0~2.6) | 51(58.6) | |
| 外周ALC(×109/L) | ||
| 降低(<0.8) | 31(35.6) | |
| 正常(0.8~4.0) | 56(64.4) | |
| CD30表达 | ||
| 阳性 | 41(47.1) | |
| 阴性 | 46(52.9) | |
| 是否合并B症状 | ||
| 是 | 63(72.4) | |
| 否 | 24(27.6) | |
| PIT评分(分) | ||
| ≤2 | 54(62.1) | |
| >2 | 33(37.9) | |
| IPI评分(分) | ||
| ≤2 | 50(57.5) | |
| >2 | 37(42.5) | |
注:CHOP为环磷酰胺+表柔比星+长春新碱+泼尼松化疗方案,GDPT为吉西他滨+顺铂+地塞米松+沙利度胺化疗方案。LDH为乳酸脱氢酶,MG为微球蛋白,ALC为淋巴细胞绝对计数,PIT为外周T细胞淋巴瘤-非特指型预后指数,IPI为国际预后指数
本组87例PTCL-NOS患者中,于治疗6个周期后进行疗效评价的结果显示,17例(19.5%)患者获得CR,49例(56.3%)获得PR,12例(13.8%)SD, 9例(10.3%)PD。患者的ORR为75.9%(66/87)。
截至本研究末次随访日期,87例患者中,23例患者存活,64例死亡,死亡原因包括疾病复发或进展。本组87例PTCL-NOS患者的1、3和5年OS率分别为85.9%、50.2%和33.0%,见图1。
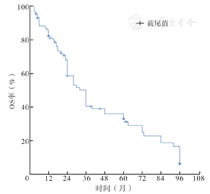

注:OS为总体生存
单因素分析结果显示,患者的Ann Arbor分期(χ2=16.384,P<0.001),血清LDH水平(χ2=5.836,P=0.016),血清β2-MG水平(χ2=5.495, P=0.019),外周血ALC(χ2=8.922,P=0.003),PIT评分(χ2=22.263,P<0.001)和IPI评分(χ2=26.138,P=0.003)为PTCL-NOS患者OS率的影响因素。本组87例PTCL-NOS患者OS率影响因素的单因素分析结果,见表2。
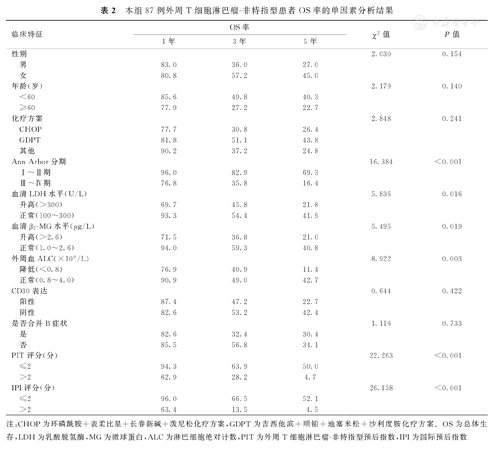
本组87例外周T细胞淋巴瘤-非特指型患者OS率的单因素分析结果
本组87例外周T细胞淋巴瘤-非特指型患者OS率的单因素分析结果
| 临床特征 | OS率 | χ2值 | P值 | |||
|---|---|---|---|---|---|---|
| 1年 | 3年 | 5年 | ||||
| 性别 | 2.030 | 0.154 | ||||
| 男 | 83.0 | 36.0 | 27.0 | |||
| 女 | 80.8 | 57.2 | 45.0 | |||
| 年龄(岁) | 2.179 | 0.140 | ||||
| <60 | 85.6 | 49.8 | 40.3 | |||
| ≥60 | 77.9 | 27.2 | 22.7 | |||
| 化疗方案 | 2.848 | 0.241 | ||||
| CHOP | 77.7 | 30.8 | 26.4 | |||
| GDPT | 81.8 | 51.1 | 43.8 | |||
| 其他 | 90.2 | 37.2 | 24.8 | |||
| Ann Arbor分期 | 16.384 | <0.001 | ||||
| Ⅰ~Ⅱ期 | 96.0 | 82.9 | 69.3 | |||
| Ⅲ~Ⅳ期 | 76.8 | 35.8 | 16.4 | |||
| 血清LDH水平(U/L) | 5.836 | 0.016 | ||||
| 升高(>300) | 69.7 | 45.8 | 21.8 | |||
| 正常(100~300) | 93.3 | 54.4 | 41.9 | |||
| 血清β2-MG水平(μg/L) | 5.495 | 0.019 | ||||
| 升高(>2.6) | 71.5 | 36.8 | 21.0 | |||
| 正常(1.0~2.6) | 94.0 | 59.3 | 40.8 | |||
| 外周血ALC(×109/L) | 8.922 | 0.003 | ||||
| 降低(<0.8) | 76.9 | 40.9 | 11.4 | |||
| 正常(0.8~4.0) | 90.9 | 49.0 | 42.7 | |||
| CD30表达 | 0.644 | 0.422 | ||||
| 阳性 | 87.4 | 47.2 | 22.7 | |||
| 阴性 | 82.6 | 53.2 | 42.4 | |||
| 是否合并B症状 | 1.116 | 0.733 | ||||
| 是 | 82.6 | 32.4 | 30.4 | |||
| 否 | 85.5 | 56.8 | 34.1 | |||
| PIT评分(分) | 22.263 | <0.001 | ||||
| ≤2 | 94.3 | 63.9 | 50.0 | |||
| >2 | 62.9 | 28.2 | 4.7 | |||
| IPI评分(分) | 26.138 | <0.001 | ||||
| ≤2 | 96.0 | 66.5 | 52.1 | |||
| >2 | 63.4 | 13.5 | 4.5 | |||
注:CHOP为环磷酰胺+表柔比星+长春新碱+泼尼松化疗方案,GDPT为吉西他滨+顺铂+地塞米松+沙利度胺化疗方案。OS为总体生存,LDH为乳酸脱氢酶,MG为微球蛋白,ALC为淋巴细胞绝对计数,PIT为外周T细胞淋巴瘤-非特指型预后指数,IPI为国际预后指数
多因素Cox比例回归风险模型分析结果显示,Ann Arbor分期Ⅲ~Ⅳ期(HR=2.112,95%CI:1.098~4.064,P=0.025)和IPI评分>2分(HR=7.744,95%CI:1.187~27.795、P=0.030)为影响PTCL-NOS患者OS率的独立危险因素。本组87例PTCL-NOS患者OS率影响因素的多因素分析结果,见表3。
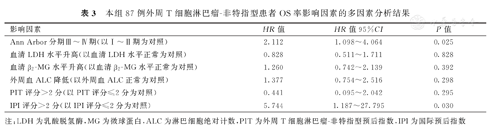
本组87例外周T细胞淋巴瘤-非特指型患者OS率影响因素的多因素分析结果
本组87例外周T细胞淋巴瘤-非特指型患者OS率影响因素的多因素分析结果
| 影响因素 | HR值 | HR值95%CI | P值 |
|---|---|---|---|
| Ann Arbor分期Ⅲ~Ⅳ期(以Ⅰ~Ⅱ期为对照) | 2.112 | 1.098~4.064 | 0.025 |
| 血清LDH水平升高(以血清LDH水平正常为对照) | 0.828 | 0.511~1.711 | 0.828 |
| 血清β2-MG水平升高(以血清β2-MG水平正常为对照) | 1.260 | 0.742~2.139 | 0.392 |
| 外周血ALC降低(以外周血ALC正常为对照) | 1.377 | 0.754~2.516 | 0.298 |
| PIT评分>2分(以PIT评分≤2分为对照) | 0.441 | 0.095~2.042 | 0.295 |
| IPI评分>2分(以IPI评分≤2分为对照) | 5.744 | 1.187~27.795 | 0.030 |
注:LDH为乳酸脱氢酶,MG为微球蛋白,ALC为淋巴细胞绝对计数,PIT为外周T细胞淋巴瘤-非特指型预后指数,IPI为国际预后指数
PTCL-NOS是一组异质性较强的成熟T细胞淋巴瘤,可侵犯患者正常淋巴结的滤泡间质和副皮质区,受累淋巴结多呈弥漫性分布。PTCL-NOS患者确诊时,通常病情已进展至晚期,多伴有淋巴结,以及骨髓、肝、脾和皮肤等结外组织器官受累,该病具有侵袭性强和预后差的特征。一项对SEER(surveillance,epidemiology,and end results)数据库资料的分析结果显示,PTCL-NOS为欧美地区最常见的外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)亚型[3]。PTCL-NOS患者的中位年龄为60岁,男、女比例约为1.9∶1,该病患者的预后较其他类型淋巴瘤差,其5年OS率为20%~30%[9]。
多项临床研究结果证实,Ann Arbor分期、LDH水平、β2-MG水平、ALC、PIT评分及IPI评分与PTCL-NOS患者的预后相关[10]。本研究结果亦证实,PTCL-NOS患者的Ann Arbor分期、血清LDH水平、血清β2-MG水平、外周血ALC、PIT评分及IPI评分,为其OS率的影响因素(P<0.05)(表2)。目前临床采用的PTCL-NOS分期系统主要为Ann Arbor分期,该分期系统的依据为肿瘤侵犯范围及部位。临床研究结果显示,Ann Arbor分期Ⅲ~Ⅳ期PTCL-NOS患者的淋巴结及结外侵犯范围广,并且预后差[7]。PTCL-NOS患者的LDH和β2-MG水平与其肿瘤负荷相关,LDH水平增高,可提示高肿瘤负荷,肿瘤结外侵犯可能性大,恶性度高;而β2-MG主要由淋巴细胞产生,PTCL-NOS患者自身合成β2-MG速度快,数量多,随细胞代谢入血量增加,导致患者血β2-MG水平增高,这亦可提示其肿瘤负荷增加[11]。外周血淋巴细胞是机体抗肿瘤重要的免疫细胞之一,可抑制肿瘤细胞的增殖和新陈代谢,故ALC可反应机体的免疫状态,当ALC低下时,机体免疫功能低下,这有助于肿瘤细胞的转移与增殖,伴ALC下降的PTCL-NOS患者,通常预后较差。IPI评分为PTCL-NOS患者重要的预后指数。在本研究87例PTCL-NOS患者,IPI评分≤2分者的5年OS率高达52.1%,IPI评分>2分者仅为4.5%。2004年,Gallamini等[12]首次提出PIT评分,并认为PIT评分较IPI评分,对PTCL-NOS患者预后的预测效果更佳。但亦有研究结果显示,PIT评分对PTCL-NOS患者的预后预测效果,并不优于IPI评分[13]。而本研究结果则显示,IPI评分对87例PTCL-NOS患者OS率的影响较PIT评分显著,但由于本研究的样本量有限,该结果尚需扩大样本量进一步确认。
目前,临床对PTCL-NOS患者的治疗通常采用含蒽环类药物联合化疗方案[14]。但是由于该病患者的组织病理类型、免疫表型异质性大,故其临床疗效欠佳,并且复发率高[15]。国内一项采用CHOP方案治疗106例PTCL-NOS患者的单中心、回顾性研究结果显示,患者的1、3、5年OS率分别为69.9%、42.9%和22.0%[16]。但本研究结果显示,87例PTCL-NOS患者的1、3、5年OS率分别为85.9%、50.2%、33.0%,较既往研究结果高。这可能与本研究对33例(37.9%)患者采取GDPT方案治疗有关。本中心采取GDPT方案治疗103例PTCL患者的前瞻性研究结果显示,接受GDPT方案患者的ORR率,较接受传统CHOP方案者显著升高[67%(35/52)比49%(25/51),P=0.046][17]。本研究发现,接受GDPT方案治疗的33例PTCL-NOS患者,其1、3、5年生存率均较接受CHOP方案治疗者高,但是二者差异无统计学意义(P>0.05)(表2)。这可能与本研究病纳入的病例数较少有关。
PTCL-NOS是一组异质性强、预后差的成熟T细胞淋巴瘤,本中心87例患者1、3、5年生存率为85.9%、50.2%、33.0%,ORR为75.9%。目前仍然需要通过更多大样本、多中心、前瞻性临床研究,以探寻PTCL-NOS更有效的治疗方案,提高患者疗效及预后。
所有作者均声明不存在利益冲突



























