
探讨PCR-高分辨熔解曲线(HRM)法在Kidd血型基因分型中的应用。
采用简单随机抽样法,选择2019年10月至11月,于深圳市血液中心参加无偿献血的256例献血者为研究对象。本组献血者年龄为18~60岁;男性献血者为142例,女性为114例。采用血型血清学试验方法对本组献血者全血标本的红细胞抗原表型进行检测。采用PCR-SSP和PCR-HRM法对本组献血者的DNA标本进行Kidd血型基因分型。对于基因分型与血型血清学检测结果不一致的标本,则通过JK基因第9外显子直接测序法进行确认。本研究遵循的程序符合2013年修订版《世界医学协会赫尔辛基宣言》要求,并且于献血前与所有献血者签署《献血者知情同意书》。
①本组256例无偿献血者全血标本的血型血清学检测结果显示,Jk(a-b+)、Jk(a+b+)和Jk(a+b-)表型献血者分别为86、109和61例。②本组256例献血者基因组DNA标本的PCR-SSP和PCR-HRM法的Kidd血型基因分型结果一致,JKB/JKB、JKA/JKB和JKA/JKA基因型献血者分别为82、115和59例。③ 22例(8.6%,22/256)献血者的血型血清学表型与基因分型结果不一致。其基因组DNA标本经JK基因第9外显子直接测序结果显示,JK基因第9外显子存在c.838 G>A突变,与JKA/JKB基因分型结果相符。
本研究建立的PCR-HRM法可准确进行Kidd血型基因分型,该方法可以有效地辅助Kidd血型精准鉴定。在进行Kidd血型鉴定的实际工作中,可联合血型血清学和PCR-HRM法,以提高Kidd血型鉴定准确度。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
Kidd血型系统(ISBT009),是人类重要的红细胞血型系统之一,其主要包括3种血型抗原:Jka、Jkb、Jk3,4种血型表型:Jk(a+b+)、Jk(a+b-)、Jk(a-b+)及Jk(a-b-),机体免疫系统产生的Jk抗体与Jk抗原发生免疫反应后,可引起严重的输血反应[1,2]或新生儿溶血病[3]。编码Jk抗原的JK基因位于染色体18q11-12,JKA与JKB是编码Jk抗原的一对等位基因,二者的差别在JK基因第838位核苷酸发生单碱基置换(c.838 G>A)。Kidd糖蛋白已被证实为尿素转运蛋白,表达Jka或Jkb抗原的红细胞可以主动转运尿素通过细胞膜,而Jk(a-b-)血型表型个体的尿素转运仅依靠被动扩散,其速度仅为主动转运的0.1%,因此Kidd糖蛋白转运尿素的功能通常被用于筛查Jk(a- b-)血型个体的尿素溶血实验中[4,5,6]。
目前,Kidd血型系统的分型方法主要有传统血型血清学检测和基因分型两类。在传统血型血清学方法中,Jk抗体检出率低,并且由于Jk抗体的特性、剂量效应,以及需要结合补体等因素,可能发生漏检或错检情况。相关研究结果证实,Jka、Jkb抗体的正确检出率<30%[6]。若Jk抗体与其相应的抗原结合,则会激活机体补体系统直接破坏红细胞,引起严重的溶血反应,导致临床输血安全隐患。因此,通过基因分型的检测方法,准确鉴定Kidd血型系统,可以显著提高输血安全性。
RR高分辨率熔解曲线(high resolution melting,HRM)法是基于DNA熔解温度不同的物理特性,通过在双链DNA中插入饱和染料,监测DNA熔解曲线变化,从而进行基因分析的一项PCR新技术[7]。近年,PCR-HRM法已被应用于血型基因分型[8,9]。本研究通过建立采用PCR-HRM法进行Kidd血型系统JK基因分型的方法,旨在为临床提供一个高灵敏度、高准确性、高通量的Kidd血型基因分型技术。现将研究结果报道如下。
于2019年10月至11月,采用简单随机抽样法,选择于深圳血液中心参加无偿献血的256例献血者为研究对象。本组献血者年龄为18~60岁,其中男性献血者为142例,女性为114例。研究对象纳入标准:①年龄为18~60岁者;②献血前体检及相关血液学检查结果,符合《献血者健康检查要求》(GB18467—2011)者;③符合《深圳经济特区无偿献血条例》相关规定的健康、自愿、无偿献血者;④全血标本的红细胞尿素溶血实验检测结果呈阳性者。排除标准:①既往有重大疾病史者;②非自愿参加本试验者。于献血者献血前,采集其肘静脉血2 mL,并置于乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)-Na2抗凝管中,4 ℃保存,待检。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求,并且于献血前与所有献血者签署《献血者知情同意书》。
抗-Jka、抗-Jkb免疫球蛋白(immunoglobulin,Ig)M单克隆抗体(批号分别为:OJkaM188、OJkbM126,德国CE-Immundiagnostika GmbH公司);基因组DNA提取试剂盒(MagNA Pure LC DNA Isolation KitⅠ)(批号:36982400,瑞士Roche公司);Type-it HRM PCR试剂盒(批号:163024448,德国Qiagen公司);人类红细胞Kidd血型PCR-序列特异性引物(sequence specific primer,SSP)基因分型试剂盒(批号:K201909002,天津市秀鹏生物技术开发有限公司)。MagNA Pure LC 2.0型全自动核酸分离纯化与加样系统(瑞士Roche公司),Eppendorf 9700型PCR扩增仪(美国Eppendorf公司),Caliper Life Sciences Labchip GXⅡ凝胶成像分析仪(美国Caliper Life Sciences公司),Light Cycler®480Ⅱ型实时荧光定量PCR仪(瑞士Roche公司);Thermo Scientific NanoDrop 2000型超微量分光光度计(美国Thermofisher公司)。
分别取本组献血者全血标本1 mL,并且采用抗-Jka、抗-Jkb IgM单克隆抗体,以及传统试管法和微柱凝胶卡法,检测其Kidd血型表型。实验操作及结果判读,严格按照《全国临床检验操作规程》进行。
分别取本组献血者全血标本300 μL,采用基因组DNA提取试剂盒和全自动核酸分离纯化与加样系统,提取全血标本DNA。实验操作严格按照试剂盒说明书进行。要求所提取的DNA浓度>20 ng/μL,纯度为1.80~2.0。并将基因组DNA标本统一稀释至5 ng/μL用于PCR-HRM实验。
分别取20 μL(100 ng)DNA样本,采用人类红细胞Kidd血型系统PCR-SSP基因分型试剂盒,对其进行JK基因检测。PCR-SSP扩增产物采用Caliper Life Sciences Labchip GXⅡ凝胶成像分析仪,进行电泳分析。按照试剂盒说明书,根据电泳分析结果中是否存在340 bp的目的条带,判断该样本DNA的JK基因型。
根据文献[10],针对JK基因第9外显子包含JKA和JKB等位基因c. 838G>A置换位点的序列,委托广州爱基生物科技有限公司合成JK基因扩增引物。正向和反向扩增引物序列分别为:5′-GACTCA GTCTTTCAGCCCCAT-3′和3′-GAGGTGGGTT TGCCAGGTGA-5′,扩增产物长度为78 bp。反应体系为25 μL,包括PCR-HRM反应混合物12.5 μL,基因组DNA 2 μL(共10 ng),正向和反向混合引物(浓度为10 μmol/L)1.75 μL,无RNA酶水8.75 μL。采用Light Cycler® 480 Ⅱ型实时荧光定量PCR仪进行PCR-HRM实验。扩增程序为:95 ℃预变性5 min;95 ℃变性10 s,52 ℃退火30 s,72 ℃延伸10 s,共40个循环。待扩增结束后,PCR扩增产物自动按照程序设定进入升温熔解阶段,收集荧光信号,并且采用Gene Scanning程序(罗氏公司)分析结果,以获得检测标本的PCR-HRM分型结果。
根据参考文献[11],合成扩增JK基因第9外显子的引物,其正向和反向扩增引物序列分别为:5′-AGAGGTAAGGTATGTCCAATC-3′和3′-AC TGCTTATCCTTGATTGAG-5′,扩增产物片段长度为677 bp。扩增反应体系为50 μL,包括4 μL基因组DNA标本(浓度为50 ng/μL),上、下游引物各1 μL(浓度为5 pmol/μL),4 μL混合dNTP(浓度为10 mmol/L),0.5 U Taq聚合酶。扩增程序为:96 ℃预变性7 min;96 ℃变性30 s, 58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃ 7 min; 4 ℃保存。采用1.5%琼脂糖凝胶电泳分析扩增产物,将扩增产物送至广州爱基生物科技有限公司进行Sanger测序。
本组256例无偿献血者全血标本的血型血清学检测结果如下。Jk(a-b+)表型献血者为86例,Jk(a+b+)为109例,Jk(a+b-)为61例。
本组256例无偿献血者基因组DNA标本的Kidd血型PCR-SSP法基因分型结果如下。JKB/JKB基因型献血者为82例,JKA/JKB为115例,JKA/JKA为59例。
本组256例无偿献血者基因组DNA标本的PCR-HRM法Kidd血型基因分型结果显示,JKB/JKB基因型献血者为82例,JKA/JKB为115例,JKA/JKA为59例。采用PCR-HKM法对无偿献血者DNA标本Kidd血型基因分型结果示意图,见图1。
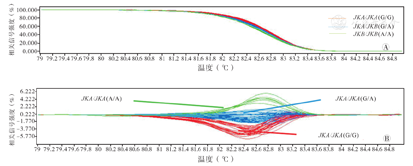

注:3种不同PCR-HRM曲线对应3种基因型:绿色曲线对应纯合子基因型JKB/JKB(A/A),红色曲线对应纯合子基因型JKA/JKA(G/G),蓝色曲线对应杂合子基因型JKA/JKB(G/A)。HRM为高分辨熔解曲线
本组256例随机无偿献血者的Kidd血型血清学表型与基因分型结果对比,22例(8.6%)献血者的结果不一致。本研究256例无偿献血者Kidd血型血清学表型与基因分型结果对比,见表1。

本组256例无偿献血者Kidd血型血清学表型与基因分型结果对比(例)
本组256例无偿献血者Kidd血型血清学表型与基因分型结果对比(例)
| 血清学表型 | 基因分型结果 | 合计 | ||
|---|---|---|---|---|
| JKA/JKA | JKA/JKB | JKB/JKB | ||
| Jk(a-b+) | 0 | 10a | 76 | 86 |
| Jk(a+b+) | 2a | 101 | 6a | 109 |
| Jk(a+b-) | 57 | 4a | 0 | 61 |
| 合计 | 59 | 115 | 82 | 256 |
注:aKidd血型血清学表型与基因分型结果不一致
对22例Kidd血型血清学表型与基因分型结果不一致无偿献血者基因组DNA标本的JK基因直接测序结果显示,JK基因第9外显子c.838G>A(图2),与JKA/JKB基因分型结果相符。JK基因直接测序结果与PCR-HRM和PCR-SSP基因分型结果符合率为100%。


PCR-HRM法通过饱和荧光染料对PCR产物的熔解曲线变化进行实时监测,不需要使用针对目标等位基因位点的特异性引物或探针,只需一对引物就可以对等位基因的变化进行识别,通常用于检测基因单核苷酸多态性及突变扫描分析[12,13]。DNA质量对PCR-HRM结果存在一定的影响[14,15]。本研究采用磁珠法提取全血基因组DNA,DNA样本经裂解后,核酸吸附于磁珠上,以磁珠为介质进行DNA洗涤和洗脱。该DNA提取过程采用全自动操作,可有效降低人工误差,并且能控制所提取DNA的浓度与纯度,从而优化PCR-HRM法的分析结果,顺利完成深圳血液中心256例无偿献血者JK基因838位点的多态性检测。
Kidd血型系统的免疫原性弱,在血型抗原表型检测中,经典的血型血清学方法对微量Jk抗原的检测灵敏度不高。本研究结果显示,Kidd血型血清学表型与基因分型结果不一致标本为22例,14例基因分型为JKA/JKB的标本中,10例标本的血清学表型为Jk(a-b+),4例为Jk(a+b-)。这提示,对于杂合子基因型的Kidd血型,Jka或Jkb抗原血清学检测存在漏检现象,漏检率为5.5%(14/256)。此外,2例JKA/JKA和6例JKB/JKB基因型献血者标本的血清学表型均为Jk(a+b+)。据此推测,本研究采用的Kidd血型抗原检测商品化试剂存在假阳性结果,假阳性率为3.1%(8/256)。Kidd血型系统鉴定的血型血清学分型技术,因具有快速简便的特点而得以广泛应用,但是其实验结果的判读难以标准化,而且由于Kidd血型系统抗原表达的剂量效应,以及定型试剂特异性、效价等因素,在很大程度上影响检测结果的准确性,这在临床输血中存在很大的安全隐患。Kidd血型基因分型则可以辅助血型血清学检测,准确判定Kidd血型[16,17]。
采用PCR-SSP进行Kidd血型基因分型的过程中,需要进行凝胶电泳分析,多步操作容易加大孔间误差,并且可能出现交叉污染的情况。而PCR-HRM法具有操作便捷、高通量、全程密闭的优势。但是,PCR-HRM法对于扩增的DNA模板、荧光染料,以及精确控温装置和高密度数据采集的仪器,均有一定的要求。本次研究建立的Kidd血型基因分型PCR-HRM法,可准确进行Kidd血型基因分型,对保证临床输血安全及预防新生儿溶血病有重要意义。
本次研究建立的PCR-HRM方法基于JK基因c.838G>A形成Jka/Jkb抗原多态性,但是无法检出包括无义突变、错义突变、拼接位点的突变和碱基缺失等JK等位基因[18,19],因此不适用于Jk(a-b-)、Jk(a+wb-)表型及其他变异型的基因分型。随着对JK基因多态性研究的不断深入,将进一步研发检测方法,以实现HRM技术在Kidd血型基因分型中的广泛应用。
所有作者均声明不存在利益冲突



























