
基于美国国立癌症研究所的监测、流行病学和结果(SEER)数据库中慢性髓细胞白血病(CML)患者的资料,探讨影响CML患者的生存预后因素及全因死亡差异。
选择SEER数据库收录中于2000-2017年诊断的18 505例CML患者为研究对象。将其按照诊断时间,分为2000-2005年组(n=5 255)、2006-2011年组(n=6 031)和2012-2017年组(n=7 219);按照患者的诊断年龄,分为15~44岁组(n=4 733)、45~64岁组(n=7 237)、65~74岁组(n=3 572)和75~84岁组(n=2 963)。采用SEER*Stat 8.3.9软件提取患者的诊断时间、性别、种族、年龄、生存结局、死亡原因、生存时间、调整后的家庭年中位收入、居住地等基本信息。患者性别、诊断年龄、人种构成比等计数资料的组间比较,采用χ2检验。采用Kaplan-Meier法分别绘制不同年龄组及不同诊断时间组患者的总体生存(OS)曲线,各组总体比较采用log-rank检验,组间两两比较采用Bonferroni法对P值进行校正。采用Cox比例风险回归模型对影响患者OS率的因素进行单因素及多因素分析。本研究遵循的程序符合2013年修订版《世界医学协会赫尔辛基宣言》要求。
①本研究3组不同诊断时间组CML患者的一般资料比较结果显示,其诊断年龄、人种、调整后家庭中位年收入及居住地构成比分别比较,差异均有统计学意义(χ2=108.035、38.721、274.437、28.377,P<0.001、<0.001、<0.001、=0.002);仅性别构成比比较,差异无统计学差异(P>0.05)。②对本研究18 505例CML患者的中位随访时间为7.1年(3.3~11.7年),中位OS期为13.4年(未达到~3.8年),5年OS率为70.9%。随着CML患者诊断年龄的增加,其OS率降低,并且差异有统计学意义(4组总体比较:χ2=4765.639,P<0.001;任意2组比较,P<0.008)。随着患者诊断时间的推后,其OS率升高,并且差异亦有统计学意义(3组总体比较:χ2=273.461,P<0.001;任意2组比较:P<0.017)。③对可能影响本研究CML患者OS率的因素进行的单因素及多因素Cox比例风险回归模型分析结果显示,男性(女性患者比男性患者:HR=0.801,95%CI:0.761~0.842,P<0.001),年龄≥45岁(45~64、65~74、75~84岁组患者分别比15~44岁组:HR=1.756,95%CI:1.611~1.914,P<0.001;HR=4.349,95%CI:3.985~4.747,P<0.001;HR=9.147,95%CI:8.396~9.964,P<0.001),诊断时间在2005年之前(2006-2011年组、2012-2017年组患者分别比2000-2005年组患者:HR=0.730,95%CI:0.689~0.773,P<0.001;HR=0.579,95%CI:0.538~0.623,P<0.001),调整后家庭中位年收入<55 000 USD(调整后家庭中位年收入为55 000~74 999 USD、≥75 000 USD的患者分别比<55 000 USD者:HR=0.905,95%CI:0.852~0.962,P=0.001;HR=0.786,95%CI:0.733~0.843,P<0.001)及黑色人种(黑色人种患者比白色人种患者:HR=1.334,95%CI:1.236~1.439,P<0.001)是影响CML患者OS率的独立危险因素。④截至随访结束,本研究CML患者中,死亡患者为6 310例,全因死亡率为34.1%(6 310/18 505)。其中,1 921例(30.4%)因CML死亡,1 812例(28.7%)因并发其他肿瘤疾病死亡,2 486例(39.4%)因非肿瘤原因死亡,91例(1.4%)死亡原因不明。不同年龄组及不同时间组CML患者的死亡原因构成比分别比较,差异均有统计学意义(χ2=309.933、24.787,P<0.001、0.001)。
在真实世界中,随着新型TKI参与CML治疗,CML患者预后逐渐改善,同时因CML死亡的患者占比逐渐降低。患者性别、诊断年龄、家庭收入,以及TKI可及性是CML患者生存预后的独立影响因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性髓细胞白血病(chronic myeloid leukemia,CML)是一种起源于骨髓造血干细胞的骨髓增殖性肿瘤,以第9和22号染色体易位形成含BCR-ABL1融合基因的Ph染色体为特征[1,2]。继2001年美国食品与药物监督管理局(Food and Drug Administration,FDA)批准首个酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)伊马替尼用于CML临床治疗后,达沙替尼、尼洛替尼、博苏替尼和普纳替尼等第2代TKI,亦相继获得美国FDA批准,用于CML患者的临床治疗,并且疗效显著。临床试验研究结果显示,采用伊马替尼治疗553例CML慢性期(chronic phase,CML-CP)患者的10年总体生存(overall survival,OS)率为83.3%[3]。与伊马替尼比较,第2代TKI可使CML-CP患者更快地获得细胞遗传学缓解和分子学缓解,同时降低进展至CML加速期(accelerated phase,CML-AP)或CML急变期(blast crisis,CML-BC)患者的比例,但是OS情况相当[4,5,6,7]。真实世界中,随着应用于CML治疗的TKI种类增加,不同TKI可及性时CML患者的生存获益情况有待进一步探讨。因此,本研究将利用美国国家卫生研究院(National Institutes of Health,NIH)下属的肿瘤类疾病临床数据库,即监测、流行病学和结果(Surveillance,Epidemiology, and End Results,SEER)数据库平台,收集、整理2000-2017年诊断的CML患者资料,探讨影响CML患者的预后因素及全因死亡差异。现将研究结果报道如下。
选择SEER数据库中于2000-2017年被诊断的18 505例CML患者为研究对象。患者年龄为15~84岁;男性患者为10 653例,女性为7 852例。对所有CML患者的随访截至2017年12月31日。研究对象纳入标准:① ICD-O-3 Hist/behav编码为9863/3: Chronic myeloid leukemia, NOS或者9875/3: Chronic myelogenous leukemia, BCR-ABL1 positive;②诊断时间为2000-2017年;③诊断年龄为15~84岁。排除标准:病例来源仅为尸检或者仅有死亡证明。按照CML患者的诊断时间,将其分为2000-2005年组(n=5 255)、2006-2011年组(n=6 031)和2012-2017年组(n=7 219);按照诊断年龄,将其分为15~44岁组(n=4 733)、45~64岁组(n=7 237)、65~74岁组(n=3 572)和75~84岁组(n=2 963)。本研究遵循的程序符合2013年修订版《世界医学协会赫尔辛基宣言》要求。
采用SEER*Stat 8.3.9软件提取纳入患者的基本信息。基本信息包括诊断时间、性别、种族、年龄、生存结局、死亡原因、生存时间、调整后的家庭中位年收入、居住地区等。
本研究所得数据采用SPSS 26.0统计学软件进行统计分析。患者性别、诊断年龄、人种构成比等计数资料,采用百分数(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法分别绘制不同诊断年龄组及不同诊断时间组患者的OS曲线;各组总体比较采用log-rank检验;组间两两比较,采用Bonferroni法对P值进行校正。采用Cox比例风险回归模型对影响患者OS率的因素进行单因素及多因素分析。本研究所有检验采用双侧检验,以P<0.05表示差异有统计学意义。
本研究3组不同诊断时间组患者的一般资料比较结果显示,患者的诊断年龄、人种、调整后家庭中位年收入及居住地构成比分别比较,差异均有统计学意义(χ2=108.035、38.721、274.437、28.377,P<0.001、<0.001、<0.001、=0.002);仅性别构成比比较,差异无统计学差异(χ2=0.448,P=0.799)。本研究3组不同诊断时间组CML患者的一般资料比较,见表1。
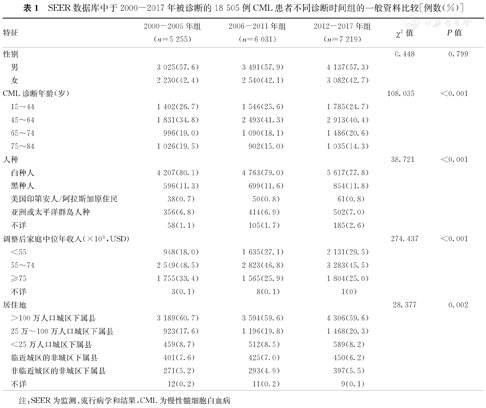
SEER数据库中于2000-2017年被诊断的18 505例CML患者不同诊断时间组的一般资料比较[例数(%)]
SEER数据库中于2000-2017年被诊断的18 505例CML患者不同诊断时间组的一般资料比较[例数(%)]
| 特征 | 2000-2005年组(n=5 255) | 2006-2011年组(n=6 031) | 2012-2017年组(n=7 219) | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 性别 | 0.448 | 0.799 | ||||
| 男 | 3 025(57.6) | 3 491(57.9) | 4 137(57.3) | |||
| 女 | 2 230(42.4) | 2 540(42.1) | 3 082(42.7) | |||
| CML诊断年龄(岁) | 108.035 | <0.001 | ||||
| 15~44 | 1 402(26.7) | 1 546(25.6) | 1 785(24.7) | |||
| 45~64 | 1 831(34.8) | 2 493(41.3) | 2 913(40.4) | |||
| 65~74 | 996(19.0) | 1 090(18.1) | 1 486(20.6) | |||
| 75~84 | 1 026(19.5) | 902(15.0) | 1 035(14.3) | |||
| 人种 | 38.721 | <0.001 | ||||
| 白种人 | 4 207(80.1) | 4 763(79.0) | 5 617(77.8) | |||
| 黑种人 | 596(11.3) | 699(11.6) | 854(11.8) | |||
| 美国印第安人/阿拉斯加原住民 | 38(0.7) | 50(0.8) | 61(0.8) | |||
| 亚洲或太平洋群岛人种 | 356(6.8) | 414(6.9) | 502(7.0) | |||
| 不详 | 58(1.1) | 105(1.7) | 185(2.6) | |||
| 调整后家庭中位年收入(×103,USD) | 274.437 | <0.001 | ||||
| <55 | 948(18.0) | 1 635(27.1) | 2 131(29.5) | |||
| 55~74 | 2 549(48.5) | 2 823(46.8) | 3 283(45.5) | |||
| ≥75 | 1 755(33.4) | 1 565(25.9) | 1 804(25.0) | |||
| 不详 | 3(0.1) | 8(0.1) | 1(0) | |||
| 居住地 | 28.377 | 0.002 | ||||
| >100万人口城区下属县 | 3 189(60.7) | 3 594(59.6) | 4 306(59.6) | |||
| 25万~100万人口城区下属县 | 923(17.6) | 1 196(19.8) | 1 468(20.3) | |||
| <25万人口城区下属县 | 459(8.7) | 512(8.5) | 589(8.2) | |||
| 临近城区的非城区下属县 | 401(7.6) | 425(7.0) | 450(6.2) | |||
| 非临近城区的非城区下属县 | 271(5.2) | 293(4.9) | 397(5.5) | |||
| 不详 | 12(0.2) | 11(0.2) | 9(0.1) | |||
注:SEER为监测、流行病学和结果,CML为慢性髓细胞白血病
本研究对18 505例CML患者的随访时间截至2017年12月31日,中位随访时间为7.1年(3.3~11.7年)。18 505例CML患者中位OS期为13.4年(未达到~3.8年),5年OS率为70.9%。截至随访结束,15~44、45~64、65~74、75~84岁组CML患者的中位OS期分别为未达到(未达到~14.5年)、未达到(未达到~7.3年)、7.8年(13.8~2.3年)和2.8年(6.8~0.8年),5年OS率分别为87.0%、80.5%、61.0%和34.3%(表2、图1)。随着CML患者诊断年龄的增加,其OS率降低,并且差异有统计学意义(4组总体比较:χ2=4765.639,P<0.001;任意2组比较:P<0.008)。
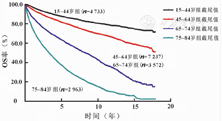

注:SEER为监测、流行病学和结果,CML为慢性髓细胞白血病,OS为总体生存

本研究SEER数据库中于2000-2017年被诊断的18 505例CML患者的5年OS率(%)
本研究SEER数据库中于2000-2017年被诊断的18 505例CML患者的5年OS率(%)
| 组别 | 例数 | 2000-2005年(n=5 255) | 2006-2011年(n=6 031) | 2012-2017年(n=7 219) | 2000-2017年(n=18 505) |
|---|---|---|---|---|---|
| 15~44岁组 | 4 733 | 81.9 | 89.1 | 90.6 | 87.0 |
| 45~64岁组 | 7 237 | 74.7 | 82.1 | 83.7 | 80.5 |
| 65~74岁组 | 3 572 | 48.8 | 65.1 | 68.9 | 61.0 |
| 75~84岁组 | 2 963 | 29.0 | 34.9 | 38.8 | 34.3 |
注:SEER为监测、流行病学和结果,CML为慢性髓细胞白血病,OS为总体生存
截至随访结束,2000-2005、2006-2011、2012-2017年组CML患者的中位OS期分别为10.2年(未达到~2.2年)、未达到(未达到~4.6年)、未达到(未达到~5.5年),5年OS率分别为62.7%、73.7%和75.6%(表2、图2)。随着患者诊断时间的推后,其OS率逐渐升高,并且差异均有统计学意义(3组总体比较:χ2=273.461, P<0.001;任意2组比较:P<0.017)。
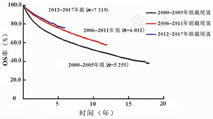

注:SEER为监测、流行病学和结果,CML为慢性髓细胞白血病,OS为总体生存
对不同年龄组患者进行诊断时间分层生存分析的结果显示,15~44岁组和45~64岁组CML患者中,2006-2011年者(n=1 546、2 493)的OS率均显著高于2000-2005年者(n=1 402、1 831)(χ2=24.727、35.008,P<0.001、0.001);2012-2017年者(n=1 785、2 913)的OS率,亦均显著高于2000-2005年者(n=1 402、1 831)(χ2=41.189、56.553,P<0.001、0.001);但2006-2011年与2012-2017年者的OS分别比较,差异均无统计学意义(χ2=0.749、3.749,P=0.387、0.053)(图3A~B)。65~74岁和75~84岁组的CML患者中,2006-2011年者(n=1 090、902)的OS率均显著高于2000-2005年者(n=996、1 026)(χ2=45.041、11.456,P<0.001、=0.001),2012-2017年者(n=1 486、1 035)的OS率,亦均显著高于2006-2011年者(n=1 090、902)(χ2=6.000、10.228,P=0.014、0.001)(图3C~D)。
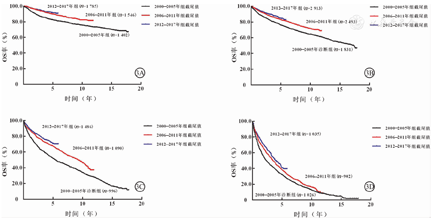

注:SEER为监测、流行病学和结果,CML为慢性髓细胞白血病,OS为总体生存
对可能影响本研究18 505例CML患者OS率的因素进行的单因素及多因素Cox比例风险模型分析结果显示,男性(女性患者比男性患者:HR=0.801,95%CI:0.761~0.842,P<0.001),年龄≥45岁(45~64、65~74、75~84岁组患者分别比15~44岁组:HR=1.756,95%CI:1.611~1.914,P<0.001;HR=4.349,95%CI:3.985~4.747,P<0.001;HR=9.147,95%CI:8.396~9.964,P<0.001),诊断时间在2005年之前(2006-2011年组、2012-2017年组患者分别比2000-2005年组患者:HR=0.730,95%CI:0.689~0.773,P<0.001;HR=0.579,95%CI:0.538~0.623,P<0.001),调整后家庭中位年收入<55 000 USD(调整后家庭中位年收入为55 000~74 999、≥75 000 USD患者分别比<55 000者:HR=0.905,95%CI:0.852~0.962,P=0.001;HR=0.786,95%CI:0.733~0.843,P<0.001)及黑色人种(黑色人种患者比白色人种患者:HR=1.334,95%CI:1.236~1.439,P<0.001)为CML患者OS率的独立危险因素。本研究18 505例CML患者OS率影响因素的Cox风险比例回归模型的单因素及多因素分析,见表3。

本研究SEER数据库中于2000-2017年被诊断的18 505例CML患者OS率影响因素的Cox风险比例回归模型的单因素及多因素分析
本研究SEER数据库中于2000-2017年被诊断的18 505例CML患者OS率影响因素的Cox风险比例回归模型的单因素及多因素分析
| 影响因素 | 单因素分析 | 多因素分析 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Wald值 | HR值 | HR值95%CI | P值 | Wald值 | HR值 | HR值95%CI | P值 | ||
| 性别(以男性为对照) | |||||||||
| 女 | 24.855 | 0.880 | 0.837~0.925 | <0.001 | 74.033 | 0.801 | 0.761~0.842 | <0.001 | |
| 诊断年龄(岁,以15~44岁为对照) | |||||||||
| 45~64 | 150.080 | 1.707 | 1.567~1.860 | <0.001 | 164.982 | 1.756 | 1.611~1.914 | <0.001 | |
| 65~74 | 1 048.957 | 4.199 | 3.850~4.580 | <0.001 | 1 086.194 | 4.349 | 3.985~4.747 | <0.001 | |
| 75~84 | 2 557.286 | 8.876 | 8.156~9.660 | <0.001 | 2 567.100 | 9.147 | 8.396~9.964 | <0.001 | |
| 诊断时间(年,以2000-2005年为对照) | |||||||||
| 2006-2011 | 143.16 | 0.706 | 0.667~0.747 | <0.001 | 114.716 | 0.730 | 0.689~0.773 | <0.001 | |
| 2012-2017 | 217.353 | 0.579 | 0.538~0.622 | <0.001 | 214.044 | 0.579 | 0.538~0.623 | <0.001 | |
| 人种(以白种人为对照) | |||||||||
| 黑种人 | 1.853 | 1.054 | 0.977~1.136 | 0.173 | 55.139 | 1.334 | 1.236~1.439 | <0.001 | |
| 美国印第安人/阿拉斯加原住民 | 0.173 | 0.941 | 0.709~1.251 | 0.677 | 4.913 | 1.417 | 1.041~1.928 | 0.027 | |
| 亚洲或太平洋群岛人种 | 36.298 | 0.712 | 0.637~0.795 | <0.001 | 0.955 | 0.946 | 0.846~1.058 | 0.328 | |
| 调整后家庭中位年收入(×103 USD,以<55×103 USD为对照) | |||||||||
| 55~75 | 15.260 | 0.887 | 0.835~0.942 | <0.001 | 10.299 | 0.905 | 0.852~0.962 | 0.001 | |
| ≥75 | 41.216 | 0.800 | 0.748~0.857 | <0.001 | 45.789 | 0.786 | 0.733~0.843 | <0.001 | |
| 居住地(以>100万人口的城区下属县为对照) | |||||||||
| 25万~100万人口的城区下属县 | 6.223 | 1.086 | 1.018~1.159 | 0.013 | - | - | - | - | |
| <25万人口的城区下属县 | 9.792 | 1.151 | 1.054~1.257 | 0.002 | - | - | - | - | |
| 临近城区的非都市下属县 | 19.111 | 1.231 | 1.122~1.352 | <0.001 | - | - | - | - | |
| 非临近城区的非城区下属县 | 28.927 | 1.333 | 1.200~1.480 | <0.001 | - | - | - | - | |
注:"-"表示未纳入多因素回归方程,故无统计学结果。SEER为监测、流行病学和结果,CML为慢性髓细胞白血病,OS为总体生存
截至随访2017年12月31日,本研究18 505例CML患者中,死亡患者为6 310例,全因死亡率为34.1%。其中,1 921例(30.4%)因CML死亡,1 812例(28.7%)因并发其他肿瘤疾病死亡,2 486例(39.4%)因非肿瘤原因死亡,91例(1.4%)死亡原因不明。不同年龄组CML患者中,15~44岁组的死亡患者为747人,主要死亡原因为CML,占54.1%(404/747);45~64、65~74和75~84岁组的死亡患者分别为1 768、1 660和2 135例,主要死亡原因均为非肿瘤原因,占比分别为37.4%(661/1 768)、44.4%(737/1 660)和43.8%(936/2 135)(表4)。随着CML患者诊断年龄的增加,因非肿瘤和非CML的其他肿瘤原因死亡患者占比逐渐增加,因CML死亡患者占比逐渐减少。不同年龄组CML患者的死亡原因构成比比较,差异有统计学意义(χ2=309.933,P<0.001)。不同诊断时间组CML患者中,2000-2005年、2006-2011年和2012-2017年组的死亡患者分别为3 024、2 159和1 127例,3组患者的主要死亡原因均为非肿瘤原因,占比分别为36.9%(1 116/3 024)、41.0%(886/2 159)和42.9%(484/1 127)(表5)。随着CML患者诊断时间的推后,非肿瘤原因死亡患者占比逐渐增加,因CML死亡患者占比逐渐减少。不同诊断时间组CML患者的死亡原因构成比比较,差异有统计学意义(χ2=24.787,P<0.001)。

本研究6 310例死亡CML患者不同年龄组的死亡原因构成比比较[例数(%)]
本研究6 310例死亡CML患者不同年龄组的死亡原因构成比比较[例数(%)]
| 组别 | 例数 | CML | 非CML的其他肿瘤 | 非肿瘤原因 | 死亡原因不明 |
|---|---|---|---|---|---|
| 15~44岁组 | 747 | 404(54.1) | 170(22.8) | 152(20.3) | 21(2.8) |
| 45~64岁组 | 1 768 | 587(33.2) | 488(27.6) | 661(37.4) | 32(1.8) |
| 65~74岁组 | 1 660 | 412(24.8) | 490(29.5) | 737(44.4) | 21(1.3) |
| 75~84岁组 | 2 135 | 518(24.3) | 664(31.1) | 936(43.8) | 17(0.8) |
| 合计 | 6 310 | 1 921(30.4) | 1 812(28.7) | 2 486(39.4) | 91(1.4) |
| χ2值 | 309.933 | ||||
| P值 | <0.001 | ||||
注:CML为慢性髓细胞白血病

本研究6 310例死亡CML患者不同诊断时间组的死亡原因构成比比较[例数(%)]
本研究6 310例死亡CML患者不同诊断时间组的死亡原因构成比比较[例数(%)]
| 组别 | 例数 | CML | 非CML的其他肿瘤 | 非肿瘤原因 | 死亡原因不明 |
|---|---|---|---|---|---|
| 2000-2005年组 | 3 024 | 986(32.6) | 883(29.2) | 1 116(36.9) | 39(1.3) |
| 2006-2011年组 | 2 159 | 643(29.8) | 597(27.7) | 886(41.0) | 33(1.5) |
| 2012-2017年组 | 1 127 | 292(25.9) | 332(29.5) | 484(42.9) | 19(1.7) |
| 合计 | 6 310 | 1 921(30.4) | 1 812(28.7) | 2 486(39.4) | 91(1.4) |
| χ2值 | 24.787 | ||||
| P值 | <0.001 | ||||
注:CML为慢性髓细胞白血病
CML是一种发病率较高的骨髓增殖性肿瘤,SEER数据库在线网站2014-2018年数据显示,CML发病率占白血病的13.3%,1975-2018年CML全球年发病率为(1.6~2.1)/10万。在TKI前时代,CML患者生存极差,20~44、45~64和≥65岁CML患者的5年OS率分别为40.1%、46.4%和20.0%[8]。既往研究发现,BCR-ABL1融合基因编码能自发活化的、具有酪氨酸激酶活性的BCR-ABL1癌蛋白,在CML的发生、发展中发挥重要作用[9,10]。靶向抑制酪氨酸激酶的伊马替尼的问世,可显著改善CML患者预后[3]。国外多项基于CML患者人群的大样临床本研究结果均显示,伊马替尼在CML治疗中的普及可显著改善CML患者的预后[11,12]。在临床试验中,后续问世的各类TKI相较于第1代TKI伊马替尼使CML患者生存获益不显著[4,5,6,7],但是在临床实践中发现,随着TKI种类的增加,CML患者生存获益似有增加。目前暂无针对不同TKI可及性的CML特大样本的预后研究。
因此,本研究基于美国SEER数据库中较完整的资料,分析2000-2017年新诊断的18 505例CML患者的预后。本研究发现,随着CML患者诊断年龄的增加,其OS率逐渐降低,与既往研究结果一致[8,13,14,15],这提示诊断年龄依然是影响CML患者生存的重要因素。本研究3组不同诊断时间患者的诊断时间分别对应不同的TKI时代:2000-2005年仅有伊马替尼1种TKI用于CML临床治疗,2006-2011年CML患者可获得伊马替尼、达沙替尼和尼洛替尼3种TKI治疗,而2012-2017年CML患者可获的伊马替尼、达沙替尼、尼洛替尼、博苏替尼和普纳替尼5种TKI治疗。本研究还发现,随着CML患者诊断时间的推后,即应用于CML治疗的TKI种类增加,患者的OS率增加,但这与既往临床试验的结果不同[4,5,6,7]。虽然既往临床试验显示,接受第2代TKI与伊马替尼治疗CML患者的生存率比较,差异无统计学意义(P>0.05)[4,5,6,7],但是在真实世界中,2006年后达沙替尼和尼洛替尼应用于CML治疗,CML患者OS率较前确有显著提高(图2),并且2012年后随着博苏替尼和普纳替尼应用于CML治疗,CML患者OS率又进一步较前显著提高(图2)。本研究进一步比较不同年龄组CML患者不同诊断时间分层的生存获益情况,发现2006-2011年达沙替尼和尼洛替尼应用于CML治疗后,15~84岁CML患者均有明显的生存获益(图3);2012-2017年博苏替尼和普纳替尼应用于CML治疗后,年龄≥65岁患者获得显著的生存获益(图3),而年龄<65岁患者生存获益暂不明显(图3)。
本研究单因素及多因素Cox比例风险回归模型分析结果显示,男性、年龄≥45岁、TKI可及性差(2000-2005年诊断)、家庭年收入低是CML患者OS的独立危险因素(表3)。因此,在临床实践中,建议当对CML患者病情控制不佳时,可与患者及家属积极沟通更换TKI治疗;年龄大、男性及家庭收入低的CML患者预后相对较差,建议与这些患者及家属积极沟通,在条件允许的情况下尽可能采取更积极的监测和治疗措施,如新一代TKI的替换,以期使患者获得最佳的生存获益。
本研究中涉及的CML患者人种最多的是白种人,占比78.8%;黑种人CML患者占比11.6%,预后差于白种人患者;亚洲或太平洋群岛人种CML患者占比6.9%,与白种人患者预后相当。笔者对本研究18 505例CML患者笔者进行亚洲或太平洋群岛人种分层发现,不同诊断时间组及年龄组患者中,各分层人群与总人群生存结局一致(待发表)。因此,推测本研究的主要结论对国内CML患者的治疗及预后评估,有一定的提示和借鉴意义。
本研究亦存在一定的局限性。首先,因为SEER数据库中CML-CP、CML-AP和CML-BC使用同一套疾病编码,因此本研究无法单独分析不同CML阶段患者具体的生存及死亡原因差异,只能获得CML患者的总体生存及预后结果。其次,因为美国以外地区研究者无法获取SEER数据库中CML患者医保相关数据,所以笔者仅能获取最基本的生存相关信息和人口学资料,更详细的临床信息,如具体治疗、疗效评价及疾病进展情况等无法获取,难以进行更深入的研究。
本研究结果提示,在真实世界中,随着应用于治疗CML的新型TKI种类的增加,CML患者的预后逐渐改善,同时因CML死亡的患者占比逐渐减少;性别、诊断年龄、家庭收入,以及TKI可及性是影响CML患者生存预后的独立因素。以上结论对国内CML患者的治疗及临床医疗实践,有借鉴意义和临床价值。
所有作者均声明不存在利益冲突



























