
糖基磷脂酰肌醇(GPI)锚定的跨膜糖蛋白CD160作为免疫球蛋白超家族(IgSF)成员,可通过与自然杀伤(NK)细胞和T细胞作用影响机体免疫功能。根据是否存在免疫球蛋白(Ig)结构域和细胞膜表面锚定方式的差异,CD160分子可被分为4种异构体。CD160与其配体疱疹病毒进入介质(HVEM)形成的CD160-HVEM复合体是IgSF和肿瘤坏死因子受体超家族(TNFRSF)间直接相互作用的特例,并且根据靶细胞的不同,CD160-HVEM复合体可产生共刺激或共抑制信号,从而调控免疫应答。HVEM作为一个信号分子开关,与不同信号通路相互作用,形成HVEM网络,在免疫应答中发挥重要作用。现有研究结果表明,CD160在多种恶性肿瘤、慢性病毒感染性疾病、自身免疫性疾病、实体器官移植后宿主抗移植物反应等疾病中均发挥作用。笔者对CD160的结构及特点、CD160异构体、CD160-HVEM复合体、HVEM网络,以及CD160在人类疾病中作用的研究新进展进行阐述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
CD160作为一种糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)介导的跨膜糖蛋白,是免疫球蛋白(immunoglobulin, Ig)超家族(Ig super family,IgSF)成员。CD160在多种免疫细胞中都有表达,目前已发现CD160存在4种异构体。CD160能够和其配体相互作用发挥共刺激或共抑制信号,从而在免疫系统中发挥重要作用。既往认为,仅有自然杀伤(natural killer, NK)细胞和T细胞可表达CD160 mRNA,而有研究表明,CD160也可表达于人类恶性B细胞肿瘤细胞[1,2]。例如,在慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)以及变异型毛细胞白血病(hairy cell leukemia,HCL)细胞中,CD160+细胞能够提供生存和激活信号,其细胞内信号通路与正常NK细胞和T细胞相同[1,2]。与正常B细胞相比,恶性B细胞中CD160存在限制性表达,提示其可能是恶性B细胞肿瘤的特异性标志物。为了进一步探讨CD160的作用,笔者拟就CD160的结构及特点,CD160异构体,CD160-疱疹病毒进入介质(herpesvirus entry mediator,HVEM)复合体,HVEM网络,以及CD160在人类疾病中作用的研究新进展阐述如下。
人类CD160蛋白由181个氨基酸残基组成,分子质量为19.81 kDa,并且由于翻译后修饰(28位和137位的天冬酰胺残基发生N-糖基化),其实际分子量可能更大[3]。CD160由1个信号肽(26个氨基酸)、1个胞外区(133个氨基酸)和1个前肽(22个氨基酸)组成,其C末端的S159能够被GPI酰胺化[3]。
CD160主要在NK细胞、T细胞、NKT细胞、CD56dimCD16+NK细胞、γδ T细胞、CD8+CD28-T细胞、肠上皮内淋巴细胞和极少数CD4+T细胞上表达[3]。人外周血单个核细胞中的CD4+T细胞上CD160表达水平较低,仅为5%~8%[4,5]。
CD160分子通过磷酸肌醇-3激酶(phosphoinositide-3 kinase,PI3K)诱导NK细胞中蛋白激酶B(protein kinases B, PKB,又被称为Akt)磷酸化和下游相关激酶产生促生存信号。同时CD160有助于增强CD3分子诱导的细胞杀伤力及CD8+ T细胞的增殖[2,6]。有文献报道,在CD8+ T细胞中,仅有表达CD160的细胞具有细胞毒活性[1]。
CD160能够以低亲和力结合主要组织相容性复合体(major histocompatibility complex, MHC)-Ⅰa和MHC-Ⅰb ,触发外周血NK细胞的细胞毒作用,并产生包括γ干扰素,肿瘤坏死因子(tumor necrosis factor,TNF)-α,白细胞介素(interleukin,IL)-6,-8在内的细胞因子[1,6](图1,A途径)。在激活的NK细胞中,CD160对于γ干扰素的有效产生不可或缺。
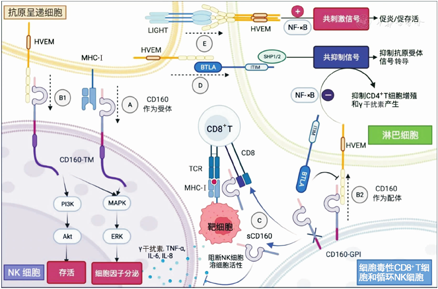

注:HVEM为疱疹病毒进入介质,MHC为主要组织相容性复合体,LIGHT为淋巴毒素类似物,NF为核转录因子,BTLA为B、T细胞衰减因子,ITIM为免疫受体酪氨酸抑制基序,SHP为含Src同源2结构域蛋白酪氨酸磷酸酶,NK为自然杀伤,TCR为T细胞受体,PI3K为磷酸肌醇-3激酶,Akt为蛋白激酶B,MAPK为促丝裂原活化蛋白激酶,ERK为细胞外调节蛋白激酶,sCD160为可溶性CD160,TNF为肿瘤坏死因子,IL为白细胞介素,CD160-TM为CD160跨膜异构体,GPI为糖基磷脂酰肌醇。A途径表示CD160以低亲和力结合MHC-Ⅰ,触发外周血NK细胞的细胞毒作用,并产生γ干扰素、TNF-α、IL-6和IL-8等细胞因子。B途径表示CD160-HVEM复合体具有双向调节信号作用。B1途径表示抗原呈递细胞上的HVEM与活化NK细胞的CD160结合,可通过PI3K/Akt信号通路传递促生存信号,通过MAPK/ERK信号通路增加NK细胞的功能活性和细胞因子分泌。B2途径表示细胞毒性淋巴细胞上表面表达的CD160与T细胞上的HVEM结合,通过抑制NF-κB活化,抑制CD4+T细胞的增殖和γ干扰素的产生。C途径表示固定在细胞膜上的CD160-GPI异构体可被金属蛋白酶切割成为sCD160,sCD160可与CD8竞争结合MHC-Ⅰ类的α3亚基,抑制CD8+ T细胞的细胞毒性功能;同时可抑制NK细胞溶细胞活性。D途径表示BTLA与CD160竞争相同的HVEM结合位点;HVEM作为配体与BTLA结合,其细胞内结构域中的ITIM磷酸化后招募SHP1/2 ,抑制T细胞早期激活的下游信号分子。E途径表示膜结合的LIGHT与HVEM结合通过NF-κB传递共刺激信号,产生促炎、促生存信号。
目前根据是否存在Ig结构域及其细胞膜表面锚定方式[通过GPI结构域或跨膜(transmembrane,TM)结构域],人类已从NK细胞中分离出4种CD160异构体,分别为:CD160-GPI、CD160ΔIg-GPI、CD160-TM和CD160ΔIg-TM[3,7]。通过TM结构域锚定的CD160异构体,均包含胞内结构域(图1)。
CD160-GPI最初是在外周血功能性细胞毒性NK细胞上发现[2]。Giustiniani等[7]研究证实,细胞毒性CD8+T细胞和外周血NK细胞表达CD160-GPI,但上述细胞均不表达2种含TM结构域的异构体(CD160-TM和CD160ΔIg-TM)。这2种CD160异构体的表达仅局限于NK细胞,并且依赖于NK细胞的激活。研究结果显示,移除GPI锚定并将其替换为细胞内结构域和TM结构域,可导致胞外结构域发生不同构象变化,从而影响CD160对抗体的识别能力[7]。Giustiniani等[7]在外周血NK细胞上对CD160异构体转录子的表达进行检测,结果显示,在静息NK细胞表面可检测到含GPI结构域的异构体(CD160-GPI和CD160ΔIg-GPI),而未检测到含TM结构域的异构体(CD160-TM和CD160ΔIg-TM)。应用IL-15进行细胞培养激活NK细胞后,CD160-TM表达水平较低,同时激活过程并未影响含GPI结构域异构体的表达水平。上述研究表明,NK细胞未被激活则无法实现含TM结构域异构体的表达。该研究同样证实,CD160-TM的胞内结构域本身就具有能够激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2通路的作用,其第225位的酪氨酸残基负责传递激活信号。
此外,与膜结合的CD160在激活后可以从细胞表面被切断,释放可溶性CD160(soluble CD160,sCD160)[8]。sCD160可在原位与靶细胞上的MHC-Ⅰ类分子结合,抑制CD8+ T细胞效应功能[8]。这为调控细胞毒性CD8+T细胞的活性提供了一种生理机制的解释[6,8]。同时sCD160可阻断NK细胞的溶细胞活性(图1,C途径)。
目前已有研究表明,CD160蛋白既有抑制功能又有激活功能[4,8]。CD160的抑制功能类似于细胞毒性T淋巴细胞相关抗原(cytotoxic T-lymphocyte associated antigen,CTLA)-4,CD160的TM结构域可激活NK细胞,而sCD160可抑制CD8+T细胞及NK细胞。这表明,CD160根据不同的胞外结构域,可以传递抑制或刺激信号[7,8]。
HVEM,亦称为疱疹病毒进入介质(herpesvirus entry mediator A,HVEA)或TNF受体超家族(receptor super family,TNFRSF)14,是由283个氨基酸残基组成的Ⅱ型跨膜蛋白,具有胞外结构域、TM结构域和胞内结构域[4]。HVEM在T细胞、B细胞、NK细胞、树突状细胞,以及内皮细胞等多种免疫细胞表面均有表达[4,9]。HVEM能够与CD160和B、T细胞衰减因子(B- and T-lymphocyte attenuator,BTLA)等IgSF结合,向T细胞提供抑制信号[5,10]。同时,HVEM也能够与TNFSF成员淋巴毒素(lymphotoxin,LT)α或与单纯疱疹病毒的糖蛋白D竞争结合HVEM的淋巴毒素类似物(homologous to lymphotoxins,exhibits inducible expression,and competes with herpesvirus glycoprotein D for HVEM, an acceptor expressed by T lymphocytes, LIGHT)结合,向T细胞提供激活信号[4,10]。信号分子相互作用的一般规律是IgSF、TNFSF配体分别与相应受体结合,而作为TNFSF成员的HVEM,能够通过不同的结合位点,分别与2种IgSF配体均产生相互作用[10]。因此,CD160-HVEM和BTLA-HVEM复合体是2种不同超家族直接相互作用的特例[9]。
CD160可通过富半胱氨酸结构域(cysteine rich domain,CRD)1与HVEM蛋白结合,形成CD160-HVEM复合体[11]。既往研究结果表明,CRD1结构域对HVEM与CD160蛋白或BTLA蛋白的结合均为必须结构,这2种蛋白与HVEM的结合位点可能存在一定程度上的相互重叠,因此CD160与BTLA可能竞争性结合HVEM[5,9,10]。CD160的4种异构体中,CD160-GPI, CD160-TM能够被HVEM蛋白识别,也就是说Ig结构域对形成CD160-HVEM复合体具有必需性。HVEM蛋白能够与这2种异构体结合,但与CD160-TM异构体的结合相对较弱。
CD160-HVEM复合体在不同类型细胞上的功能不同。在T淋巴细胞中,HVEM和CD160形成反式接触,传递共抑制信号,能够抑制CD4+ T细胞的增殖和γ干扰素的产生[5](图1,B2途径)。相反,在NK细胞中,HVEM与CD160相互作用可通过磷酸化Akt和ERK1/2传递共刺激信号,发挥促进CD69分化、炎性细胞因子表达、NK细胞脱颗粒(可通过CD107α表达衡量),以及溶细胞作用[12](图1,B1途径)。在黏膜系统中,上皮内淋巴细胞上的CD160与上皮细胞表面的HVEM相互作用,激活STAT3/Reg3信号通路,从而增强黏膜固有免疫应答,为宿主抵御病原微生物感染提供防御功能[13]。
HVEM是一个双向分子开关,能够传递正向或负向信号,与不同配体相互作用,形成信号通路网,即HVEM网络。HVEM作为TNF超家族成员,可与TNF超家族配体LIGHT结合。HVEM上与LIGHT的结合位点不同于该分子与CD160和BTLA的结合位点,其为CRD2和CRD3结构域。细胞膜表面的LIGHT可与T细胞上的HVEM结合,通过HVEM传递共刺激信号,进一步促进T细胞存活[10,14](图1,E途径)。
BTLA属于IgSF受体超家族,在大多数淋巴系造血细胞的细胞膜上均有不同程度的表达。其中,BTLA在B细胞中表达水平较高,在CD4+ T细胞中较低,在CD8+ T细胞中更低;在NK细胞、NKT细胞和髓系细胞中亦有少量表达。BTLA的胞内结构域含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motifs, ITIM),其磷酸化后可招募含Src同源2结构域蛋白酪氨酸磷酸酶(Src homology domain 2 containing protein tyrosine phosphatases, SHP)-1和-2,从而抑制抗原受体信号转导(图1,D途径)。由于BTLA与CD160可竞争性结合HVEM,在稳态(非炎症)条件下,HVEM和BTLA的顺式相互作用可产生对T细胞活化的抑制信号[14]。
在HVEM网络中,IgSF与TNFSF分子之间发生相互作用,在免疫相关疾病或癌症免疫治疗中为增强或减弱免疫反应提供多个靶向分子。虽然HVEM同时具有共刺激和共抑制功能,但共抑制信号的传递可能比促炎信号显得更重要。通过LIGHT刺激免疫细胞、CD160刺激NK细胞,或解除HVEM和BTLA的抑制作用,可能对增强免疫细胞抗肿瘤作用具有重要意义。
已有多项研究表明,CD160蛋白在多种人类疾病的免疫调控中发挥重要作用。例如、多种恶性肿瘤[2,15,16,17,18]、慢性病毒感染性疾病[19,20,21]、自身免疫性疾病[22]、实体器官移植后宿主抗移植物反应[8,23,24]、疟疾[25]、阵发性夜间血红蛋白尿[26]、动脉粥样硬化[27]、皮肤炎[6]、急性肝损伤[28]和视网膜血管疾病[29]等。
虽然目前恶性肿瘤的治疗进展日新月异,但是仍需不断探寻能够影响该类患者预后的生物标志物和治疗靶点。CD160可在T细胞和B细胞上表达,并可参与CLL[2,15]、结直肠癌[16]和胰腺癌[17]等多种恶性肿瘤的发生、发展,因此CD160可能是具有临床前景的靶标之一。
研究结果显示,在人类结肠癌病变组织中的新生血管内皮细胞上表达CD160蛋白,而在健康组织血管中未观察到上述现象,这提示CD160在肿瘤新生血管形成中发挥作用[18]。在结直肠癌肿瘤组织中CD160与程序性死亡因子(programmed cell death,PD)-1、CTLA-4等mRNA水平同时升高,提示CD160及其他蛋白可能参与结直肠癌的发生、发展[16]。CD160可在人恶性B细胞中表达。Farren等[1]研究结果显示,811例B细胞增生性疾病患者中,100%HCL患者(32/32)、98%CLL患者(590/600)、15%套细胞性淋巴瘤患者(5/34)和16%其他B细胞增殖性疾病患者(23/145)的B细胞均存在CD160表达;而CD160在健康对照者(n=30)的B细胞中未见表达。与正常B细胞相比,CD160在恶性B细胞中的限制性表达,提示其是恶性B细胞肿瘤的特异性标志物。CLL属于淋巴增生性疾病,以外周血、骨髓、淋巴结和脾中有特异性免疫表型的未成熟B细胞聚集为特征。CLL细胞可发生自发性凋亡,而CD160可增加其存活率及活性。这是由于CD160招募PI3K并诱导Akt磷酸化,而Akt的激活则增加抗凋亡蛋白的表达,因此CLL细胞能持续存活。此外,CLL细胞可通过CD160,明显增强IL-6和IL-8的分泌[2]。Bozorgmehr等[15]发现,CLL患者的CD8+和CD4+T细胞表面也可检测到CD160表达,CD160表达的上调可能与耗竭T细胞表型相关。
目前,一项关于采用CD160-TM单克隆抗体治疗人黑素瘤的临床试验(NCT04477876)正在受试者招募中。该临床试验可从证明CD160应用于肿瘤治疗的重要性。
人类免疫缺陷病毒(human immunodeficiency virus,HIV)[20],丙型肝炎病毒[6],EB病毒和巨细胞病毒等慢性病毒感染中,CD8+T细胞上CD160受体表达增加[30]。在乙型肝炎病毒感染中,CD160长链非编码RNA表达减少[31]。
目前,对于CD160在慢性HIV感染中的作用仍存争议。在慢性HIV感染刺激下,CD160与PD-1受体的共表达,可引起CD8+T细胞耗竭,导致机体对持续感染的正确免疫反应受到抑制[20]。若阻断CD160与HVEM的相互作用,可增加HIV特异性CD8+T细胞增殖和γ干扰素、IL-4、IL-10的产生。近期亦有研究表明,CD160在慢性HIV感染中具有保护作用:触发CD8+T细胞表面的CD160,可通过其胞内结构域激活MAPK/ERK和PI3K/Akt信号通路正向调节CD8+T细胞,从而增强特定表位CD8+T细胞发生脱颗粒,以诱发免疫应答[21]。
CD160在人类嗜T细胞淋巴病毒(human T lymphotropic virus,HTLV)-1慢性感染中也有重要作用。HTLV-1属逆转录病毒科,主要感染CD4+T细胞,2%~6%携带者可发展为成年人T细胞淋巴瘤/白血病(adult T-cell lymphoma/leukemia, ATL)。ATL是一种预后很差、侵袭性很强的T细胞肿瘤,急性ATL患者的中位生存时间仅为数月。ATL的主要特点是恶性细胞单克隆转化导致CD8+T细胞功能缺陷。CD160和其他共抑制分子的表达会导致CD8+T细胞耗竭及T细胞功能受损,从而导致HTLV-1感染持续存在。因此,CD160受体可以作为反映CD8+T细胞耗竭程度的标志物[19]。此外,在HTLV-1感染T细胞中,阻断CD160-HVEM复合体的形成,能够增加CD107α脱颗粒水平和穿孔素的产生,从而增加CD8+T细胞的效应功能,发挥正确免疫应答[19]。因此,HTLV-1特异性的CD8+T细胞是通过CD160-HVEM复合体的抑制宿主反应,从而导致HTLV-1感染的持续存在。
自身免疫性疾病是一组因免疫系统功能受损而导致机体自身细胞和组织受损和破坏的复杂疾病。信号分子在调节T细胞介导的免疫反应中发挥重要作用,刺激和抑制途径之间的平衡至关重要。目前,CD160信号分子在自身免疫性疾病中的作用尚未完全确定。
He等[22]研究结果显示,CD160表达是自身免疫疾病的重要特征,CD160信号通路的功能障碍在自身免疫性疾病的发生、发展中起重要作用。该研究还提示,CD160的表达存在疾病特异性差异,这有助于系统性红斑狼疮、炎症性肠病、幼年特发性关节炎、Graves病等自身免疫性疾病的诊断。但是,由于CD160并不能作为上述自身免疫疾病的唯一诊断标志物。因此,将CD160表达与其他自身免疫性疾病诊断相结合的策略,仍在探索中。
在获得性再生障碍性贫血患者的CD8+记忆T祖细胞[32]、类风湿性关节炎患者的CD8+T细胞及NK细胞中,均可观察到CD160异常表达。CD160的rs744877位点与Graved病存在显著相关性(OR=0.79,95%CI:0.66~0.95,P=0.013)[33]。5例克罗恩病患者在应用巯基嘌呤治疗后,可观察到其中4例喊着外周血中CD160表达较治疗前降低[34]。上述研究结果提示,在自身免疫性疾病中,CD160可能是不正确表达的重要信号基因。
实体器官移植后宿主抗移植物反应是导致移植物损伤、功能丧失的重要原因,有效的免疫抑制是决定移植物能否长期存活的关键因素。针对T细胞活化和向效应T细胞分化过程的新治疗策略,可能在未来有助于补充目前实体器官移植中宿主抗移植物反应的治疗方案。CD160能够与MHC-Ⅰ直接结合,产生共刺激信号,触发T细胞受体诱导的细胞增殖、细胞因子释放及细胞毒效应,在移植后的免疫调节中可能发挥一定作用。
对敲除CD4-/-、CD8-/-、CD28-/-及C57BL/6野生型的小鼠进行不相合同种异体心脏移植的研究结果显示,应用抗鼠CD160单抗能够延长CD4-/-、CD28-/-及应用CTLA4抗体治疗的野生型小鼠心脏移植物的存活时间;心脏移植物存活的延长与同种异体CD8+ T细胞增殖、γ干扰素产生的减少有关[8]。在MHC-Ⅰ不相合小鼠皮肤移植模型中,联合应用抗鼠CD160抗体及抗鼠CD40L抗体能够显著抑制CD4+辅助T细胞介导的细胞毒性反应,同时可以显著延长移植物生存[24]。
关于同种异体移植过程中CD160基因缺失的影响的研究结果显示,将野生型和CD160基因敲除小鼠的T细胞移植到未接受过辐照的小鼠中,可以观察到CD160基因敲除小鼠的CD4+T细胞及CD8+T细胞相较于野生型增殖减弱。对CD160基因敲除小鼠和野生小鼠进行同种异体MHC-Ⅰ类分子不相合的皮肤移植,虽然没有发现二者皮肤移植物存活率出现显著差异;但当应用CTLA4抗体后,与野生型相比,CD160基因敲除小鼠皮肤移植物的生存趋势增强。CD160蛋白在某种程度而言可替代共刺激分子CD28,调节异体CD8+T细胞的反应,从而阻断宿主抗移植物反应过程中的共刺激作用。
由于正常免疫机制情况下,CD160几乎不表达于正常B细胞,对在肾移植后发生抗体介导的宿主抗移植物反应者进行CD160单核苷酸多态性分析,亦未发现单核苷酸多态性与肾移植后宿主抗移植物反应的发病机制间存在显著联系[35]。因此,CD160可作为预防T细胞介导的实体器官移植中宿主抗移植物反应、延长移植物生存的新治疗方向。
尽管目前对CD160的研究很多,但其在人体内的功能和作用仍需进一步的研究与讨论。到目前为止,CD160在多种恶性肿瘤、病毒感染、自身免疫疾病及实体器官移植后宿主抗移植物反应中发挥了重要作用。然而,该蛋白可能还参与了许多尚未发现的免疫系统信号通路。CD160与其配体的相互作用可能是未来寻找相关疾病的治疗新靶点的一个极具前景的方向。
所有作者声明无利益冲突



























