
供者自然杀伤(NK)细胞是异基因造血干细胞移植(allo-HSCT)后最早重建的一类淋巴细胞亚群。移植后早期,供者NK细胞可以通过其表面的杀伤细胞免疫球蛋白样受体(KIR)与靶细胞人类白细胞抗原(HLA)Ⅰ类分子特异性偶联,识别并杀伤被感染的细胞和血液肿瘤细胞,发挥抗感染和抗血液肿瘤等作用。根据供者KIR与受者HLA配型组合的不同模式,可预测NK细胞的同种异体反应性和移植结果。笔者拟就目前临床工作中常用的KIR/HLA配型模式及其对移植结果影响的研究现状进行阐述,旨在为优化供者筛选、改善移植结果和治疗提供思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是根治多种血液系统恶性疾病的有效治疗手段[1]。然而,移植后复发、感染和移植物抗宿主病(graft versus host disease,GVHD)仍是导致移植失败的主要原因,如何预防移植后感染、降低GVHD并保留移植物抗白血病(graft versus leukemia,GVL)效应,是提高移植疗效的关键问题[2,3]。自然杀伤(natural killer,NK)细胞是参与早期抗感染和免疫监视肿瘤细胞的固有免疫细胞,是allo-HSCT后首个重建的淋巴细胞亚群[4],其无需抗原呈递细胞激活,可直接通过细胞溶解和快速分泌细胞因子发挥细胞毒性杀伤功能,在移植早期发挥抗肿瘤和抗感染作用[5,6]。NK细胞的激活受抑制型和激活型受体与靶细胞上配体之间相互作用的动态调节,包括NK细胞表面杀伤细胞免疫球蛋白样受体(killer-cell immunoglobulin-like receptor,KIR)与靶细胞表面特异性人类白细胞抗原(human leukocyte antigen,HLA)Ⅰ类分子的相互作用[7,8]。研究表明,供者KIR和受者HLA的配型模式可用于预测患者接受移植后复发、感染和GVHD的发生风险,基于这种配型关系可为供者筛选和提高移植疗效提供新的方法[9,10]。笔者拟就KIR/HLA配型模式在allo-HSCT中的研究现状阐述如下。
KIR是人类成熟NK细胞表达的膜结合糖蛋白,是控制NK细胞发育和功能的关键受体[11],其结构可分为细胞膜外、跨细胞膜、细胞质区。根据细胞膜外免疫球蛋白结构域的数量,KIR可分为KIR2D(2个结构域)和KIR3D(3个结构域);KIR细胞质内蛋白质尾端的长度决定NK细胞的功能类型,根据尾端长短不同(长尾端"L"和短尾端"S"),KIR可分为抑制型KIR(inhibitory KIR,iKIR)和活化型KIR(activating KIR,aKIR),分别传递免疫抑制和活化信号[12]。目前已发现14种KIR,包括7种iKIR(KIR3DL1~3、KIR2DL1~3、KIR2DL5),6种aKIR(KIR3DS1、KIR2DS1~5)和1种a/iKIR(KIR2DL4)。
编码KIR的基因位于人染色体19q13.4,目前已发现15种功能性KIR基因和2种KIR假基因(KIR2DP1和KIR3DP1)[13],其中功能性KIR基因可分为抑制型KIR基因(KIR2DL1~4、KIR2DL5A/B和KIR3DL1~3)和活化型KIR基因(KIR2DS1~5和KIR3DS1),根据KIR基因组成,KIR可分为A和B单元型[14],A单元型KIR除与B单元型KIR共有4种KIR框架基因(KIR2DL4、KIR3DL2、KIR3DL3和KIR3DP1)外,还特有4种抑制型KIR基因(KIR3DL1、KIR2DL1、KIR2DL3和2DP1)和1种活化型KIR基因(KIR2DS4),而B单元型特有3种抑制型KIR基因(KIR2DL2和KIR2DL5A/B)和5种活化型KIR基因(KIR2DS1~3、KIR2DS5和KIR3DS1)。B单元型KIR基因组成高度可变,较A单元型有更多活化型KIR基因,因此具有更高的活化特性。根据个体的KIR基因单元型表达情况,可将其分为遗传型KIR A/A(A单元型纯合子)或KIR B/x(A/B单元型杂合子或B/B单元型纯合子)[14]。此外,框架基因KIR3DP1和KIR2DL4将KIR单元型分为着丝粒区(Cen-A,Cen-B)和端粒区(Tel-A,Tel-B)单元型[14]。
KIR基因以多种等位基因形式存在,目前已知1 532个KIR等位基因,个体在KIR基因含量、拷贝数变异、核苷酸序列多态性、编码的KIR受体数等方面具有高度的遗传变异,最终影响NK细胞的KIR表型、特异性和细胞毒性等功能[15,16]。KIR在NK细胞分化成熟晚期表达,每个NK细胞克隆只随机表达个体KIR基因谱的一部分,如遗传型KIR A/A个体的NK细胞中,约26%仅表达1种KIR基因,约9%不表达任何KIR基因,而人体中表达所有KIR基因的NK细胞比例<0.01%[17]。此外,KIR等位基因种类与KIR受体表达水平相关,如KIR3DL1/S1是最具多态性的KIR基因之一[18],KIR3DL1受体可以在细胞表面高密度(KIR3DL1-h)、低密度(KIR3DL1-l)或在细胞内(KIR3DL1-n)表达,而KIR3DS1受体只表达于细胞表面[19],不同KIR受体亚型与HLA结合的特异性和亲和力也有所差异[20,21]。在同胞HLA相合allo-HSCT中,供、受者KIR基因相合率仅为25%,而无关供者allo-HSCT中,供、受者KIR基因相合率几乎为0[17]。
KIR配体位于HLA-Ⅰ类分子(HLA-A、HLA-B或HLA-C)表面的特定表位,由人染色体6p21.3编码,可与KIR受体特异性结合[12]。每个HLA-Ⅰ类分子最多携带1个KIR配体(HLA-A3/A11、-Bw4、-C1和-C2),根据HLA-C分子肽结合沟第80位氨基酸不同,KIR配体可分为HLA-C1(天冬酰胺,识别KIR2DL2/KIR2DL3受体)和HLA-C2(赖氨酸,识别KIR2DL1受体)。约40%的HLA-B分子和17%的HLA-A分子携带HLA-Bw4配体,根据HLA-Bw4分子第80位氨基酸不同,HLA-Bw4配体又可分为HLA-Bw4-80I(异亮氨酸)和HLA-Bw4-80T(苏氨酸),二者均可识别KIR3DL1受体;16%的HLA-A分子携带HLA-A3/11,识别KIR3DL2受体[22]。
1986年,Karre等[23]首次在小鼠和人类中观察到,NK细胞可以选择性裂解缺失HLA-Ⅰ类分子的淋巴瘤细胞,而表达HLA-Ⅰ类分子的淋巴瘤细胞可避免被NK细胞裂解,因此提出了NK细胞能够识别靶细胞上"自身"HLA-Ⅰ类分子缺失的假说,即"缺失自我"假说,并证实这种识别由NK细胞抑制型受体(iKIR)完成。在健康个体中,NK细胞发育经历了一个称为"教育许可"的过程[7,24],即具有iKIR的NK细胞对缺乏同源HLA-Ⅰ类分子的靶细胞具有高反应性,而对非自身HLA-Ⅰ类分子的靶细胞反应迟钝,这种相互作用在NK细胞的自我免疫耐受机制中起主要作用[25,26]。抑制作用的强度决定NK细胞的功能,成熟NK细胞至少表达一种自身HLA-Ⅰ类分子的抑制型受体,从而避免自身反应性[27]。在自体环境中,正常细胞表达HLA-Ⅰ类分子,通过iKIR产生抑制信号,但肿瘤细胞或受病毒感染的细胞可能出现HLA-Ⅰ类分子表达下调或缺失,从而激活NK细胞,使其发挥抗感染和抗肿瘤作用[28]。
目前,移植研究相关学者已提出多种KIR/HLA配型模式,用于预测供者NK细胞的同种异体反应性,旨在优化供者选择。allo-HSCT中,常见的KIR/HLA配型模式,见表1。
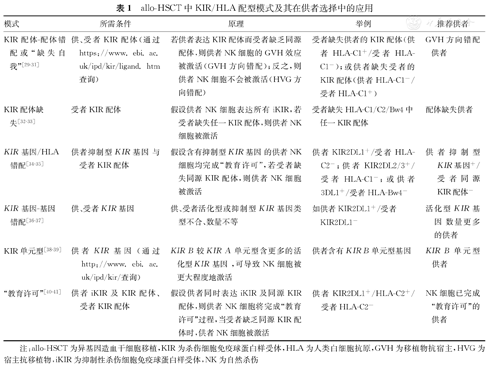
allo-HSCT中KIR/HLA配型模式及其在供者选择中的应用
allo-HSCT中KIR/HLA配型模式及其在供者选择中的应用
| 模式 | 所需条件 | 原理 | 举例 | 推荐供者 |
|---|---|---|---|---|
| KIR配体-配体错配或"缺失自我"[29,30,31] | 供、受者KIR配体(通过https://www.ebi.ac.uk/ipd/kir/ligand.htm查询) | 若供者表达KIR配体而受者缺乏同源配体,则供者NK细胞的GVH效应被激活(GVH方向错配);反之,则供者NK细胞不会被激活(HVG方向错配) | 受者缺失供者的KIR配体(供者HLA-C1+/受者HLA-C1-);或供者缺失受者的KIR配体(供者HLA-C1-/受者HLA-C1+) | GVH方向错配供者 |
| KIR配体缺失[32,33] | 受者KIR配体 | 假设供者NK细胞表达所有iKIR,若受者缺失任一KIR配体,则供者NK细胞被激活 | 受者缺失HLA-C1/C2/Bw4中任一KIR配体 | 配体缺失供者 |
| KIR基因/HLA错配[34,35] | 供者抑制型KIR基因与受者KIR配体 | 假设含有抑制型KIR基因的供者NK细胞均完成"教育许可",若受者缺失同源KIR配体,则供者NK细胞被激活 | 供者KIR2DL1+/受者HLA-C2-;供者KIR2DL2/3+/受者HLA-C1-;或供者3DL1+/受者HLA-Bw4- | 供者抑制型KIR基因+/受者同源KIR配体- |
| KIR基因-基因错配[36,37] | 供、受者KIR基因 | 供、受者活化型或抑制型KIR基因类型不合、数量不等 | 如供者KIR2DL1+/受者KIR2DL1- | 活化型KIR基因数量更多的供者 |
| KIR单元型[38,39] | 供者KIR基因(通过http://www.ebi.ac.uk/ipd/kir/查询) | KIR B较KIR A单元型含更多的活化型KIR基因,可导致NK细胞被更大程度地激活 | 供者含有KIR B单元型基因 | KIR B单元型供者 |
| "教育许可"[40,41] | 供者iKIR及KIR配体、受者KIR配体 | 假设供者同时表达iKIR及同源KIR配体,则供者NK细胞将完成"教育许可"过程,当受者缺乏同源KIR配体时,供者NK细胞被激活 | 供者KIR2DL1+/HLA-C2+/受者HLA-C2- | NK细胞已完成"教育许可"的供者 |
注:allo-HSCT为异基因造血干细胞移植,KIR为杀伤细胞免疫球蛋白样受体,HLA为人类白细胞抗原,GVH为移植物抗宿主,HVG为宿主抗移植物,iKIR为抑制性杀伤细胞免疫球蛋白样受体,NK为自然杀伤
2002年,Ruggeri等[29]首次通过动物实验及急性白血病患者临床移植结果揭示NK细胞在allo-HSCT中的作用。该研究回顾性分析92例接受体外去除T淋巴细胞模式亲缘单倍型HSCT(haploidentical HSCT,haplo-HSCT)的急性白血病患者的临床资料,并根据供、受者HLA-C分型评估是否存在GVH方向KIR配体-配体错配,将其分为无错配组和错配组。该研究结果显示,57例急性髓细胞白血病(acute myeloid leukemia,AML)患者中,相较于无错配组(n=37),错配组(n=20)患者的5年复发率显著下降(75%比0,P<0.000 8),5年无病生存率显著提高(5%比60%,P<0.000 5);多因素分析结果显示,KIR配体无错配是AML患者接受亲缘haplo-HSCT预后的独立危险因素(HR=0.33,P<0.04);但是,在35例急性淋巴细胞白血病(acute lymphoid leukemia,ALL)患者中未观察到类似结果,无错配组(n=21)与错配组(n=14)患者的5年复发率比较,差异无统计学意义(90%比85%,P>0.05)[29]。该临床研究结果提示,在接受人类体外去除T淋巴细胞haplo-HSCT的AML患者体内,供者异体反应性NK细胞具有强大的GVL效应。该团队采用非肥胖糖尿病/严重联合免疫缺陷小鼠构建的人AML模型进一步验证上述作用。该动物实验分为以下3个阶段:①根据对小鼠输注NK细胞处理的不同,将其分为实验组(n=10,输注少量异基因NK细胞)和对照组(n=20,未处理或输注同种NK细胞各10只)。结果显示,实验组小鼠体内的白血病细胞被清除并存活,而对照组小鼠均死于疾病进展,这证实异基因NK细胞具有杀伤白血病细胞作用。②构建haplo-HSCT模型小鼠,且采用大剂量全身照射(total body irradiation,TBI)9 Gy作为移植前预处理方案,并将小鼠分为实验组(n=10,输注16×106异基因NK细胞)和对照组(n=10,输注1×106供者T淋巴细胞)。结果显示,实验组小鼠均未发生GVHD并全部存活,而对照组小鼠均发生GVHD后死亡。③对haplo-HSCT模型小鼠的研究结果显示,对照组(n=6,接受9 Gy TBI预处理)和实验组3(n=6,接受7、6或5 Gy TBI预处理联合输注4×106异基因NK细胞)小鼠均获得稳定的供者造血干细胞植入,而实验组1(n=6,接受7 Gy TBI预处理)和实验组2(n=6,接受7 Gy TBI预处理联合输注4×106同种NK细胞)小鼠均植入失败[29]。该研究证实,供者异基因NK细胞具有促进GVL效应和减轻GVHD的作用,并有望减轻TBI预处理辐照剂量和促进供者造血干细胞植入等作用。该研究拉开了对NK细胞在allo-HSCT中临床应用研究的序幕,并激发更多相关研究者对NK细胞的关注和研究,为allo-HSCT供者选择提供新的思路。
2017年,Boudreau等[21]通过将KIR3DL1-H(KIR3DL1高表达)或KIR3DL1-L(KIR3DL1低表达)的NK细胞,分别与HLA-Bw4-80T/80I基因转染细胞和HLA-Bw4-80T/80I+ AML细胞系共培养发现,KIR3DL1-L+ NK细胞对HLA-Bw4-80T+细胞的亲和力和抑制作用更强,而KIR3DL1-H+ NK细胞对HLA-Bw4-80I+细胞的亲和力和抑制作用更强。该研究将不同KIR3DL1亚型健康供者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)与HLA-Bw4-80T/80I+ AML细胞系共培养发现,KIR3DL1-H+ PBMC对HLA-Bw4-80T+ AML细胞的杀伤作用,亦显著高于KIR3DL1-L+ PBMC(P=0.023 8);KIR3DL1-L+ PBMC对HLA-Bw4-80I+ AML细胞的杀伤作用,显著高于KIR3DL1-H+ PBMC(P=0.003 9),而使用抗体靶向阻断KIR3DL1受体后,KIR3DL1-L+和KIR3DL1-H+ NK对AML细胞的杀伤程度比较,差异无统计学意义(P>0.05)。这提示,不同KIR3DL1亚型NK细胞与不同HLA-Bw4亚型细胞的亲和力和抑制程度不同,并影响对AML细胞的杀伤能力。该研究进一步分析1 328例AML患者接受无关供者allo-HSCT的临床资料,多因素分析结果显示,弱抑制组(KIR3DL1-H/HLA-Bw4-80T或KIR3DL1-L/HLA-Bw4-80I,n=362)和无抑制组[KIR3DL-N和(或)HLA-Bw6,n=632)患者的5年复发率和5年总体死亡率,均显著低于强抑制组(n=334,KIR3DL1-H/HLA-Bw4-80I或KIR3DL1-L/HLA-Bw4-80T)(HR=0.72、0.84,P=0.004、0.030);并且在606例表达HLA-C1/C2的患者中发现,弱/无抑制组(n=443)的5年复发率和5年总体死亡率,亦均显著低于强抑制组(n=163)(HR=0.54、0.74,P<0.001、0.009)。该研究进一步分析供者KIR3DL1亚型对移植结果的影响发现,在437例HLA-Bw4-80T受者中,KIR3DL1-H(n=250)和KIR3DL1-N供者(n=58)的5年复发率,均显著低于KIR3DL1-L供者(n=129)(HR=0.65、0.52,P=0.031、0.058);而在363例HLA-Bw4-80I受者中,KIR3DL1-N供者(n=44)的5年复发率和5年总体死亡率,均显著低于KIR3DL1-H供者(n=210)(HR=0.52、0.64,P=0.055、0.054)。该临床研究结果证实,KIR3DL/HLA-Bw4的强抑制配型模式存在增加AML患者移植后复发和死亡的风险,而弱抑制配型模式结果则相反。因此,根据KIR3DL1亚型筛选供者,有望提高AML患者移植后的GVL效应、降低复发风险,并提高生存率。
Zhao等[42]探讨供、受者HLA及供者KIR对NK细胞重建和移植结果影响的研究发现,队列1的114例血液肿瘤患者在移植后第90~180天,d-rsKIR组(n=17,供、受者均表达供者KIR相应配体)iKIR单阳性(KIR2DL1+、KIR2DL2/L3+或KIR3DL1+)NK细胞的绝对数和对K562细胞(表达CD107a或γ干扰素)的反应性,均显著高于nsKIR组(n=62,供、受者均缺乏供者KIR相应配体),dsKIR组(n=20,供者表达而受者缺乏供者KIR相应配体)和rsKIR组(n=15,受者表达而供者缺乏供者KIR相应配体)(P<0.05)。队列2的276例髓系肿瘤患者接受haplo-HSCT后,d-rsKIR组(n=31)患者的复发率最低[d-rsKIR组比rsKIR组(n=55):0比10.0%,P=0.115;d-rsKIR组比dsKIR组(n=33):0比14.9%,P=0.039;d-rsKIR组比nsKIR组(n=156):0比18%,P=0.022)];与nsKIR组相比,d-rsKIR组患者的无白血病复发率(67.2%比87.5%,P=0.046)和总体生存率(68.1%比87.5%,P=0.066)升高。该研究结果表明,当供者和受者均表达供者iKIR的所有配体时,移植后重建的NK细胞可以发挥更好抗白血病作用,并有助于降低复发。
尽管已对不同KIR/HLA配型模式进行了大量临床研究,但没有发现单一模式普遍适用于所有移植中心的供者选择,各模式在移植结果中的作用仍存在争议。NK细胞如何影响移植后结果的确切作用机制仍不清楚。目前,通过KIR预测NK细胞同种异体反应性和发挥GVL潜力的研究仍在进行中,移植相关学者已开发出几种KIR评分系统用于预测移植结果,如供者KIR B单元型含量评分,抑制型KIR基因和HLA相互作用评分,或综合评分等[43,44],各评分系统在allo-HSCT中的临床意义仍存在争议,尚未在临床工作中推广。2019年欧洲骨髓移植工作组已将"NK同种异体反应"列入haplo-HSCT供者筛选指南中,但未推荐使用何种方法预测NK细胞同种异体反应性[45]。如何选择KIR/HLA配型模式,以最大程度激活NK细胞同种异体反应性、提高GVL效应,并使患者获得很好的生存质量等问题,仍需要更多临床研究的验证和深入的研究。
所有作者声明无利益冲突































